铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:(已知:FeS2+H2SO4(稀)=FeSO4+H2S↑+S↓)
(1)操作I中为了提高硫酸渣的溶解速度,可采取的措施有____________ ,_________ (任写两种)。
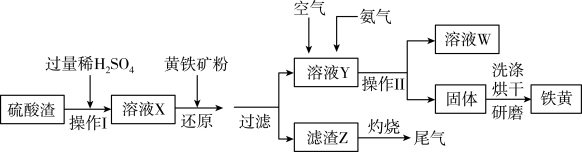
(2)滤液X中加入黄铁矿粉后,发生的还原反应离子方程式为_______________________ ;
(3)操作II中除用到玻璃棒外,还需要的玻璃仪器是____________ ;
(4)在溶液Y中通入空气的目的是____________ ;通入NH3发生的离子反应为___________ 。
(5)验证滤渣Z灼烧的尾气中含有SO2的方法____________________ ;
(6)为了测定制备铁黄中结晶水的含量,进行下列实验。
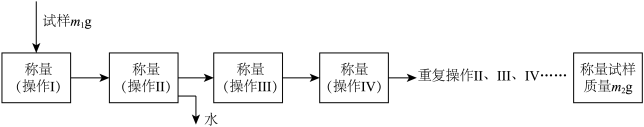
用分析天平准确称量m1g样品置于坩埚中加热、冷却;经过重复操作,当样品质量恒重时,测得质量为m2g,用算式表示出铁黄中结晶水的个数x=_________ 。
(7)拟用酸性高锰酸钾标准溶液滴定某亚铁盐溶液中Fe2+离子的浓度,请写出该反应的离子方程式_______ ,并叙述滴定终点的判断方法____________ 。
(1)操作I中为了提高硫酸渣的溶解速度,可采取的措施有

(2)滤液X中加入黄铁矿粉后,发生的还原反应离子方程式为
(3)操作II中除用到玻璃棒外,还需要的玻璃仪器是
(4)在溶液Y中通入空气的目的是
(5)验证滤渣Z灼烧的尾气中含有SO2的方法
(6)为了测定制备铁黄中结晶水的含量,进行下列实验。

用分析天平准确称量m1g样品置于坩埚中加热、冷却;经过重复操作,当样品质量恒重时,测得质量为m2g,用算式表示出铁黄中结晶水的个数x=
(7)拟用酸性高锰酸钾标准溶液滴定某亚铁盐溶液中Fe2+离子的浓度,请写出该反应的离子方程式
更新时间:2016-12-09 11:14:57
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、D、E、F都是中学化学中的常见物质,已知Y是单质,X是化合物,溶液E中滴入KSCN溶液呈血红色。这些物质间的相互关系如框图所示,根据框图及提示的信息回答下列问题:

(1)Y和X的浓溶液反应的条件是____________ ,若无该条件,反应将很难进行,其原因是_____________________________________________ 。
(2)写出F→G+X的离子方程式_______________________ 。
(3)L转化为I的化学方程式是___________________________________ 。
(4)在试管中制备L,为了能观察到L的颜色,需要进行特殊的操作,该特殊的操作是________________ 。
(5)将Cu放入0.1 mol·L-1Fe(NO3)3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为________ 。

(1)Y和X的浓溶液反应的条件是
(2)写出F→G+X的离子方程式
(3)L转化为I的化学方程式是
(4)在试管中制备L,为了能观察到L的颜色,需要进行特殊的操作,该特殊的操作是
(5)将Cu放入0.1 mol·L-1Fe(NO3)3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】自然资源的开发利用,金属铼(Re)是重要的新兴金属,应用于国防、石油化工以及电子制造等领域,通过还原高铼酸铵(NH4ReO4)可制取金属铼。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流程如下图所示。回答下列问题:
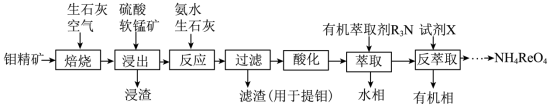
(1)“焙烧”过程加入生石灰的目的___________ 。
(2)“浸出”中,浸出率与温度的关系如下左图所示,浸出率与硫酸浓度的关系如下图所示。工业生产应选择的适宜条件是___________ 。

(3)“萃取”机理为: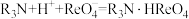 ,则“反萃取”对应的离子方程式为
,则“反萃取”对应的离子方程式为___________ 。
(4)硫酸铼(Ⅳ)铵[(NH4)aReb(SO4)c·mH2O]是制备高纯铼的基础产品,为测定其组成进行如下实验:
①称取3.300g样品配成100mL溶液M。
②取10.00mL溶液M,用0.05mol/L的BaCl2标准溶液滴定,恰好完全沉淀,进行三次平行实验,平均消耗40.00mLBaCl2标准溶液。
③另取10.00mL溶液M,加足量浓NaOH溶液并加热,生成标准状况下气体44.80mL。
通过计算可知铼的物质的量为___________ ,确定硫酸铼铵的化学式为___________ 。

(1)“焙烧”过程加入生石灰的目的
(2)“浸出”中,浸出率与温度的关系如下左图所示,浸出率与硫酸浓度的关系如下图所示。工业生产应选择的适宜条件是

(3)“萃取”机理为:
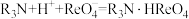 ,则“反萃取”对应的离子方程式为
,则“反萃取”对应的离子方程式为(4)硫酸铼(Ⅳ)铵[(NH4)aReb(SO4)c·mH2O]是制备高纯铼的基础产品,为测定其组成进行如下实验:
①称取3.300g样品配成100mL溶液M。
②取10.00mL溶液M,用0.05mol/L的BaCl2标准溶液滴定,恰好完全沉淀,进行三次平行实验,平均消耗40.00mLBaCl2标准溶液。
③另取10.00mL溶液M,加足量浓NaOH溶液并加热,生成标准状况下气体44.80mL。
通过计算可知铼的物质的量为
您最近一年使用:0次
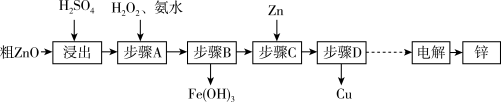
【推荐3】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
已知:几种离子形成氢氧化物沉淀时的pH如下表:
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有_______ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是_______ ,该步骤中加入H2O2发生反应的离子方程式为_______ 。若步骤A中加入H2O2充分反应后,室温下再加入氨水将溶液的pH调为4,求此时Fe3+浓度为_______ 。(已知Ksp[Fe(OH)3]=4.0×10-38)
(3)步骤D的操作名称为_______ 。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全部转化为Na2[Zn(OH)4]溶液,然后将FeO、CuO过滤除去,再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阳极电极反应式为_______ ;阴极电极反应式为_______ 。

已知:几种离子形成氢氧化物沉淀时的pH如下表:
| 待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
| 沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是
(3)步骤D的操作名称为
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全部转化为Na2[Zn(OH)4]溶液,然后将FeO、CuO过滤除去,再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阳极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___________ 。
(2)“矿渣”中除了S以外,还有___________ (填化学式);“回收S”过程中温度控制在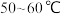 之间,不宜过高或过低的原因是
之间,不宜过高或过低的原因是___________ 。
(3)“保温除铁”过程中,加入CuO的目的是___________ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是___________ 。
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________ ;向“滤液M”中加入(或通入)___________ (填字母代号),可得到另一种流程中可循环利用的物质。
a.铁 b.氯气 c.锰酸钾 d.二氧化氮

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)“矿渣”中除了S以外,还有
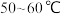 之间,不宜过高或过低的原因是
之间,不宜过高或过低的原因是(3)“保温除铁”过程中,加入CuO的目的是
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为
a.铁 b.氯气 c.锰酸钾 d.二氧化氮
您最近一年使用:0次
【推荐2】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。纳米级Fe3O4有多种不同制法,用共沉淀法制备纳米四氧化三铁的流程如图所示。

(1)下列试剂可以鉴别溶液A 和溶液B的是_______ (填字母)。
a.K2SO4溶液 b.KMnO4溶液 c.NaOH溶液 d盐酸
(2)纳米Fe3O4投入分散剂中形成的分散系是__________ 。
(3)证明沉淀已经洗涤干净的操作是_________ 。
(4)写出生成Fe3O4的离子方程式:______________ 。
(5)实际生产中为提高产率,起始时所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1: 2,原因是_____________ 。

(1)下列试剂可以鉴别溶液A 和溶液B的是
a.K2SO4溶液 b.KMnO4溶液 c.NaOH溶液 d盐酸
(2)纳米Fe3O4投入分散剂中形成的分散系是
(3)证明沉淀已经洗涤干净的操作是
(4)写出生成Fe3O4的离子方程式:
(5)实际生产中为提高产率,起始时所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1: 2,原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是 ,并含少量的
,并含少量的 、
、 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是_______________ 。
(2)写出Fe3+水解的离子方程式_________________ 。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________ 。
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________ 选填序号。
 大理石粉
大理石粉  石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________ 、_______ 、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中 的质量分数不低于
的质量分数不低于__________ 用代数式表示
 ,并含少量的
,并含少量的 、
、 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
(1)将菱锌矿研磨成粉的目的是
(2)写出Fe3+水解的离子方程式
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为
| 沉淀化学式 |  |  |  |  |
| 开始沉淀的pH |  |  |  |  |
| 沉淀完全的pH |  |  |  |  |
| 开始溶解的pH |  |  |  |  |
| Ksp |  |  |  |  |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是
 大理石粉
大理石粉  石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水(5)“滤液4”之后的操作依次为
(6)分析图中数据,菱锌矿粉中
 的质量分数不低于
的质量分数不低于
您最近一年使用:0次
【推荐1】宝鸡被称为中国的钛谷,金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀、高强度、低密度、钛合金与人体具有很好的“相容性”,而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分为钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图所示。已知:钛酸亚铁和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。

请回答下列问题:
(1)金属、金属材料的性质在很大程度上决定了它们的用途,下列关于钛及其合金的说法正确的是___________。
(2)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为:2R+C 2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为
2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为___________
(3)上述生产流程中加入铁屑的目的是_______ ,此时溶液I中含有Fe2+、TiO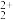 和少量Mg2+等阳离子,常温下,其对应氢氧化物的Ksp如表所示。
和少量Mg2+等阳离子,常温下,其对应氢氧化物的Ksp如表所示。
①常温下,若所得溶液中Mg2+的物质的量浓度为0.18 mol/L,当溶液的pH值等于_______ 时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为__________
③溶液经过冷却、结晶、过滤,得到副产物甲的化学式是____ ,过滤需要的玻璃仪器有_____ 。
(4)Mg还原TiCl4过程必须在1070 K的温度下进行,你认为还应该控制的反应条件是______

请回答下列问题:
(1)金属、金属材料的性质在很大程度上决定了它们的用途,下列关于钛及其合金的说法正确的是___________。
| A.制造人造骨骼 | B.用作保险丝 |
| C.用作航空航天材料 | D.钛可以与金属钠熔合形成合金 |
 2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为
2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为(3)上述生产流程中加入铁屑的目的是
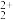 和少量Mg2+等阳离子,常温下,其对应氢氧化物的Ksp如表所示。
和少量Mg2+等阳离子,常温下,其对应氢氧化物的Ksp如表所示。| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为
③溶液经过冷却、结晶、过滤,得到副产物甲的化学式是
(4)Mg还原TiCl4过程必须在1070 K的温度下进行,你认为还应该控制的反应条件是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学学习小组对海水资源综合利用的设计流程如图所示: 等杂质,精制时可选用的试剂如下,请填写添加试剂的合理顺序:
等杂质,精制时可选用的试剂如下,请填写添加试剂的合理顺序:_______ (用试剂的字母表示)。
a.盐酸 b.Na2CO3溶液 c.BaCl2溶液 d.NaOH溶液
(2)上世纪30年代,吴蕴初研发了通过电解饱和食盐水生产盐酸、烧碱和消毒液(丁)的工艺。实验室模拟氯碱工业进行步骤①,写出步骤①对应的离子方程式:_______ 。反应过程中OH-向_____ 极定向移动。步骤②的化学方程式:_______ 。

 等杂质,精制时可选用的试剂如下,请填写添加试剂的合理顺序:
等杂质,精制时可选用的试剂如下,请填写添加试剂的合理顺序:a.盐酸 b.Na2CO3溶液 c.BaCl2溶液 d.NaOH溶液
(2)上世纪30年代,吴蕴初研发了通过电解饱和食盐水生产盐酸、烧碱和消毒液(丁)的工艺。实验室模拟氯碱工业进行步骤①,写出步骤①对应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是__________ 。(选填下面的序号)
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是__________ 。
(3)本实验用加碱沉淀的目的是否能达到?__________ 。原因是__________ 。
(4)加氧化剂的目的为__________ 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________ 。如何操作? __________ 。·

请回答下列问题:
(1)本实验最适合的氧化剂X是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是
(3)本实验用加碱沉淀的目的是否能达到?
(4)加氧化剂的目的为
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,Mr=288}是常用的补铁剂。乳酸亚铁可由乳酸与FeCO3反应制得。
Ⅰ.制备碳酸亚铁(FeCO3)
(1)仪器B的名称是___________ 。
(2)利用如图所示装置进行实验,进行以下两步操作:

第一步:关闭活塞2,依次打开活塞3、1,反应一段时间;
第二步:①___________ ,发现C中有白色沉淀和气体生成。
②要先进行第一步操作,反应一段时间后才能开始第二步操作的原因是___________ 。
③C中反应生成白色沉淀的离子方程式是___________ 。
④仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀,检验其是否洗净的方法是___________ (填操作,现象和结论)。
Ⅱ.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70 ℃下搅拌使反应充分进行,静置一段时间后过滤,再经操作a,得到乳酸亚铁晶体,洗涤,干燥后得到产品。操作a的步骤包括(填操作过程)___________ 。
Ⅰ.制备碳酸亚铁(FeCO3)
(1)仪器B的名称是
(2)利用如图所示装置进行实验,进行以下两步操作:

第一步:关闭活塞2,依次打开活塞3、1,反应一段时间;
第二步:①
②要先进行第一步操作,反应一段时间后才能开始第二步操作的原因是
③C中反应生成白色沉淀的离子方程式是
④仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀,检验其是否洗净的方法是
Ⅱ.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70 ℃下搅拌使反应充分进行,静置一段时间后过滤,再经操作a,得到乳酸亚铁晶体,洗涤,干燥后得到产品。操作a的步骤包括(填操作过程)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0,回答下列问题:
(1)仪器①的名称为_______ ,装置己中盛放的试剂为_______ 。
(2)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_______ →FG←_______ ←KJ←B (按气流方向,用大写字母表示)。
(3)反应结束后,从反应后的混合物中分离出产品的实验操作是_______ ,戊中气球的作用是_______ 。

(1)仪器①的名称为
(2)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→
(3)反应结束后,从反应后的混合物中分离出产品的实验操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
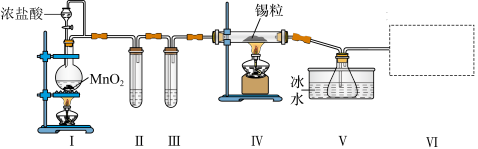
已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。
请根据上图装置回答:
(1)装置I中反应的离子方程式是________________________________________
(2)试管II中的试剂是________ ,试管III中的试剂是____________ 。
(3)装置V的作用是____________ 。
(4)装置Ⅵ 最好选用下列装置中的________ (填标号)。
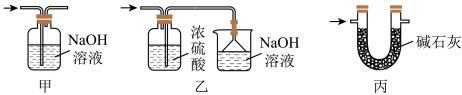
(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________ 。

已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。
请根据上图装置回答:
(1)装置I中反应的离子方程式是
(2)试管II中的试剂是
(3)装置V的作用是
(4)装置Ⅵ 最好选用下列装置中的

(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有
您最近一年使用:0次



