乙酰水杨酸,俗称阿司匹林(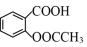 ),是常用的解热镇痛药。实验室合成流程如图:
),是常用的解热镇痛药。实验室合成流程如图:

查阅资料得以下信息:
阿司匹林:受热易分解,溶于乙醇、难溶于水;水杨酸(邻羟基苯甲酸):溶于乙醇、微溶于水;醋酸酐[(CH3CO)2O]:无色透明液体,溶于水形成乙酸。请根据以上信息回答下列问题:
(1)①书写该流程中合成阿司匹林的反应方程式:_______ 。
②合成阿司匹林时,下列几种加热方式中最合适的是_______ 。
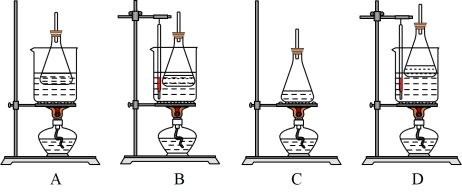
③合成阿司匹林使用的锥形瓶必须干燥的原因是_______ 。
(2)提纯粗产物中加入饱和 NaHCO3溶液至没有 CO2产生为止,再抽滤。加入饱和 NaHCO3溶液的主要化学反应方程式为_______ 。
(3)另一种改进的提纯方法,称为重结晶提纯法。

①最后步骤中洗涤剂最好选择_______ 。
A.15%的乙醇溶液 B.NaOH 溶液 C.冷水 D.滤液
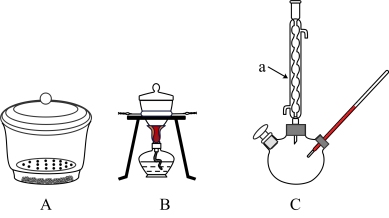
②图中装置在上述流程中肯定用不到的是_______ ,其中装置C中的a名称为_______ 。
 ),是常用的解热镇痛药。实验室合成流程如图:
),是常用的解热镇痛药。实验室合成流程如图:
查阅资料得以下信息:
阿司匹林:受热易分解,溶于乙醇、难溶于水;水杨酸(邻羟基苯甲酸):溶于乙醇、微溶于水;醋酸酐[(CH3CO)2O]:无色透明液体,溶于水形成乙酸。请根据以上信息回答下列问题:
(1)①书写该流程中合成阿司匹林的反应方程式:
②合成阿司匹林时,下列几种加热方式中最合适的是

③合成阿司匹林使用的锥形瓶必须干燥的原因是
(2)提纯粗产物中加入饱和 NaHCO3溶液至没有 CO2产生为止,再抽滤。加入饱和 NaHCO3溶液的主要化学反应方程式为
(3)另一种改进的提纯方法,称为重结晶提纯法。

①最后步骤中洗涤剂最好选择
A.15%的乙醇溶液 B.NaOH 溶液 C.冷水 D.滤液
②图中装置在上述流程中肯定用不到的是

更新时间:2021-02-01 12:01:28
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
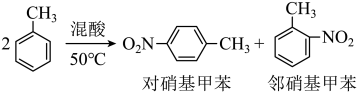
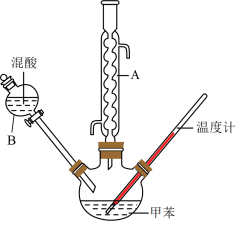
【推荐1】一硝基甲苯是一种重要的工业原料,某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯),反应原理如图:
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL。
②在三颈烧瓶中加入13g甲苯(易挥发),按如图所示装置装好药品和其他仪器。
③向三颈烧瓶中加入混酸。
④控制温度约为50℃,反应大约10min至三颈烧瓶底部有大量淡黄色油状液体出现。
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
(1)实验过程中常采用的控温方法___________ ;实验前混酸该如何配制___________ 。
(2)仪器A的作用为___________ ,下口为___________ (选填“出水”或“进水”)口,仪器B的名称为___________ 。
分离产物的方案如图:___________ ,操作VI的名称为___________ 。
(4)操作Ⅲ中加入5%NaOH溶液的目的是___________ ,操作V中加入无水CaCl2的目的是___________ 。
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL。
②在三颈烧瓶中加入13g甲苯(易挥发),按如图所示装置装好药品和其他仪器。
③向三颈烧瓶中加入混酸。
④控制温度约为50℃,反应大约10min至三颈烧瓶底部有大量淡黄色油状液体出现。
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
| 有机物 | 密度(g/cm3) | 沸点(°C) | 溶解性 |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)实验过程中常采用的控温方法
(2)仪器A的作用为
分离产物的方案如图:
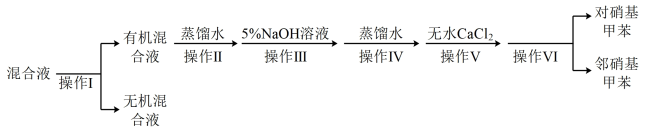
(4)操作Ⅲ中加入5%NaOH溶液的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】高铁酸钾( )是一种高效、多功能的新型非氯绿色消毒剂,主要用于饮水处理,化工生产中作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂。某实验小组利用如图装置和药品制备高铁酸钾并探究其性质。已知:
)是一种高效、多功能的新型非氯绿色消毒剂,主要用于饮水处理,化工生产中作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂。某实验小组利用如图装置和药品制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性,易溶于水、微溶于浓碱溶液、不溶于乙醇,在
为紫色固体,具有强氧化性,易溶于水、微溶于浓碱溶液、不溶于乙醇,在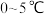 的强碱性溶液中较稳定。
的强碱性溶液中较稳定。
(1)制备 (部分夹持装置略)
(部分夹持装置略)
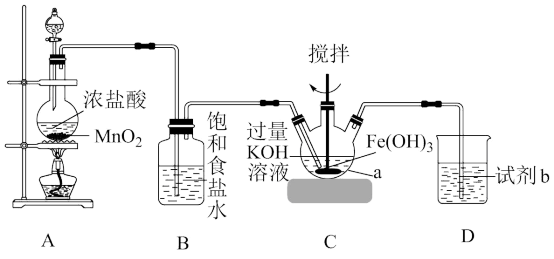
①仪器 的名称是
的名称是_______ 。
②装置A为实验室制取氯气的装置,装置A中发生反应的离子方程式为_______ 。
③在搅拌下,将 通入含
通入含 的悬浊液(含
的悬浊液(含 )中即可制取
)中即可制取 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
④下列试剂中,试剂b的最佳选择是_______ (填标号)。
A.氢氧化钠溶液 B.澄清石灰水 C.浓硫酸 D.浓氨水
(2)制备的高铁酸钾粗产品中含有氢氧化钾、氯化钾、氢氧化铁等杂质,请完成提纯高铁酸钾的实验设计(实验药品:蒸馏水、乙醇、饱和 溶液、饱和
溶液、饱和 溶液、冷的
溶液、冷的 稀溶液)。提纯高铁酸钾的实验步骤:①取一定量的高铁酸钾粗产品,溶于
稀溶液)。提纯高铁酸钾的实验步骤:①取一定量的高铁酸钾粗产品,溶于_______ 中;②过滤除去_______ (填化学式),取滤液将其置于冰水浴中,向滤液中加入饱和 溶液;③搅拌、静置、过滤,用
溶液;③搅拌、静置、过滤,用_______ 洗涤 次;④在真空干燥箱中干燥。
次;④在真空干燥箱中干燥。
(3) 性质探究
性质探究
①取少量提纯后的晶体于烧杯中,加入足量 溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是
溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是_______ (填化学式)。
②根据 的制备实验得出氧化性:
的制备实验得出氧化性:
_______ (填“>”或“<”) ,而步骤①中实验表明,
,而步骤①中实验表明, 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是_______ 。
③ 时,
时,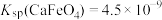 ,若要使
,若要使 溶液中的
溶液中的 完全沉淀[
完全沉淀[ 视为沉淀完全],理论上要加入
视为沉淀完全],理论上要加入 的
的
_______  (忽略溶液体积变化)。
(忽略溶液体积变化)。
 )是一种高效、多功能的新型非氯绿色消毒剂,主要用于饮水处理,化工生产中作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂。某实验小组利用如图装置和药品制备高铁酸钾并探究其性质。已知:
)是一种高效、多功能的新型非氯绿色消毒剂,主要用于饮水处理,化工生产中作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂。某实验小组利用如图装置和药品制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性,易溶于水、微溶于浓碱溶液、不溶于乙醇,在
为紫色固体,具有强氧化性,易溶于水、微溶于浓碱溶液、不溶于乙醇,在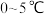 的强碱性溶液中较稳定。
的强碱性溶液中较稳定。(1)制备
 (部分夹持装置略)
(部分夹持装置略)
①仪器
 的名称是
的名称是②装置A为实验室制取氯气的装置,装置A中发生反应的离子方程式为
③在搅拌下,将
 通入含
通入含 的悬浊液(含
的悬浊液(含 )中即可制取
)中即可制取 ,写出该反应的化学方程式:
,写出该反应的化学方程式:④下列试剂中,试剂b的最佳选择是
A.氢氧化钠溶液 B.澄清石灰水 C.浓硫酸 D.浓氨水
(2)制备的高铁酸钾粗产品中含有氢氧化钾、氯化钾、氢氧化铁等杂质,请完成提纯高铁酸钾的实验设计(实验药品:蒸馏水、乙醇、饱和
 溶液、饱和
溶液、饱和 溶液、冷的
溶液、冷的 稀溶液)。提纯高铁酸钾的实验步骤:①取一定量的高铁酸钾粗产品,溶于
稀溶液)。提纯高铁酸钾的实验步骤:①取一定量的高铁酸钾粗产品,溶于 溶液;③搅拌、静置、过滤,用
溶液;③搅拌、静置、过滤,用 次;④在真空干燥箱中干燥。
次;④在真空干燥箱中干燥。(3)
 性质探究
性质探究①取少量提纯后的晶体于烧杯中,加入足量
 溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是
溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是②根据
 的制备实验得出氧化性:
的制备实验得出氧化性:
 ,而步骤①中实验表明,
,而步骤①中实验表明, 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是③
 时,
时,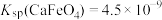 ,若要使
,若要使 溶液中的
溶液中的 完全沉淀[
完全沉淀[ 视为沉淀完全],理论上要加入
视为沉淀完全],理论上要加入 的
的
 (忽略溶液体积变化)。
(忽略溶液体积变化)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
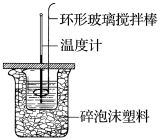
【推荐3】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_______ 。
(2)倒入NaOH溶液的正确操作是_______ (填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号)。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_______ 。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1.为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ (结果保留一位小数)。
(6)_______ (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______ 。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号)。
| A.用温度计小心搅拌 |
| B.揭开硬纸片用玻璃棒搅拌 |
| C.轻轻地振荡烧杯 |
| D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动 |
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1.为了计算中和热,某学生实验记录数据如下:
| 起始温度t1/℃ | 终止温度t2/℃ | ||
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(6)
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1 ②1∶1∶2 ∶6 ③3∶2 ④3∶2∶2∶2∶1 ,请分别推断出其对应的结构:
①_______________________________ ; ②______________________________ ;
③_______________________________ ; ④______________________________ 。
(2)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水; ②氢氧化钠; ③溴水; ④酸性高锰酸钾
分离装置:A.分液装置; B.蒸馏装置; C.洗气装置;
①
③
(2)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水; ②氢氧化钠; ③溴水; ④酸性高锰酸钾
分离装置:A.分液装置; B.蒸馏装置; C.洗气装置;
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | ||
| 乙醇(乙酸) |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】侯氏制碱法是中国传统工业方法,此方法制备Na2CO3一直在工业上沿用至今。其原理如下:① NH3 + H2O + CO2 = NH4HCO3 ② NH4HCO3 + NaCl = NH4Cl + NaHCO3↓ ③ 2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ. 制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中反应的化学方程式为___________________ 。
(2)装置乙中加入的试剂是_____________ ,其作用是________________ ,为防止污染空气,尾气需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作名称有________________________ 。
Ⅱ. 测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为_______________ 。
 Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ. 制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中反应的化学方程式为
(2)装置乙中加入的试剂是
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作名称有
Ⅱ. 测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
样品中含NaHCO3 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】苯胺( )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:① 和
和 相似,与盐酸反应生成易溶于水的盐(
相似,与盐酸反应生成易溶于水的盐( );
);
②用硝基苯制取苯胺的反应原理:2 +3Sn+12HCl→2
+3Sn+12HCl→2 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质如表:
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为___________ ;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是___________ 。
Ⅱ.制备苯胺。往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20 mL浓盐酸(过量),置于热水浴中回流20 min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。

(2)冷凝管的出水口是___________ (填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为___________ 。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示的装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
ⅲ.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79 g。

(4)图2中B装置的名称为___________ ;操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是___________ 。
(5)该实验中苯胺的产率为___________ 。
(6)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:___________ 。
 )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。已知:①
 和
和 相似,与盐酸反应生成易溶于水的盐(
相似,与盐酸反应生成易溶于水的盐( );
);②用硝基苯制取苯胺的反应原理:2
 +3Sn+12HCl→2
+3Sn+12HCl→2 +3SnCl4+4H2O
+3SnCl4+4H2O③有关物质的部分物理性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/( ) ) |
| 苯胺 | -6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
| 硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
| 乙醚 | -116.2 | 34.6 | 微溶于水 | 0.7134 |
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为
Ⅱ.制备苯胺。往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20 mL浓盐酸(过量),置于热水浴中回流20 min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。

(2)冷凝管的出水口是
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示的装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
ⅲ.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79 g。

(4)图2中B装置的名称为
(5)该实验中苯胺的产率为
(6)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) NaHSO4+ HBr
NaHSO4+ HBr
CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。

回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________ 。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______ (填序号)
A.NaOH溶液B.H2O
C.Na2SO3溶液D.CCl4
分离时所需的主要玻璃仪器是______________ (填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________ (填操作名称)。
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL溴乙烷,将试管如图固定后,加热。试管口安装一长导管的作用是_________ 。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式_____________________________________________ 。
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________ ,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________ 。

I.已知:NaBr+H2SO4(浓)
 NaHSO4+ HBr
NaHSO4+ HBrCH3CH2OH+HBr
 CH3CH2Br+H2O
CH3CH2Br+H2O溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。

回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:
A.NaOH溶液B.H2O
C.Na2SO3溶液D.CCl4
分离时所需的主要玻璃仪器是
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL溴乙烷,将试管如图固定后,加热。试管口安装一长导管的作用是
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】在试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上。在试管②中加入5 mL Na2CO3饱和溶液,按图示装置连接。用酒精灯对试管①加热,当观察到试管②中有明显现象时,停止实验。
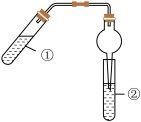
请回答下列问题:
(1)写出①中主要反应的化学方程式:______________ 。
(2)加入浓硫酸的目的是___________ 。
(3)试管②中观察到的现象是__________________ 。
(4)该实验中球形干燥管除起冷凝作用外,另一重要作用是_______ ,原因是____________ 。

请回答下列问题:
(1)写出①中主要反应的化学方程式:
(2)加入浓硫酸的目的是
(3)试管②中观察到的现象是
(4)该实验中球形干燥管除起冷凝作用外,另一重要作用是
您最近一年使用:0次



