按要求填空
I.某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:___________ 与盐酸反应最剧烈,___________ 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________ 。
II.甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入1mol/L的H2SO4溶液中,乙同学将两电极放入6mol/L的NaOH溶液中,装置如图所示。

(1)①中负极材料为___________ 。②中负极材料为___________ 。
(2)写出①中发生的正极反应式:___________ 。
I.某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
II.甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入1mol/L的H2SO4溶液中,乙同学将两电极放入6mol/L的NaOH溶液中,装置如图所示。

(1)①中负极材料为
(2)写出①中发生的正极反应式:
更新时间:2021-04-02 15:45:24
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】人类的一切活动都离不开能量,人们不仅利用化学反应获得新物质,也需从化学反应中获得能量。回答下列问题:
Ⅰ、键能是指在1 × 105 Pa、298 K时,将1 mol气态分子分离成气态原子所需要的能量,其单位为kJ·mol−1,已知H—H的键能为436 kJ·mol−1;N≡N的键能为946 kJ·mol−1;N—H的键能为391 kJ·mol−1。
(1)NH3的电子式为___________ 。
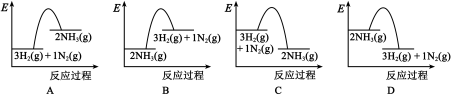
(2)在1 × 105 Pa、298 K时,生成2 mol NH3(g),吸收或放出的热量为Q kJ,则Q =___________ ,能正确表示该过程的能量变化的是___________ (填标号)。
Ⅱ、电化学气敏传感器可用于监测空气中的污染物,空气中NH3的含量监测原理如图所示。
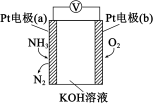
(3)正极为___________ (填“a”或“b”)电极,负极发生的电极反应式为___________ ,原电池总反应方程式为___________ 。
(4)溶液中OH−向电极___________ (填“a”或“b”)移动,电池工作一段时间后,溶液c(OH−)___________ (填“变大”“变小”或“不变”)。
(5)当转移电子数为6.02 × 1023时,被还原的气体的质量为___________ g。
Ⅰ、键能是指在1 × 105 Pa、298 K时,将1 mol气态分子分离成气态原子所需要的能量,其单位为kJ·mol−1,已知H—H的键能为436 kJ·mol−1;N≡N的键能为946 kJ·mol−1;N—H的键能为391 kJ·mol−1。
(1)NH3的电子式为
(2)在1 × 105 Pa、298 K时,生成2 mol NH3(g),吸收或放出的热量为Q kJ,则Q =

Ⅱ、电化学气敏传感器可用于监测空气中的污染物,空气中NH3的含量监测原理如图所示。

(3)正极为
(4)溶液中OH−向电极
(5)当转移电子数为6.02 × 1023时,被还原的气体的质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1
反应ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
根据反应ⅰ和反应ⅱ,推出CO(g)和H2(g)合成甲醇的热化学方程式为_______ 。
(2)在催化剂M的作用下,CO2(g)+H2(g) CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示C,
表示C, 表示O,
表示O, 表示H。
表示H。
历程Ⅰ: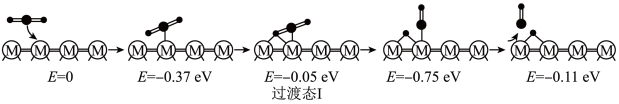
反应甲:CO2(g)=CO(g)+O*
历程Ⅱ: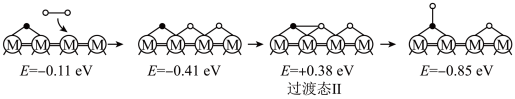
反应乙:H2(g)+O*=HO*+H*
历程Ⅲ: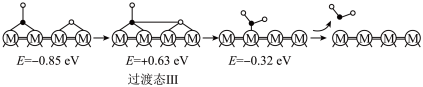
反应丙:_______
①历程Ⅲ中的反应丙可表示为_______ 。
②决定CO2(g)+H2(g) CO(g)+H2O(g)的总反应速率的是历程
CO(g)+H2O(g)的总反应速率的是历程_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(3)将CO2和H2按物质的量之比1:3充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。
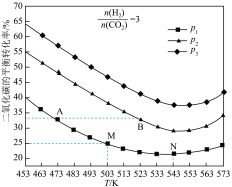
①压强p1、p2、p3 的大小关系为_______ 。
②A点、B点的化学反应速率大小:v(A)_______ v(B) (填“<”、“=”或“>”)。
③温度高于543K时,CO2的平衡转化率随温度的升高而增大的原因是_______ 。
④图中M点对应的温度下,已知CO的选择性(生成的CO与转化的CO2的百分比)为50%,该温度下反应ii的平衡常数为_______ (结果保留3位小数)。
如图是某科研团队设计的光电催化反应器,可由CO2制得异丙醇,其中A、B均是惰性电极。
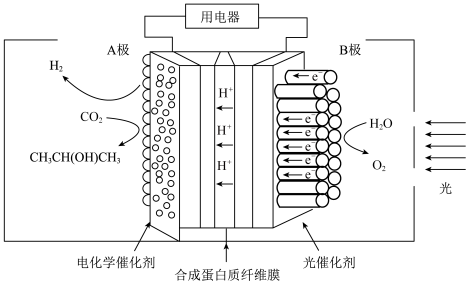
(4)B电极为该电化学装置的_______ 极。
(5)A极上CO2参与的电极反应式为_______ 。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1反应ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1根据反应ⅰ和反应ⅱ,推出CO(g)和H2(g)合成甲醇的热化学方程式为
(2)在催化剂M的作用下,CO2(g)+H2(g)
 CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示C,
表示C, 表示O,
表示O, 表示H。
表示H。历程Ⅰ:

反应甲:CO2(g)=CO(g)+O*
历程Ⅱ:

反应乙:H2(g)+O*=HO*+H*
历程Ⅲ:

反应丙:_______
①历程Ⅲ中的反应丙可表示为
②决定CO2(g)+H2(g)
 CO(g)+H2O(g)的总反应速率的是历程
CO(g)+H2O(g)的总反应速率的是历程(3)将CO2和H2按物质的量之比1:3充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。

①压强p1、p2、p3 的大小关系为
②A点、B点的化学反应速率大小:v(A)
③温度高于543K时,CO2的平衡转化率随温度的升高而增大的原因是
④图中M点对应的温度下,已知CO的选择性(生成的CO与转化的CO2的百分比)为50%,该温度下反应ii的平衡常数为
如图是某科研团队设计的光电催化反应器,可由CO2制得异丙醇,其中A、B均是惰性电极。

(4)B电极为该电化学装置的
(5)A极上CO2参与的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】如图所示的过程是目前直接利用太阳能的研究热点,人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在如图构想的物质和能量循环中,太阳能最终转化为_______ 能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为甲醇(CH3OH),该反应的化学方程式为2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
用O2表示0~3 min内该反应的平均反应速率为_______ mol/(L·min)。
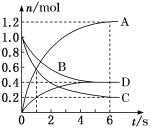
(3)一定温度下,向容积为2 L的密闭容器中通入两种气体并发生反应,反应中各物质的物质的量的变化如图所示。试写出该反应的化学方程式为_______ 。
(4)用人工光合作用得到的甲醇、氧气和KOH溶液制作燃料电池,其电极反应分别为:CH3OH+8OH--6e-=CO +6H2O;O2+2H2O+4e-=4OH-。则甲醇应通入该燃料电池的
+6H2O;O2+2H2O+4e-=4OH-。则甲醇应通入该燃料电池的_______ 极(填“正”或“负”),通入氧气的一极发生_______ 反应(填:氧化或还原)。当通入6.72 L O2(在标准状况下)完全反应后,消耗甲醇的质量为_______ 。

(1)在如图构想的物质和能量循环中,太阳能最终转化为
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为甲醇(CH3OH),该反应的化学方程式为2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CH3OH)/mol | 0 | 0.040 | 0.070 | 0.080 | 0.085 | 0.085 |
用O2表示0~3 min内该反应的平均反应速率为
(3)一定温度下,向容积为2 L的密闭容器中通入两种气体并发生反应,反应中各物质的物质的量的变化如图所示。试写出该反应的化学方程式为

(4)用人工光合作用得到的甲醇、氧气和KOH溶液制作燃料电池,其电极反应分别为:CH3OH+8OH--6e-=CO
 +6H2O;O2+2H2O+4e-=4OH-。则甲醇应通入该燃料电池的
+6H2O;O2+2H2O+4e-=4OH-。则甲醇应通入该燃料电池的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________ 。
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________ 。
A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。
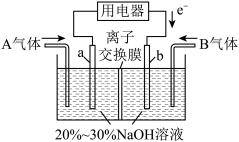
①b极的电极反应式为______________________ 。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____ mL(气体处于标准状况;假设电解过程中溶液体积不变)。
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) ∆H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________ 。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________ 。已知常温下.Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq) NaNO2(aq)+H2O(1)的平衡常数为
NaNO2(aq)+H2O(1)的平衡常数为________ 。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。

①b极的电极反应式为
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) ∆H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为
 NaNO2(aq)+H2O(1)的平衡常数为
NaNO2(aq)+H2O(1)的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =+67.7kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)⇌1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______ 。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,燃料电池放电时的负极反应为:______ 。如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______ mol。
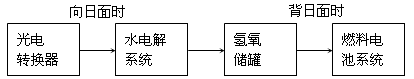
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e- = O2↑+2H2O,则阴极反应为:______ 。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?______ ,理由是:______ 。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =+67.7kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)⇌1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,燃料电池放电时的负极反应为:

(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e- = O2↑+2H2O,则阴极反应为:
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】)常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

① 沸腾氯化炉中发生的主要反应为:_____________ 。
② 已知:Ti (s)+2Cl2(g)=TiCl4(l) △H=akJ/mol;
2Na(s)+Cl2(g)=2NaCl(s) △H=bkJ/mol;
Na(s) = Na (l) △H=ckJ/mol
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s) △H=________ kJ/mol
③ TiCl4遇水强烈水解,写出其水解的化学方程式________ 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示。二氧化钛电极连接电源_____ 极,该极电极反应为__________ 。

(3)若以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,多孔石墨为电极构成的燃料电池提供上述电解的电源,则该电池工作时负极的电极反应式为____________ 。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

① 沸腾氯化炉中发生的主要反应为:
② 已知:Ti (s)+2Cl2(g)=TiCl4(l) △H=akJ/mol;
2Na(s)+Cl2(g)=2NaCl(s) △H=bkJ/mol;
Na(s) = Na (l) △H=ckJ/mol
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s) △H=
③ TiCl4遇水强烈水解,写出其水解的化学方程式
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示。二氧化钛电极连接电源

(3)若以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,多孔石墨为电极构成的燃料电池提供上述电解的电源,则该电池工作时负极的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】下表列出了①~⑨九种元素在周期表中的位置。
请按要求回答下列问题:
(1)元素⑧的原子结构示意图:___________ ,元素⑥与⑨组成的化合物的电子式:___________ 。
(2)元素⑥~⑨中原子半径最小的是___________ (填元素符号)。
(3)元素①~⑨中化学性质最不活泼的是___________ (填元素符号)。
(4)元素③和④的气态氢化物中,稳定性较强的是___________ (填化学式)。
(5)元素⑥和⑦的最高价氧化物对应的水化物分别为X和Y,其中碱性较强的是___________ (填化学式),X和Y反应的离子方程式:___________ 。
(6)元素①与②所形成的最简单有机物的空间结构是___________ 。元素①与②所形成的最简单烯烃为Z,写出Z与水在催化剂、加热、加压条件下反应的化学方程式:___________ ,该反应生成物的官能团是___________ (填名称),反应类型为___________ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)元素⑧的原子结构示意图:
(2)元素⑥~⑨中原子半径最小的是
(3)元素①~⑨中化学性质最不活泼的是
(4)元素③和④的气态氢化物中,稳定性较强的是
(5)元素⑥和⑦的最高价氧化物对应的水化物分别为X和Y,其中碱性较强的是
(6)元素①与②所形成的最简单有机物的空间结构是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】2019年诺贝尔化学奖发给了三位在开发锂离子电池方面作出的杰出贡献的化学家。完成下列填空:
(1)锂在元素周期表的位置是___ 。锂原子核外能量最高的电子所处的轨道是___ 。
(2)写出一条判断锂与相邻同主族金属元素金属性强弱的实验依据:___ 。
(3)氢化锂(LiH)是离子化合物,写出其电子式___ ,LiH中阴离子半径大于阳离子半径,其原因是___ 。
LiBr可作锂电池中电解质材料。用Li2CO3,氨水和液溴制备LiBr•H2O的流程如图:

(4)合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:___ 。
 LiCO3+
LiCO3+ Br2+
Br2+ NH3·H2O→
NH3·H2O→ LiBr+___。
LiBr+___。
画出该反应所涉及物质中属于非电解质的电子式___ 。
(5)溴化锂的溶解度随温度变化曲线如图所示:

从溶液中得到LBr·H2O晶体的实验步骤依次为:___ ,___ ,过滤,用乙醇洗涤,干燥。
(1)锂在元素周期表的位置是
(2)写出一条判断锂与相邻同主族金属元素金属性强弱的实验依据:
(3)氢化锂(LiH)是离子化合物,写出其电子式
LiBr可作锂电池中电解质材料。用Li2CO3,氨水和液溴制备LiBr•H2O的流程如图:

(4)合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
 LiCO3+
LiCO3+ Br2+
Br2+ NH3·H2O→
NH3·H2O→ LiBr+___。
LiBr+___。画出该反应所涉及物质中属于非电解质的电子式
(5)溴化锂的溶解度随温度变化曲线如图所示:

从溶液中得到LBr·H2O晶体的实验步骤依次为:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】W、X、Y、Z四种短周期元素的原子序数 。四种元素原子结构描述如下:
。四种元素原子结构描述如下:
(1)根据上述信息Z元素基态原子中能量最高的电子,其电子云在空间有___________ 个伸展方向,轨道呈___________ 形。
(2)元素W位于元素周期表的第___________ 周期第___________ 族,该原子的价电子轨道表示式为___________ 。
(3)Y、Z的电负性:___________ >___________ (填元素符号),两元素形成的化合物的电子式___________ 。
(4)X的基态原子核外电子排布式为___________ ,该元素位于元素周期表的___________ 区。
(5)下列事实能证明W的活泼性大于X的事实是___________。
 。四种元素原子结构描述如下:
。四种元素原子结构描述如下:| X | 原子核外s电子与p电子数之比为 |
| W | 原子的最外层没有p电子,且同周期中第一电离能最小 |
| Y | 原子最外层s电子与p电子数之比为 |
| Z | 原子核外电子中p电子数比Y原子多2个 |
(2)元素W位于元素周期表的第
(3)Y、Z的电负性:
(4)X的基态原子核外电子排布式为
(5)下列事实能证明W的活泼性大于X的事实是___________。
| A.W能与冷水反应,而X不能 | B.W最外层有一个电子,X最外层有两个电子 |
C.碱性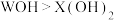 | D.W能从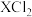 的溶液中把X置换出来 的溶液中把X置换出来 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、W、M、N、P为元素周期表前20号主族元素,Y原子最外层电子数为其内层电子数的一半,Z的原子序数为8,M的焰色为黄色,N与Z同主族,P是人体含量最多的金属元素,其中元素的原子序数和原子半径的关系如图所示,请回答下列问题:
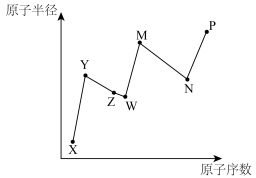
(1)Y为_______ (填元素名称);非金属性:W_______ (填“>”或“<”,下同)N;简单离子半径:Y_______ W。
(2)单质M与X2Z反应的化学方程式为______ ,该反应的还原产物为_______ (填化学式)。
(3)MX可用作金属氯化物的还原剂、有机合成的还原剂、加氢剂、缩合剂,该化合物熔融状态下能导电。MX为_______ (填“离子”或“共价”)化合物,用电子式表示MX的形成过程:_______ 。
(4)下列说法正确的是_______ (填标号)。
a.最高价氧化物对应水化物的碱性:Y>M
b.X2与W2在暗处混合后会剧烈反应并发生爆炸
c.P与水反应时部分生成物会覆盖在P表面,可能导致P与水反应的剧烈程度不如M
d.Y在Z2中燃烧的产物为YZ2

(1)Y为
(2)单质M与X2Z反应的化学方程式为
(3)MX可用作金属氯化物的还原剂、有机合成的还原剂、加氢剂、缩合剂,该化合物熔融状态下能导电。MX为
(4)下列说法正确的是
a.最高价氧化物对应水化物的碱性:Y>M
b.X2与W2在暗处混合后会剧烈反应并发生爆炸
c.P与水反应时部分生成物会覆盖在P表面,可能导致P与水反应的剧烈程度不如M
d.Y在Z2中燃烧的产物为YZ2
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】短周期主族元素①~⑩在元素周期表中的位置如图所示。
(1)元素⑦在元素周期表中的位置是_______ 。
(2)元素③④⑦⑧形成的简单离子,其半径由小到大的顺序是_______ (写离子符号)。
(3)用电子式表示元素③和⑩形成化合物的过程:_______ 。
(4)元素①~⑩的最高价氧化物对应的水化物中:酸性最强的是_______ (填化学式);碱性最强的物质的电子式是_______ ,该碱与元素④的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)用化学方程式表示元素的⑨的非金属性强于⑦:_______ 。
(6)表中元素⑥和⑨可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式是_______ 。
| ① | |||||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
| ② | ③ | ④ | ⑧ | ⑩ | |||
(2)元素③④⑦⑧形成的简单离子,其半径由小到大的顺序是
(3)用电子式表示元素③和⑩形成化合物的过程:
(4)元素①~⑩的最高价氧化物对应的水化物中:酸性最强的是
(5)用化学方程式表示元素的⑨的非金属性强于⑦:
(6)表中元素⑥和⑨可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】元素周期律是自然科学的基本规律,也是无机化学的基础.下图为现代元素周期表的一部分,请回答下列问题:
(1)⑤和⑥的最高价氧化物对应的水化物相互反应的化学方程式为:___________ ;
(2)③、④、⑥、⑧的简单离子半径由大到小依次为___________ (用离子符号表示);
(3)由②的最低负价氢化物与最高正价氧化物的水化物反应所生成的物质中,所含化学键类型有:___________ 、___________ ;
(4)元素①②③④形成的简单气态氢化物的稳定性由弱到强的顺序排列为:___________ (用化学式表示)。
(5)某盐由③⑤⑦三种元素组成,向其水溶液中通入少量二氧化碳气体,出现白色胶状沉淀,写出该反应的离子方程式__________________________________ ;
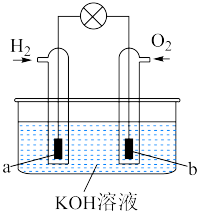
(6)氢气和③的单质可以作为燃料电池的两个电极反应气体,其装置如图所示_____ 极(填“正”或“负”),该电极上发生________ 反应(填“氧化”或“还原”);b极发生的电极反应方程式是__________________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
(1)⑤和⑥的最高价氧化物对应的水化物相互反应的化学方程式为:
(2)③、④、⑥、⑧的简单离子半径由大到小依次为
(3)由②的最低负价氢化物与最高正价氧化物的水化物反应所生成的物质中,所含化学键类型有:
(4)元素①②③④形成的简单气态氢化物的稳定性由弱到强的顺序排列为:
(5)某盐由③⑤⑦三种元素组成,向其水溶液中通入少量二氧化碳气体,出现白色胶状沉淀,写出该反应的离子方程式
(6)氢气和③的单质可以作为燃料电池的两个电极反应气体,其装置如图所示
您最近一年使用:0次



