硫酸镍(NiSO4)主要用于电镀工业,是电镀镍和化学镍的主要镍盐。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,从该矿渣中回收NiSO4的工艺流程如下:

(1)“焙烧”时发生多个反应,其中NiFe2O4生成NiSO4、Fe2(SO4)3,发生该反应的化学方程式为___________ 。
(2)“浸泡”时用“95℃热水”的目的是___________ ,“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___________ 。
(3)“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________ (填化学式),为检验浸出液中是否含有Fe3+,可选用的化学试剂是___________ 。
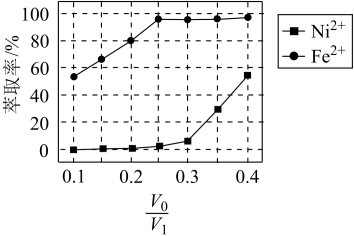
(4)“萃取"过程中发生反应Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值为___________ ;在___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(1)“焙烧”时发生多个反应,其中NiFe2O4生成NiSO4、Fe2(SO4)3,发生该反应的化学方程式为
(2)“浸泡”时用“95℃热水”的目的是
(3)“浸渣”的成分除Fe2O3、FeO(OH)外还含有
(4)“萃取"过程中发生反应Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值为
更新时间:2021-05-12 09:55:20
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】离子反应是中学化学中重要的反应类型。
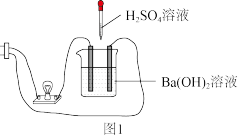
【实验】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计如图1所示实验:
(1)完成下表空白处。
【实验拓展】已知某无色透明溶液中可能含有下列离子中的若干种:K+、Mg2+、Fe3+、Ba2+、SO 、OH-、CO
、OH-、CO 和Cl-,现取该溶液进行如下实验:(已知AgOH为白色沉淀)
和Cl-,现取该溶液进行如下实验:(已知AgOH为白色沉淀)
Ⅰ.取少量原溶液,滴入紫色石蕊试液,溶液呈蓝色;
Ⅱ.取少量原溶液,滴入BaCl2溶液,无明显现象;
Ⅲ.取少量原溶液,先滴加足量稀硝酸,再加入AgNO3溶液,有白色沉淀产生;
Ⅳ.取少量原溶液,滴入少量稀H2SO4,有白色沉淀产生。
(2)某同学提出,不用实验即可判断原溶液中不存在的离子是_______ (填离子符号,下同)。
(3)由Ⅱ可以判断出原溶液中不存在的离子是_______ 。
(4)Ⅲ是为了判断_______ 离子的存在,先滴加足量稀硝酸的目的是_______ 。写出Ⅲ中发生反应的离子方程式_______
(5)原溶液中一定含有的离子是_______ (填离子符号)。
【实验】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计如图1所示实验:

(1)完成下表空白处。
| 实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入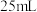 一定浓度的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加一定浓度的H2SO4溶液直至过量,边滴加边振荡 一定浓度的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加一定浓度的H2SO4溶液直至过量,边滴加边振荡 | 产生白色沉淀, | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
【实验拓展】已知某无色透明溶液中可能含有下列离子中的若干种:K+、Mg2+、Fe3+、Ba2+、SO
 、OH-、CO
、OH-、CO 和Cl-,现取该溶液进行如下实验:(已知AgOH为白色沉淀)
和Cl-,现取该溶液进行如下实验:(已知AgOH为白色沉淀)Ⅰ.取少量原溶液,滴入紫色石蕊试液,溶液呈蓝色;
Ⅱ.取少量原溶液,滴入BaCl2溶液,无明显现象;
Ⅲ.取少量原溶液,先滴加足量稀硝酸,再加入AgNO3溶液,有白色沉淀产生;
Ⅳ.取少量原溶液,滴入少量稀H2SO4,有白色沉淀产生。
(2)某同学提出,不用实验即可判断原溶液中不存在的离子是
(3)由Ⅱ可以判断出原溶液中不存在的离子是
(4)Ⅲ是为了判断
(5)原溶液中一定含有的离子是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】水体中的六价铬[Cr(Ⅵ)]对生态环境和人体健康威胁很大。工业废水中Cr(Ⅵ)常用还原沉淀法、微生物法等进行处理。
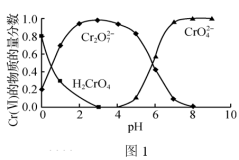
(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、 Cr2O 和CrO
和CrO )的物质的量分数随pH的关系如图1所示。
)的物质的量分数随pH的关系如图1所示。
①某含Cr(Ⅵ)废水的pH约为3,写出用Na2SO3处理该废水的离子方程式:_______ [已知pH=3时,Cr(Ⅲ)以Cr3+形式存在]。
②其他条件相同,用Na2SO3处理不同pH的含Cr(Ⅵ)废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图2所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是_______ 。
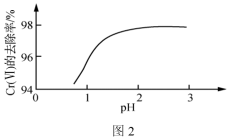
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO 转化为S2–,S2–与CrO
转化为S2–,S2–与CrO 可反应生成Cr2S3和S两种沉淀。写出S2–与CrO
可反应生成Cr2S3和S两种沉淀。写出S2–与CrO 反应的离子方程式:
反应的离子方程式:_______ 。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是_______ 。
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图3所示。已知溶液中的S2–会完全转化为FeS,则Fe腐蚀后生成FeS和Fe(OH)2的物质的量之比为_______ 。

(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、 Cr2O
 和CrO
和CrO )的物质的量分数随pH的关系如图1所示。
)的物质的量分数随pH的关系如图1所示。
①某含Cr(Ⅵ)废水的pH约为3,写出用Na2SO3处理该废水的离子方程式:
②其他条件相同,用Na2SO3处理不同pH的含Cr(Ⅵ)废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图2所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是

(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO
 转化为S2–,S2–与CrO
转化为S2–,S2–与CrO 可反应生成Cr2S3和S两种沉淀。写出S2–与CrO
可反应生成Cr2S3和S两种沉淀。写出S2–与CrO 反应的离子方程式:
反应的离子方程式:②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图3所示。已知溶液中的S2–会完全转化为FeS,则Fe腐蚀后生成FeS和Fe(OH)2的物质的量之比为

您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】Ⅰ.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:
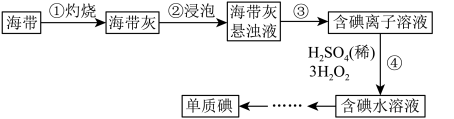
(1)步骤③的实验操作为_______ (填操作名称),此过程使用玻璃棒,玻璃棒的作用是_______ 。
(2)步骤④反应的离子方程式为H2O2+2H++2I-=I2+2H2O。该离子反应的氧化剂是_______ ,还原剂是_______ 。
(3)向步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现_______ 色,说明有碘单质产生。
Ⅱ.碘被称为“智力元素”。以前食盐中常加入KI作为加碘剂,但空气中氧气的作用容易引起碘的损失,I-被氧气氧化成碘单质(I2),同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的离子方程式:_______ 。
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如下所示关系:
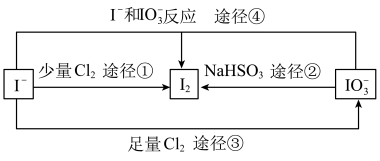
(5)四个途径中属于氧化还原反应的是_______ (填序号)。
(6)碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应的化学方程式为Cl2+KIO3+2KOH=2KCl+KIO4+H2O,写出该反应的离子方程式:_______ 。

(1)步骤③的实验操作为
(2)步骤④反应的离子方程式为H2O2+2H++2I-=I2+2H2O。该离子反应的氧化剂是
(3)向步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现
Ⅱ.碘被称为“智力元素”。以前食盐中常加入KI作为加碘剂,但空气中氧气的作用容易引起碘的损失,I-被氧气氧化成碘单质(I2),同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的离子方程式:
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如下所示关系:

(5)四个途径中属于氧化还原反应的是
(6)碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应的化学方程式为Cl2+KIO3+2KOH=2KCl+KIO4+H2O,写出该反应的离子方程式:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】已知有以下物质相互转化
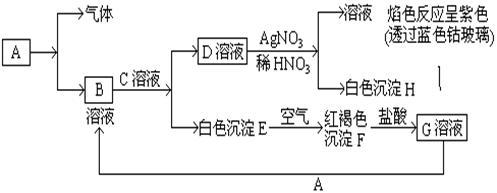
试回答: (1)写出化学式B_________ ,D_____________ E__________ F__________
(2)写出用KSCN鉴别G溶液的离子方程式_______________ ;向G溶液加入A的有关离子反应方程式______________________ 。

试回答: (1)写出化学式B
(2)写出用KSCN鉴别G溶液的离子方程式
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】甘氨酸亚铁[ (H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
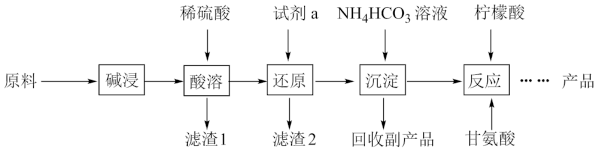
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是_________ , “滤渣1”是_________ (填化学式)
(2)“'还原”时的还原产物是_________ 。
(3)“沉淀”的离子方程式_________ ,“副产品”是_________ (写名称)
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为_________ 。
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是_________ ,某同学通过如下实验测定该补血剂中Fe2+的含量:
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是_________ 。
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为________ % (保留2位小数) 。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是
(2)“'还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某研究性学习小组拟配制FeI2溶液并探究相关性质。
Ⅰ.配制240mL0.2mol·L-1FeI2溶液
(1)配制FeI2溶液除烧杯、量筒、胶头滴管外,
①还需要的玻璃仪器是_____ 。
②用托盘天平称量,需要称取FeI2_____ g。
③定容时,若仰视容量瓶刻度线会使配制的FeI2溶液浓度_____ 。(填“偏大”或“偏小”)
④久置的FeI2溶液容易变质,检测其是否变质的试剂为_____ 。
Ⅱ.探究Fe2+与I-的还原性强弱
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色。
同学们对产生黄色的原因提出假设:
假设1:只有I-被少量Cl2氧化成I2溶解在溶液中,碘水为黄色,还原性:I->Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+,FeCl3溶液为黄色,还原性:Fe2+>I-。
(2)设计方案,验证假设
①为______ (填“CCl4”或“苯”)。
②上层呈______ 色。
最终实验现象证实:假设1正确。
③若向20mL上述FeI2溶液通入112mL(标准状况)Cl2,反应的离子方程式为______ 。
Ⅰ.配制240mL0.2mol·L-1FeI2溶液
(1)配制FeI2溶液除烧杯、量筒、胶头滴管外,
①还需要的玻璃仪器是
②用托盘天平称量,需要称取FeI2
③定容时,若仰视容量瓶刻度线会使配制的FeI2溶液浓度
④久置的FeI2溶液容易变质,检测其是否变质的试剂为
Ⅱ.探究Fe2+与I-的还原性强弱
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色。
同学们对产生黄色的原因提出假设:
假设1:只有I-被少量Cl2氧化成I2溶解在溶液中,碘水为黄色,还原性:I->Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+,FeCl3溶液为黄色,还原性:Fe2+>I-。
(2)设计方案,验证假设
| 实验方案 | 预期现象 | 结论 |
| 向反应后的溶液中加入适量______,振荡,静置,分层,观察下层液体颜色,在上层溶液中加入KSCN溶液,观察上层颜色 | 下层呈紫红色 | 假设1正确 |
| ______ | 假设2正确 |
②上层呈
最终实验现象证实:假设1正确。
③若向20mL上述FeI2溶液通入112mL(标准状况)Cl2,反应的离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
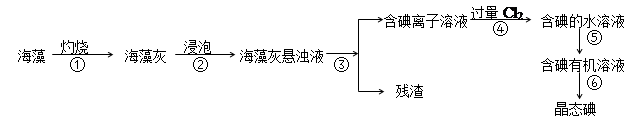
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③_________________________ ,步骤⑤___________________________ 。
(2)写出步骤④对应反应的离子方程式:________________________ 。
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用_____________ (填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
(4)提取碘的过程中,可供选择的有机试剂是____________ 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯

(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③
(2)写出步骤④对应反应的离子方程式:
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
(4)提取碘的过程中,可供选择的有机试剂是
A.酒精 B.醋酸 C.四氯化碳 D.苯
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】海洋是一座巨大的化学资源宝库,如图是从海水中或海产品中提取若干种化学物质的流程图。
Ⅰ.海水提溴的流程如图所示:
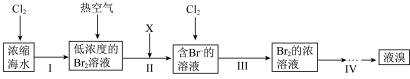
(1)X可用 气体,该反应的离子方程式为
气体,该反应的离子方程式为___________ 。
(2)步骤Ⅳ包含蒸馏,该操作不需要下列仪器中的___________ (填字母)。
a. b.
b. c.
c. d.
d. e.
e. f.
f.
Ⅱ.兴趣小组同学按如图实验过程,证明海带中存在碘元素。
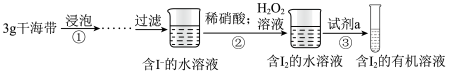
(3)实验时需要将干海带放入___________ 中灼烧(填仪器名称)
(4) 的作用是
的作用是___________ (用离子方程式解释)
(5)试剂a不能选择的是(填序号)___________。
(6)操作③的名称是___________ 。
(7)操作③中需要振荡排放气体,放气时分液漏斗的状态是___________。
Ⅰ.海水提溴的流程如图所示:

(1)X可用
 气体,该反应的离子方程式为
气体,该反应的离子方程式为(2)步骤Ⅳ包含蒸馏,该操作不需要下列仪器中的
a.
 b.
b. c.
c. d.
d. e.
e. f.
f.
Ⅱ.兴趣小组同学按如图实验过程,证明海带中存在碘元素。

(3)实验时需要将干海带放入
(4)
 的作用是
的作用是(5)试剂a不能选择的是(填序号)___________。
A. | B.苯 | C.酒精 | D.裂化汽油 |
(7)操作③中需要振荡排放气体,放气时分液漏斗的状态是___________。
A. | B. | C. | D. |
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】一氯化碘(ICl)是一种卤素互化物。卤素互化物具有强氧化性稀溶液,可与金属直接反应,也可用作有机合成中的碘化剂,一般可由卤素单质直接化合制得。有关一氯化碘制备及性质验证,请回答下列问题:
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:
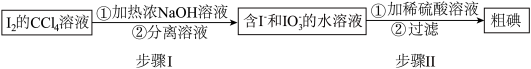
(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和_______ ,步骤Ⅱ的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。
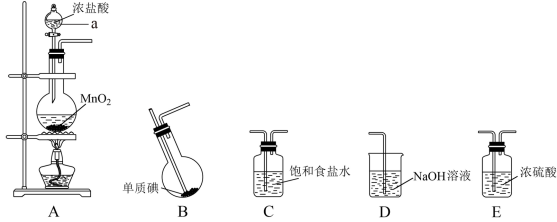
查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;_______
(4)B装置烧瓶需放在冷水中,其目的是:_______ ,B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_______ 。
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式_______ 。
(6)请设计简单的实验证明ICl的氧化性比I2强:_______ 。
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:

(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;
(4)B装置烧瓶需放在冷水中,其目的是:
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式
(6)请设计简单的实验证明ICl的氧化性比I2强:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】经检测,某化工厂排出的废水呈酸性,且其中含有大量 、
、 、
、 、
、 、
、 ,回答下列问题:
,回答下列问题:
(1)下列离子中,能大量存在于该废水中的是__________(填标号)。
A. | B. | C. | D. |
(2)取100mL该废水于烧杯,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
 、
、(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图: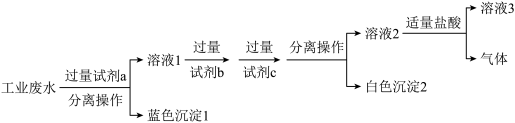
①试剂b为 、
、
②“分离操作”的名称是
③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计了如下实验方案:
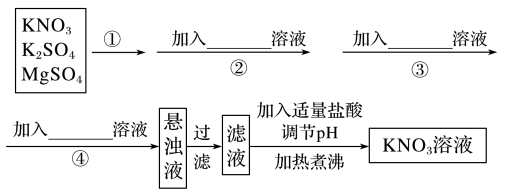
(1)操作①为_______ 。
(2)操作②~④加入的试剂依次为_______ 。
(3)判断SO 已除尽的方法是
已除尽的方法是_______ 。
(4)实验过程中多次产生的沉淀_______ (填“需要”或“不需要”)多次过滤,其理由是_______ 。
(5)该同学的实验设计方案是否严密?_______ (填“是”或“否”);请说明理由_______ 。
(6)写出上述提纯过程中可能涉及的反应的离子方程式:_______ 。

(1)操作①为
(2)操作②~④加入的试剂依次为
(3)判断SO
 已除尽的方法是
已除尽的方法是(4)实验过程中多次产生的沉淀
(5)该同学的实验设计方案是否严密?
(6)写出上述提纯过程中可能涉及的反应的离子方程式:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】己二酸在有机合成工业、医药、润滑剂制造等方面都有重要作用,实验室常用环己醇来制备,其反应原理如下,KMnO4在该实验条件下被还原成MnO2。
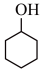
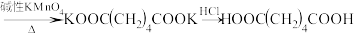
实验步骤:
①按下图安装装置,在250mL三颈烧瓶中加入50mL0.3mol/LKOH溶液和8.5g高锰酸钾。打开电磁搅拌器,水浴升温至35°C使之溶解。控制滴速滴加环己醇2. l mL,维持反应温度在43°C~47°C,充分反应后趁热过滤,滤渣用少量热水洗涤。
②将滤液和洗涤液倒入100mL烧杯中,加入适量饱和亚硫酸氢钠溶液,再用浓盐酸酸化至pH为2~4,小火加热蒸发滤液至10mL左右,然后倒入冷水中,过滤析出的晶体,并用冷水洗涤2~3次,干燥、称重得产品2.1g。

回答下列问题:
(1)仪器A名叫恒压滴液漏斗,与用分液漏斗相比,其优点是_______ ;冷凝管的出水口是_____ (填“a”或“b”) 。
(2)步骤①中趁热过滤所得滤渣的主要成分是_________ 。
(3)实验时,发现环己醇的黏性太强,恒压滴液漏斗中残留过多从而导致产率较低,可以向环己醇中加入_______ (“水”或“乙醇”) 稀释从而降低黏性,不用另一种试剂稀释的原因是________ 。
(4)步骤②中加入饱和亚硫酸氢钠溶液的作用是__________ 。
(5)浓盐酸酸化的目的是调pH至2~4,若pH过高将会使产品的产率______ (填“增大”“不变”或“减小”)。由环己醇制备己二酸的实验中,产品的产率为_____ ( 保留两位有效数字)。

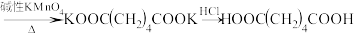
| 名称 | 相对分子质量 | 密度(g/mL) | 溶解性 |
| 环己醇 | 1 00 | 0.96 | 溶于水,易溶于乙醇 |
| 己二酸 | 146 | 1.36 | 易溶于热水,易溶于乙醇 |
①按下图安装装置,在250mL三颈烧瓶中加入50mL0.3mol/LKOH溶液和8.5g高锰酸钾。打开电磁搅拌器,水浴升温至35°C使之溶解。控制滴速滴加环己醇2. l mL,维持反应温度在43°C~47°C,充分反应后趁热过滤,滤渣用少量热水洗涤。
②将滤液和洗涤液倒入100mL烧杯中,加入适量饱和亚硫酸氢钠溶液,再用浓盐酸酸化至pH为2~4,小火加热蒸发滤液至10mL左右,然后倒入冷水中,过滤析出的晶体,并用冷水洗涤2~3次,干燥、称重得产品2.1g。

回答下列问题:
(1)仪器A名叫恒压滴液漏斗,与用分液漏斗相比,其优点是
(2)步骤①中趁热过滤所得滤渣的主要成分是
(3)实验时,发现环己醇的黏性太强,恒压滴液漏斗中残留过多从而导致产率较低,可以向环己醇中加入
(4)步骤②中加入饱和亚硫酸氢钠溶液的作用是
(5)浓盐酸酸化的目的是调pH至2~4,若pH过高将会使产品的产率
您最近半年使用:0次



