实验室制备苯乙酮的化学方程式为: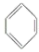 +(CH3CO)2O
+(CH3CO)2O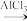
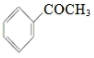 +CH3COOH。制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑
+CH3COOH。制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑ 等副反应。主要实验装置和步骤如图:
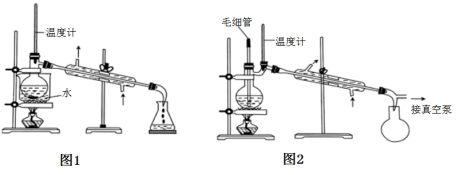
等副反应。主要实验装置和步骤如图:
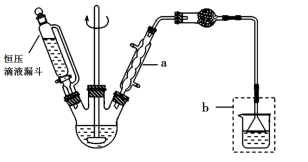
(I)合成:
在三颈烧瓶中加入20g无水AlCl3和30mL无水苯。边搅拌边慢慢滴加6mL乙酸酐和10mL无水苯的混合液,使反应液缓缓回流。滴加完毕后加热回流1小时,形成黑黄色液体。
(Ⅱ)分离与提纯:
将冷却后的反应瓶置于冰水浴中,加入15mL苯,慢慢加入混合的盐酸冰水,静置分层,分液,无机相用乙醚萃取,与有机相合并,有机相用10%NaOH溶液洗涤,分液,弃去无机层,有机层用9mL水洗,分液,弃去无机层,有机层用MgSO4干燥,得到苯乙酮粗产品。
回答下列问题:
(1)仪器a的名称:___ ;使用恒压滴定漏斗的优点是:___ 。
(2)球形干燥管的作用是___ 。
(3)若将乙酸酐和苯的混合液一次性倒入三颈烧瓶,可能导致__ 。
A.反应太剧烈 B.液体太多搅不动 C.反应变缓慢 D.副产物增多
(4)分离和提纯操作中是否可改用乙醇萃取?___ (填“是”或“否”),原因是___ 。
(5)分液漏斗使用前须___ 并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振荡并__ 后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先___ ,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)已知常压下:
则从粗产品中提纯苯乙酮使用的操作是___ ;为了收集纯净的苯乙酮馏分,分离苯乙酮应使用下面的图___ 装置。
 +(CH3CO)2O
+(CH3CO)2O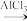
 +CH3COOH。制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑
+CH3COOH。制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑ 等副反应。主要实验装置和步骤如图:
等副反应。主要实验装置和步骤如图:
(I)合成:
在三颈烧瓶中加入20g无水AlCl3和30mL无水苯。边搅拌边慢慢滴加6mL乙酸酐和10mL无水苯的混合液,使反应液缓缓回流。滴加完毕后加热回流1小时,形成黑黄色液体。
(Ⅱ)分离与提纯:
将冷却后的反应瓶置于冰水浴中,加入15mL苯,慢慢加入混合的盐酸冰水,静置分层,分液,无机相用乙醚萃取,与有机相合并,有机相用10%NaOH溶液洗涤,分液,弃去无机层,有机层用9mL水洗,分液,弃去无机层,有机层用MgSO4干燥,得到苯乙酮粗产品。
回答下列问题:
(1)仪器a的名称:
(2)球形干燥管的作用是
(3)若将乙酸酐和苯的混合液一次性倒入三颈烧瓶,可能导致
A.反应太剧烈 B.液体太多搅不动 C.反应变缓慢 D.副产物增多
(4)分离和提纯操作中是否可改用乙醇萃取?
(5)分液漏斗使用前须
(6)已知常压下:
| 熔点/℃ | 沸点/℃ | |
| 苯 | 5.5 | 80.1 |
| 乙醚 | -116.3 | 34.6 |
| 苯乙酮 | 19.6 | 202 |

更新时间:2021-05-21 08:41:17
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】废旧印刷电路板是一种电子废弃物,某化学小组利用该电子废弃物回收铜和制取胆矾,实验流程简图如下:

已知:①步骤I涉及的反应为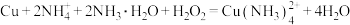
②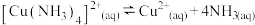
请回答:
(1)步骤I中, 作用是作为反应物和
作用是作为反应物和_______ ,步骤I的分离操作名称为_______ 。
(2)①步骤Ⅱ涉及的离子反应方程式为_______ 。
②步骤Ⅱ可以分解为以下实验步骤,正确的操作顺序是_______ (用相应的编号填写)
a.把混合液加入分液漏斗中,并盖好玻璃塞
b.检验分液漏斗旋塞芯和玻璃塞是否漏水
c.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
d.倒转漏斗用力振荡,并不断放气,振荡完毕,把分液漏斗放正在铁架台的铁圈中
e.将分液漏斗上口倒出上层溶液
f.旋开活塞,用烧杯接收溶液
③步骤Ⅱ中,影响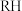 对铜元素萃取率的主要因素有
对铜元素萃取率的主要因素有_______
A.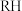 的浓度 B.压强 C.温度 D.铜氨溶液的
的浓度 B.压强 C.温度 D.铜氨溶液的 值
值
(3)步骤Ⅳ,以石墨作电极电解 溶液。阴极析出铜,阳极产物是
溶液。阴极析出铜,阳极产物是_______ 。
(4)步骤V,制取胆矾的主要步骤是_______ (填字母,按操作顺序写)
a.过滤 b.蒸发浓缩,冷却结晶 c.蒸发结晶 d.加入少量 e.洗涤 f.烘干 g.低温干燥
e.洗涤 f.烘干 g.低温干燥
(5)上述实验流程中可以循环使用的物质有_______

已知:①步骤I涉及的反应为
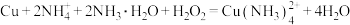
②
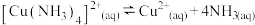
请回答:
(1)步骤I中,
 作用是作为反应物和
作用是作为反应物和(2)①步骤Ⅱ涉及的离子反应方程式为
②步骤Ⅱ可以分解为以下实验步骤,正确的操作顺序是
a.把混合液加入分液漏斗中,并盖好玻璃塞
b.检验分液漏斗旋塞芯和玻璃塞是否漏水
c.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
d.倒转漏斗用力振荡,并不断放气,振荡完毕,把分液漏斗放正在铁架台的铁圈中
e.将分液漏斗上口倒出上层溶液
f.旋开活塞,用烧杯接收溶液
③步骤Ⅱ中,影响
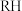 对铜元素萃取率的主要因素有
对铜元素萃取率的主要因素有A.
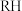 的浓度 B.压强 C.温度 D.铜氨溶液的
的浓度 B.压强 C.温度 D.铜氨溶液的 值
值(3)步骤Ⅳ,以石墨作电极电解
 溶液。阴极析出铜,阳极产物是
溶液。阴极析出铜,阳极产物是(4)步骤V,制取胆矾的主要步骤是
a.过滤 b.蒸发浓缩,冷却结晶 c.蒸发结晶 d.加入少量
 e.洗涤 f.烘干 g.低温干燥
e.洗涤 f.烘干 g.低温干燥(5)上述实验流程中可以循环使用的物质有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某电镀污泥中含有镍(Ni)、Fe、Cu、Ca等金属化合物(主要以氢氧化物形式存在)及SiO2,从该电镀污泥中回收制备硫酸镍(NiSO4),具体流程如图所示。已知:加入有机萃取剂发生的反应为:nHX+Mn+ MXn+nH+。
MXn+nH+。
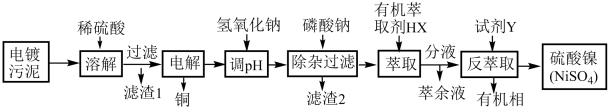
(1)提高电镀污泥溶解速率的措施有____ (写出两条)。
(2)滤渣1的成分中有____ 。
(3)电解中用惰性电极电解滤液,阳极区溶液pH降低,其电极反应式为____ ,确定电解后Cu2+反应完全的实验操作是____ 。
(4)Ksp(FeSO4)=9.9×10-16,若使溶液中c(Fe3+)<1×10-5mol·L-1此时溶液中c(PO )至少
)至少____ 。
(5)试剂Y为____ ,反萃取时发生反应的离子方程式为____ 。
(6)此流程中可以循环利用的是有机相和____ 。
 MXn+nH+。
MXn+nH+。
(1)提高电镀污泥溶解速率的措施有
(2)滤渣1的成分中有
(3)电解中用惰性电极电解滤液,阳极区溶液pH降低,其电极反应式为
(4)Ksp(FeSO4)=9.9×10-16,若使溶液中c(Fe3+)<1×10-5mol·L-1此时溶液中c(PO
 )至少
)至少(5)试剂Y为
(6)此流程中可以循环利用的是有机相和
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】蛇纹石矿可以看做是由MgO、 、
、 、
、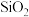 组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:

(1)蛇纹石矿加盐酸溶解后,溶液里除了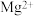 外,还含有的金属离子是
外,还含有的金属离子是 ______
(2)进行Ⅰ操作时,控制溶液 有关氢氧化物沉淀的pH见上表
有关氢氧化物沉淀的pH见上表 不能过量,若
不能过量,若 过量可能会导致
过量可能会导致 ______ 溶解、 ______ 沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______  填入物质的化学式
填入物质的化学式 ,然后
,然后 ______  依次填写实验操作名称
依次填写实验操作名称 .
.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是______  填写物质化学式
填写物质化学式 .
.
(5)若热分解不完全,所得碱式碳酸镁中将混有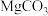 ,则产品中镁的质量分数
,则产品中镁的质量分数 ______  填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于
填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于 .
.
 、
、 、
、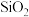 组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
组成.由蛇纹石制取碱式碳酸镁的实验步骤如下: 
| 氢氧化物 |  |  |  |
| 开始沉淀pH | 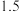 |  | 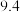 |
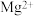 外,还含有的金属离子是
外,还含有的金属离子是 (2)进行Ⅰ操作时,控制溶液
 有关氢氧化物沉淀的pH见上表
有关氢氧化物沉淀的pH见上表 不能过量,若
不能过量,若 过量可能会导致
过量可能会导致 (3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入
 填入物质的化学式
填入物质的化学式 ,然后
,然后  依次填写实验操作名称
依次填写实验操作名称 .
.(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是
 填写物质化学式
填写物质化学式 .
.(5)若热分解不完全,所得碱式碳酸镁中将混有
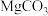 ,则产品中镁的质量分数
,则产品中镁的质量分数  填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于
填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于 .
.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】生物柴油是指由动植物油脂(脂肪酸甘油三酯)与醇(甲醇或乙醇)经酯交换反应得到的脂肪酸单烷基酯,可以替代普通柴油使用的清洁的可再生能源。利用地沟油与甲醇制备生物柴油,其原理及实验步骤:

①称取4.66g CH3OH和0.2g NaOH依次放入锥形瓶中,充分振荡得NaOH甲醇溶液;
②将20 g地沟油、20 g正己烷(作溶剂)、步骤1配得的NaOH甲醇溶液一次加入到三口烧瓶中;
③安装装置(如图)恒温水浴加热,使温度保持在60~65℃左右,搅拌速度400 r/min,加热1.5 h~2 h;
④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
(1)仪器a的作用是___________ 。
(2)实验中取用的甲醇与油脂的物质的量之比约为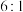 ,甲醇过量的主要目的是
,甲醇过量的主要目的是___________ ;NaOH的用量不宜过多,其原因是___________ 。
(3)步骤4的液体分为两层,上层为生物柴油、正己烷和甲醇,上层液体需用温水洗涤,检验已洗涤干净的方法是___________ 。
(4)碘值是指每100 g油品所能吸收(I2)的质量。测定产品碘值得步骤如下:
Ⅰ.准确称取m g油品,注入碘量瓶中,向碘量瓶中加入20 mL氯仿溶解后,加入25.00 mL韦氏碘液,(IBr溶液及催化剂,发生反应: ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。
Ⅱ.30 min后立即加入20 mL 15%的碘化钾溶液和100 mL水,发生反应的化学方程式为___________ ,不断振荡,用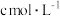 的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1 mL淀粉指示剂,继续滴定(
的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1 mL淀粉指示剂,继续滴定( ),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是
),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是___________ 。

①称取4.66g CH3OH和0.2g NaOH依次放入锥形瓶中,充分振荡得NaOH甲醇溶液;
②将20 g地沟油、20 g正己烷(作溶剂)、步骤1配得的NaOH甲醇溶液一次加入到三口烧瓶中;
③安装装置(如图)恒温水浴加热,使温度保持在60~65℃左右,搅拌速度400 r/min,加热1.5 h~2 h;
④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
(1)仪器a的作用是
(2)实验中取用的甲醇与油脂的物质的量之比约为
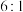 ,甲醇过量的主要目的是
,甲醇过量的主要目的是(3)步骤4的液体分为两层,上层为生物柴油、正己烷和甲醇,上层液体需用温水洗涤,检验已洗涤干净的方法是
(4)碘值是指每100 g油品所能吸收(I2)的质量。测定产品碘值得步骤如下:
Ⅰ.准确称取m g油品,注入碘量瓶中,向碘量瓶中加入20 mL氯仿溶解后,加入25.00 mL韦氏碘液,(IBr溶液及催化剂,发生反应:
 ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。Ⅱ.30 min后立即加入20 mL 15%的碘化钾溶液和100 mL水,发生反应的化学方程式为
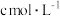 的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1 mL淀粉指示剂,继续滴定(
的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1 mL淀粉指示剂,继续滴定( ),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是
),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】检验甲醛含量的方法有很多,其中银-Ferrozine法灵敏度较高。测定原理为甲醛把氧化银还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
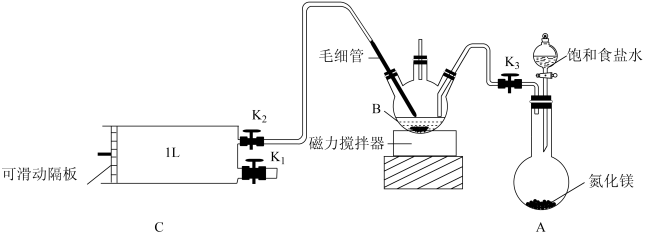
已知:甲醛和银氨溶液反应生成单质银和CO2,氮化镁与水反应放出NH3,毛细管内径不超过1mm。
请回答下列问题:
(1)A装置中反应的化学方程式为_______ ,用饱和食盐水代替水制备NH3的原因是_______ 。
(2)B中装有AgNO3溶液,仪器B的名称为_______ 。
(3)银氨溶液的制备。关闭K1、K2,打开K3,打开_______ ,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中_______ ,停止通NH3。
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气,关闭K1;后续操作是_______ ;再重复上述操作3次。毛细管的作用是_______ 。
②向上述B中充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成Fe2+1.12mg,空气中甲醛的含量为_______ mg·L-1。

已知:甲醛和银氨溶液反应生成单质银和CO2,氮化镁与水反应放出NH3,毛细管内径不超过1mm。
请回答下列问题:
(1)A装置中反应的化学方程式为
(2)B中装有AgNO3溶液,仪器B的名称为
(3)银氨溶液的制备。关闭K1、K2,打开K3,打开
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气,关闭K1;后续操作是
②向上述B中充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成Fe2+1.12mg,空气中甲醛的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】用如图所示实验装置制取乙酸乙酯。回答以下问题:

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:先向试管中加入一定量的_______ ,然后边振荡边缓缓加入_______ ,冷却后再加入一定量的_______ ,轻轻振荡使之混合均匀。
(2)浓硫酸的作用是:_______ 。
(3)饱和碳酸钠溶液的作用是:①_______ ;②_______ ;③_______ ;
(4)生成的乙酸乙酯,其密度比水_______ (填“大”或“小”),有_______ 味。
(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物的结构简式为:_______ 。
(6)与书中采用的实验装置的不同之处是:本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中。在此处球形干燥管的作用有:①_______ ,②_______ 。

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:先向试管中加入一定量的
(2)浓硫酸的作用是:
(3)饱和碳酸钠溶液的作用是:①
(4)生成的乙酸乙酯,其密度比水
(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物的结构简式为:
(6)与书中采用的实验装置的不同之处是:本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中。在此处球形干燥管的作用有:①
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】兴趣小组在实验室制备氨气并进行氨气的性质探究实验。
I.甲同学利用如图装置让氨气与氧化铜反应,验证氨气的还原性。

(1)实验室制取氨气的化学方程式为_______ 。
(2)A中反应后得到三种物质,其中有两种单质。反应的化学方程式为_______ 。
II.乙同学按如图所示装置进行氨的催化氧化实验,操作步骤及实验现象总结如下:

操作步骤:将浓氨水倒入锥形瓶中,从导气管中通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。
(3)通入热空气的作用是_______ 。
(4)氨气催化氧化反应的化学方程式为_______ 。
(5)用 NaOH 溶液吸收等物质的量的 NO、NO2两种气体,只生成一种盐的离子方程式为_______ 。
(6)锥形瓶内出现白烟的原因是_______ 。
I.甲同学利用如图装置让氨气与氧化铜反应,验证氨气的还原性。

(1)实验室制取氨气的化学方程式为
(2)A中反应后得到三种物质,其中有两种单质。反应的化学方程式为
II.乙同学按如图所示装置进行氨的催化氧化实验,操作步骤及实验现象总结如下:

操作步骤:将浓氨水倒入锥形瓶中,从导气管中通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。
(3)通入热空气的作用是
(4)氨气催化氧化反应的化学方程式为
(5)用 NaOH 溶液吸收等物质的量的 NO、NO2两种气体,只生成一种盐的离子方程式为
(6)锥形瓶内出现白烟的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】安徽繁昌矿产资源十分丰富,其中峨山镇的随山主产辉铜矿。辉铜矿石主要含有硫化亚铜(Cu2S)、脉石(SiO2)和少量的银。孙村富铁矿业开发集团采用现代湿法炼铜工艺,用酸浸法从矿石中提取铜,其主要工艺流程图如下:

(1)矿泥的主要成分是_______ 。
(2)反应1中发生的离子方程式是_______ 。
(3)第一次萃取实验结束时,发现水层1的颜色仍然较蓝,接下来的操作是_______
(4)反萃取剂的作用是_______ 。
(5)反应2是用惰性电极电解水层2,写出阳极发生的反应方程式_______
(6)传统的湿法炼铜工艺是:粉碎矿石,先高温灼烧,加酸溶解产物,然后加入铁屑进一步得到铜。请评价两种工艺的优缺点_______

(1)矿泥的主要成分是
(2)反应1中发生的离子方程式是
(3)第一次萃取实验结束时,发现水层1的颜色仍然较蓝,接下来的操作是
(4)反萃取剂的作用是
(5)反应2是用惰性电极电解水层2,写出阳极发生的反应方程式
(6)传统的湿法炼铜工艺是:粉碎矿石,先高温灼烧,加酸溶解产物,然后加入铁屑进一步得到铜。请评价两种工艺的优缺点
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】SO2直接排放会形成酸雨,危害环境。某化学实验小组用如图所示装置进行有关SO2性质的探究活动。___________ 。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱,甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________ 。正确的连接顺序是:A→C→___________ (填字母)→尾气处理。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是___________ 。
(3)利用如图所示的装置研究SO2的性质:(熔点:SO2 -76.1℃ SO3 16.8℃ 沸点: SO2 -10℃ SO3 45℃___________ ;装置Ⅲ中溶液逐渐褪色,则该反应的离子方程式是___________ 。
②乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL2.5 mol/LNaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生总反应的化学方程式___________ 。
(4)该实验小组的学生丁用200 mL0.1 mol/L酸性 KMnO4溶液测定空气中:SO2含量,若气体流速为a cm3/min,当时间为t min时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为___________ (g/cm3)。

(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱,甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是
(3)利用如图所示的装置研究SO2的性质:(熔点:SO2 -76.1℃ SO3 16.8℃ 沸点: SO2 -10℃ SO3 45℃
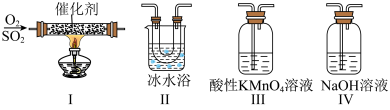
②乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL2.5 mol/LNaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生总反应的化学方程式
(4)该实验小组的学生丁用200 mL0.1 mol/L酸性 KMnO4溶液测定空气中:SO2含量,若气体流速为a cm3/min,当时间为t min时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为
您最近一年使用:0次



