碳及其化合物广泛存在于自然界中,回答下列问题:
(1)碳在形成化合物时,其键型以共价键为主,原因是_______ 。
(2)CS2分子中,共价键的类型有_______ ,C原子的杂化轨道类型是_______ ,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______ 。
(3)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_______ 晶体。
(1)碳在形成化合物时,其键型以共价键为主,原因是
(2)CS2分子中,共价键的类型有
(3)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于
2021高三·全国·专题练习 查看更多[1]
(已下线)小题36 分子结构与性质(价层电子对互斥理论、杂化轨道理论、配合物) ——备战2021年高考化学经典小题考前必刷(全国通用)
更新时间:2021-05-31 14:02:02
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图_____________________ 。
②氮所在的周期中,第一电离能最大的元素为_____________ (填元素符号)。
③与N3互为等电子体的粒子为____________ (写出一种)。
④氨气的电子式____________ 。
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因是____________
(3)依据价层电子对互斥理论,NO3-间构型呈__________ 形。
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是_________ 。
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α﹣Fe、γ﹣Fe的堆积方式分别与钾和铜相同
C.空间利用率α﹣Fe大于γ﹣Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α﹣Fe:γ﹣Fe)的密度比值为___________ 。(写成小数,保留2位有效数字)

2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图
②氮所在的周期中,第一电离能最大的元素为
③与N3互为等电子体的粒子为
④氨气的电子式
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因是
(3)依据价层电子对互斥理论,NO3-间构型呈
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α﹣Fe、γ﹣Fe的堆积方式分别与钾和铜相同
C.空间利用率α﹣Fe大于γ﹣Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α﹣Fe:γ﹣Fe)的密度比值为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)写出SO3分子的空间构型是____ ;是____ 分子(填“极性”或“非极性”);常见的等电子体的化学式:一价阴离子______ (写出一种),它们的中心原子采用的杂化方式都是_______ 。
(2)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为__ ,甲醇分子内的O—C—H键角___ (填“>”“<”或“=”)甲醛分子内的O—C—H键角, 甲醇极易溶于水,其主要原因是_____ 。
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____ (填“>”“<”或“=”)HIO4。
(2)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)醛基中碳原子的轨道杂化类型是__________ 。
(2)现有H、N、O、 S、Cu几种元素,回答下列问题。
①氢元素和N、O、 S、Cu等元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_____ ;分子中既含有极性共价键、又含有非极性共价键的化合物是______ (填化学式,写出两种)。
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_______ (填化学式);酸根呈三角锥结构的酸是_______ (填化学式)。
(3)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中O原子采用_____ 杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_______ 。
(2)现有H、N、O、 S、Cu几种元素,回答下列问题。
①氢元素和N、O、 S、Cu等元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(3)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中O原子采用
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知一些物质的熔点数据如表:
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是_______ 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因_______ 。SiCl4的空间结构为_______ ,其中Si的轨道杂化形式为_______ 。
| 物质 | 熔点/℃ |
| NaCl | 800.7 |
| SiCl4 | -68.8 |
| GeCl4 | -51.5 |
| SnCl4 | -34.1 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)SiCl4可发生水解反应,机理如下:
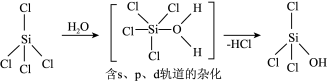
含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。
(3)CS2分子中存在___________ 个σ键和___________ 个π键。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(5)FeCO3的阴离子的空间构型为___________ ,写出一种与该阴离子互为等电子体的分子的化学式___________ 。
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为___________ ,羰基镍属于___________ 晶体。已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(3)CS2分子中存在
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(5)FeCO3的阴离子的空间构型为
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为
您最近一年使用:0次

 中
中 的立体构型为
的立体构型为 原子的杂化方式为
原子的杂化方式为
 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式: 中心原子
中心原子 的配位数为
的配位数为 ,向含
,向含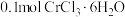 的溶液中滴加
的溶液中滴加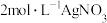 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为


