亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_______ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是_______ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是_______ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于_______ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,离子方程式为_______ ,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______ 。
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
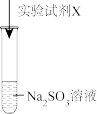 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊。 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
20-21高一下·甘肃平凉·阶段练习 查看更多[2]
更新时间:2021-06-23 15:26:21
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原
例如:PdCl2 + CO + H2O=Pd↓+ CO2+2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
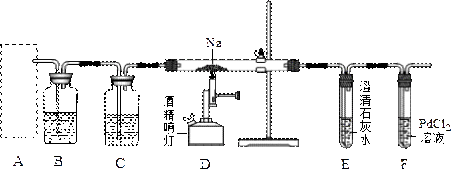
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是_______________________________ ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是_____ (填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是____________ 溶液,装置C中应盛放的试剂是______________ 。
(2)观察实验装置图可知Na与CO2反应的条件是_____________ 。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________ 。待装置______ (填写字母)中出现____________________ 现象时,再点燃酒精喷灯,这步操作的目的是______________________________________ 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是_______________________ 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是__________________________ 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。_________________________________ 。

例如:PdCl2 + CO + H2O=Pd↓+ CO2+2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。


请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是
(2)观察实验装置图可知Na与CO2反应的条件是
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________ 。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________ (填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
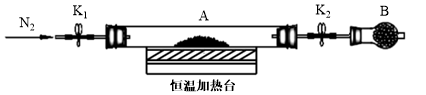
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是________________ 。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______ (列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
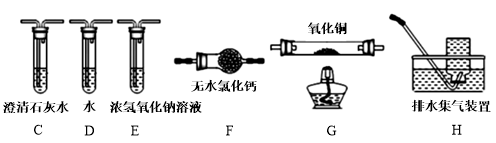
①写出草酸亚铁受热分解的化学方程式____________ 。
②实验装置中,依次连接的合理顺序为A、____________ 。
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。

验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。

①写出草酸亚铁受热分解的化学方程式
②实验装置中,依次连接的合理顺序为A、
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】草酸亚铁晶体(FeC2O4·2H2O,M=180 g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。采用如图装置进行实验。
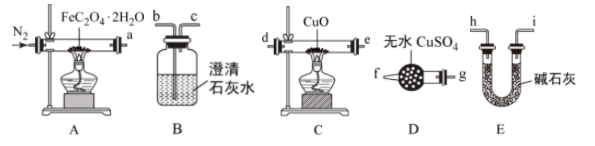
(1)按照气流从左到右的方向,上述装置的接口顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(4)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为_______ 。
(5)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品溶于稀H2SO4中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用c mol/L KMnO4标准液滴定至终点,消耗标准液V1 mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用c mol/L KMnO4标准溶液滴定至终点,消耗标准液V2 mL。
①步骤2中滴定终点的现象为_______ 。
②该样品中草酸亚铁晶体的质量分数的表达式为_______ 。
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。

(1)按照气流从左到右的方向,上述装置的接口顺序为A→
(2)实验证明了气体产物中含有CO,依据的实验现象为
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(4)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
(5)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品溶于稀H2SO4中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用c mol/L KMnO4标准液滴定至终点,消耗标准液V1 mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用c mol/L KMnO4标准溶液滴定至终点,消耗标准液V2 mL。
①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的表达式为
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为_____ ;装置Ⅰ中产生气体的化学方程式为______ 。
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为_____ 。
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是_____ 。
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是_____ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_______ 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_______ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果______ (填“偏高”“偏低”或“不变”)。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】化学小组实验探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图装置制备 ,并将足量
,并将足量 通入
通入 溶液中,
溶液中,迅速反应 ,得到无色溶液A和白色沉淀B(省略夹持、加热仪器)。
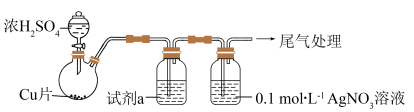
(1)制备的 中会混有少量的
中会混有少量的 ,原因可能为
,原因可能为_______ ,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为_______ 。
A. 溶液 B.饱和
溶液 B.饱和 溶液
溶液
C.饱和 溶液 D.饱和
溶液 D.饱和 溶液
溶液
实验二:验证白色沉淀B的成分。
已知: 微溶于水,
微溶于水, 难溶于水
难溶于水
分析:沉淀B可能为 、
、 或两者混合物。滴加氨水可释出其负离子,便于后续检验。
或两者混合物。滴加氨水可释出其负离子,便于后续检验。
相关反应为:①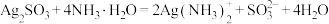 ,②
,②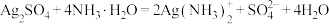 。
。
流程如下:

(2)欲检验溶液C中加入的 是否已经过量,请简述实验方法:
是否已经过量,请简述实验方法:_______ 。
(3)沉淀F是_______ ,沉淀D中主要含 ,理由是
,理由是_______ 。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是_______ ,可进一步证实B中含 。
。
实验三:探究 的产生途径。
的产生途径。
猜想1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
猜想2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:_______ 。根据以上实验结果,则可得出沉淀B的成分是_______ 。
(5)实验探究可知, 在
在_______ (选填“酸性”“中性”“碱性”)溶液中更易被氧化为 。
。
 与
与 溶液的反应。
溶液的反应。实验一:用如图装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,
溶液中,
(1)制备的
 中会混有少量的
中会混有少量的 ,原因可能为
,原因可能为 的干扰,试剂a可以为
的干扰,试剂a可以为A.
 溶液 B.饱和
溶液 B.饱和 溶液
溶液C.饱和
 溶液 D.饱和
溶液 D.饱和 溶液
溶液实验二:验证白色沉淀B的成分。
已知:
 微溶于水,
微溶于水, 难溶于水
难溶于水分析:沉淀B可能为
 、
、 或两者混合物。滴加氨水可释出其负离子,便于后续检验。
或两者混合物。滴加氨水可释出其负离子,便于后续检验。相关反应为:①
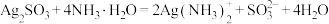 ,②
,②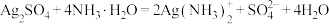 。
。流程如下:

(2)欲检验溶液C中加入的
 是否已经过量,请简述实验方法:
是否已经过量,请简述实验方法:(3)沉淀F是
 ,理由是
,理由是 溶液,产生的现象是
溶液,产生的现象是 。
。实验三:探究
 的产生途径。
的产生途径。猜想1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。猜想2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加
 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:(5)实验探究可知,
 在
在 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某小组同学对 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。
(1)测得 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因___________ 。
(2)调节 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:
资料:ⅰ. :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。
ⅱ. :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。
针对实验 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:
推测1:白色沉淀为 。
。
推测2:白色沉淀为 。
。
①推测1产生该沉淀的反应用离子方程式表示___________ 。
②推测2的理论依据是___________ 。
③取 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于___________ 溶液中,未溶解。
(3)为确认 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:
Ⅰ.向 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;
Ⅱ.向 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;
Ⅲ.用 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
①Ⅰ的目的是___________ 。
②根据Ⅲ的现象,可判断 的元素组成
的元素组成___________ 。
③Ⅱ中反应的化学方程式是___________ 。
(4)综合以上实验,分析 产生的可能原因:
产生的可能原因:
①甲同学认为随着溶液酸性增强, 中的
中的 氧化性增强。
氧化性增强。
②乙同学认为___________ 。
 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。(1)测得
 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因(2)调节
 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:| 实验 |  | 现象 |
 | 10 | 产生白色沉淀,稍后沉淀溶解 |
 | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
 | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质 |
 :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。ⅱ.
 :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。针对实验
 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:推测1:白色沉淀为
 。
。推测2:白色沉淀为
 。
。①推测1产生该沉淀的反应用离子方程式表示
②推测2的理论依据是
③取
 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于(3)为确认
 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:Ⅰ.向
 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;Ⅱ.向
 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;Ⅲ.用
 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。①Ⅰ的目的是
②根据Ⅲ的现象,可判断
 的元素组成
的元素组成③Ⅱ中反应的化学方程式是
(4)综合以上实验,分析
 产生的可能原因:
产生的可能原因:①甲同学认为随着溶液酸性增强,
 中的
中的 氧化性增强。
氧化性增强。②乙同学认为
您最近一年使用:0次



