根据下列操作及现象,所得结论正确的是
| 序号 | 操作及现象 | 结论 |
| A | 将 氨水稀释成 氨水稀释成 测得 测得 由11.1变成10.6 由11.1变成10.6 | 稀释后, 的电离程度减小 的电离程度减小 |
| B | 向 冷水和沸水中分别滴入5滴 冷水和沸水中分别滴入5滴 饱和溶液,前者为黄色,后者为红褐色 饱和溶液,前者为黄色,后者为红褐色 | 温度升高, 的水解程度增大 的水解程度增大 |
| C | 常温下,测得饱和 溶液的 溶液的 大于饱和 大于饱和 溶液 溶液 | 常温下水解程度: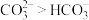 |
| D | 将固体 加入 加入 溶液中,一段时间后,检验固体成分为 溶液中,一段时间后,检验固体成分为 | 同温度下溶解度: |
| A.A | B.B | C.C | D.D |
更新时间:2021-07-06 11:37:32
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
A.0.1mol/LHF溶液中存在平衡: ,加水可使溶液中 ,加水可使溶液中 增大 增大 |
B.向0.1mol/L弱酸HA溶液中通少量HCl气体,平衡逆向移动,溶液 减小 减小 |
| C.等浓度的硫酸与盐酸分别与相同的锌片反应,初始反应的速率一样快 |
| D.将0.1mol/L的氨水升温(不考虑氨水的挥发),氨水的pH下降 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示。下列说法错误的是
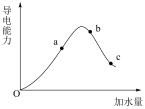

| A.加水前导电能力约为零的原因是冰醋酸中几乎没有自由移动的离子 |
| B.a、b、c三点对应的溶液中,CH3COOH电离程度最大的是c |
| C.a、b、c三点对应的溶液中,c(H+)由小到大的顺序是c<a<b |
| D.在b点加入浓硫酸,可使溶液中c(CH3COO-)增大、c(H+)增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某课外研究小组设计数字化实验探究温度对盐类水解反应的影响。通过加热50mL0.1000mol/L的 标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示。下列说法错误的是
标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示。下列说法错误的是
 标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示。下列说法错误的是
标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示。下列说法错误的是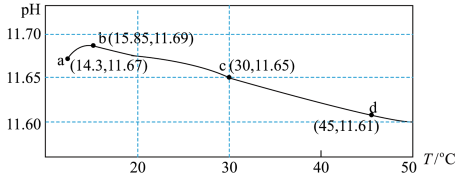
A.c点溶液中: |
B.由ab段可得结论:  |
C.bd段pH减小是水的 随着温度的升高而增大所致 随着温度的升高而增大所致 |
D.从a→d随着温度升高,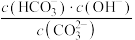 始终增大 始终增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列对 溶液进行实验操作的有关说法中错误的是
溶液进行实验操作的有关说法中错误的是
 溶液进行实验操作的有关说法中错误的是
溶液进行实验操作的有关说法中错误的是| A.加水稀释,溶液中所有离子的浓度都减小 |
B.保持温度不变,通入 后溶液pH减小 后溶液pH减小 |
C.加入 固体后, 固体后,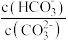 减小 减小 |
D.升高温度,溶液中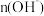 增大 增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】关于图中各装置的叙述不正确的是


| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②能测量锌与硫酸的反应速率 |
| C.装置③能验证铁的吸氧腐蚀 |
| D.装置④的X电极是负极,则能验证外接电源的阴极保护法 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】废旧铅蓄电池的铅膏中主要含有 、
、 。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。下列说法不正确的是
。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。下列说法不正确的是
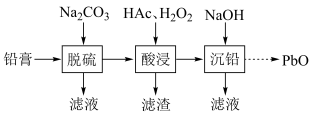
 、
、 。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。下列说法不正确的是
。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。下列说法不正确的是
A.“铅膏”中 主要来源于该电池的正极材料 主要来源于该电池的正极材料 |
B.“脱硫”的目的是将 转化为 转化为 |
C.“酸浸”中的 作氧化剂 作氧化剂 |
| D.“沉铅”后的滤液焰色反应呈黄色 |
您最近一年使用:0次




