锂单质及化合物用途广泛,涉及电池、陶瓷、玻璃、润滑剂、制冷液、核工业等领域。
(1)锂离子电池的电解液有LiBF4,等,碳酸亚乙酯(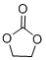 )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为_______ ,LiBF4中不存在______ (填序号)。
A.离子键 B.极性共价键 C.配位键 D.氢键
②碳酸亚乙酯分子中σ键与π键数目之比为______ 。酯密度一般比水小,难溶于水,而碳酸亚乙酯能溶于水的主要原因是______ 。
(2)碱金属在空气中燃烧时,只有锂生成普通氧化物 。
。 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的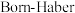 循环计算得到。
循环计算得到。
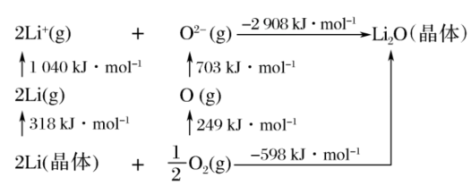
①由图中数据可知O=O键键能为___________  ,
, 晶格能为
晶格能为___________  。
。
② 和
和 的熔点如下表所示:
的熔点如下表所示:
熔点差异的原因是___________ 。
(1)锂离子电池的电解液有LiBF4,等,碳酸亚乙酯(
 )用作该电解液的添加剂。
)用作该电解液的添加剂。①LiBF4中阴离子的空间构型为
A.离子键 B.极性共价键 C.配位键 D.氢键
②碳酸亚乙酯分子中σ键与π键数目之比为
(2)碱金属在空气中燃烧时,只有锂生成普通氧化物
 。
。 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的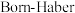 循环计算得到。
循环计算得到。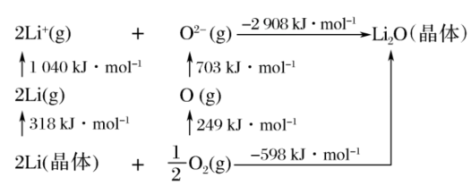
①由图中数据可知O=O键键能为
 ,
, 晶格能为
晶格能为 。
。②
 和
和 的熔点如下表所示:
的熔点如下表所示:| 氧化物 |  |  |
| 熔点/℃ | 1570 | 2800 |
熔点差异的原因是
更新时间:2021-07-10 22:00:43
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】(1)Mn2+基态核外电子排布式为__ 。Mn3+得电子生成基态Mn时,电子填充在__ 轨道上。
(2)配离子 中配位原子是
中配位原子是___ ;1mol该配离子中有____ molσ键。
(3) 键角
键角____  键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”);
”);
(4)元素 基态原子的
基态原子的 层全部排满电子,
层全部排满电子, 层电子数为1,则
层电子数为1,则 位于周期表
位于周期表_______ 区。
(5) 能与
能与 任意比混溶的原因,除它们都是极性分子外还因为
任意比混溶的原因,除它们都是极性分子外还因为_____ 。
(6) 分子中碳原子的轨道杂化类型为
分子中碳原子的轨道杂化类型为____ 。
(7)C、N、O基态原子第一电离能由大到小的顺序是____ 。(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(8) 是钴的一种配合物,中心离子的配位数6,向
是钴的一种配合物,中心离子的配位数6,向 该配合物溶液中加入足量
该配合物溶液中加入足量 溶液,生成5.74g白色沉淀。则该配合物的化学式为
溶液,生成5.74g白色沉淀。则该配合物的化学式为_______ 。
(9)MnS晶体具有 、
、 、
、 三种形态,其中
三种形态,其中 的晶胞结构如图所示,则
的晶胞结构如图所示,则 的配位数为
的配位数为____ 。

(2)配离子
 中配位原子是
中配位原子是(3)
 键角
键角 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”);
”);(4)元素
 基态原子的
基态原子的 层全部排满电子,
层全部排满电子, 层电子数为1,则
层电子数为1,则 位于周期表
位于周期表(5)
 能与
能与 任意比混溶的原因,除它们都是极性分子外还因为
任意比混溶的原因,除它们都是极性分子外还因为(6)
 分子中碳原子的轨道杂化类型为
分子中碳原子的轨道杂化类型为(7)C、N、O基态原子第一电离能由大到小的顺序是
 ”、“
”、“ ”或“
”或“ ”)
”)(8)
 是钴的一种配合物,中心离子的配位数6,向
是钴的一种配合物,中心离子的配位数6,向 该配合物溶液中加入足量
该配合物溶液中加入足量 溶液,生成5.74g白色沉淀。则该配合物的化学式为
溶液,生成5.74g白色沉淀。则该配合物的化学式为(9)MnS晶体具有
 、
、 、
、 三种形态,其中
三种形态,其中 的晶胞结构如图所示,则
的晶胞结构如图所示,则 的配位数为
的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过_____ 方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为______ 。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______ ,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______ 、______
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在______ (填序号):
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJ•mol-1,S-F的键能为______ kJ•mol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g•cm-3。
①CuF比CuCl熔点高的原因是______ ;
②已知NA为阿伏伽德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___ nm (列出计算式)。

(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过
(2)基态铜原子价电子排布的轨道式为
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJ•mol-1,S-F的键能为
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g•cm-3。
①CuF比CuCl熔点高的原因是
②已知NA为阿伏伽德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】按要求填空
(1)在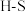 和H-Cl两种共价键中,键的极性较强的是
和H-Cl两种共价键中,键的极性较强的是___________ ,键长较长的是___________ 。
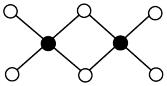
(2)氯化铝通常以双聚物存在,其结构如图所示。 该分子中含
该分子中含___________ 个配位键,该分子___________ (填“是”或“不是”)平面型分子。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色[Cu(NH3)4]SO4•H2O沉淀。
①写出上述实验前两步反应的离子方程式___________ ,___________ 。
②与NH3分子互为等电子体的一种阳离子是___________ 。
③在晶体[Cu(NH3)4]SO4•H2O中,中心原子是sp3杂化的原子有___________ (写元素符号),配离子(内界)中存在的化学键有___________ 。
a、离子键b、共价键c、配位键d、氢键e、范德华力
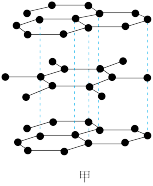
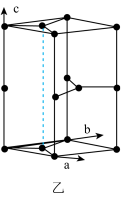
(4)图甲所示石墨晶体按ABAB方式堆积而成,图乙为石墨的六方晶胞。每个晶胞中的碳原子个数为___________ 。

(1)在
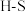 和H-Cl两种共价键中,键的极性较强的是
和H-Cl两种共价键中,键的极性较强的是(2)氯化铝通常以双聚物存在,其结构如图所示。
 该分子中含
该分子中含(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色[Cu(NH3)4]SO4•H2O沉淀。
①写出上述实验前两步反应的离子方程式
②与NH3分子互为等电子体的一种阳离子是
③在晶体[Cu(NH3)4]SO4•H2O中,中心原子是sp3杂化的原子有
a、离子键b、共价键c、配位键d、氢键e、范德华力
(4)图甲所示石墨晶体按ABAB方式堆积而成,图乙为石墨的六方晶胞。每个晶胞中的碳原子个数为


您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为24。
(1)W基态原子的核外电子排布式为___________ ,元素X、Y、Z的第一电离能由大到小的顺序为___________ (用元素符号表达);
(2)与XYZ-互为等电子体的化学式为___________ ;
(3)1mol HYZ3分子中含有σ键的数目为___________ ;
(4)YH3极易溶于水的主要原因是___________ 。
(1)W基态原子的核外电子排布式为
(2)与XYZ-互为等电子体的化学式为
(3)1mol HYZ3分子中含有σ键的数目为
(4)YH3极易溶于水的主要原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:_______ ,B:_______ ,E_______ ,G:_______ 。
(2)C、D、E三种元素的原子半径由大到小的顺序为_______ (用元素符号表示)。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:_______ ,_______ ,_______ 。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为_______ 。
(5)G元素可形成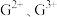 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:_______ 。
(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是_______ 化合物(填“离子”或“共价”)。根据“对角线规则”,元素周期表中某些处于对角的元素,它们的化合物性质具有相似性,则M的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: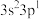 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)C、D、E三种元素的原子半径由大到小的顺序为
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)G元素可形成
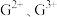 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
【推荐3】硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,请回答:
(1)基态下Fe2+共有_____ 种不同空间运动状态的电子。
(2)Fe2+形成的配合物亚铁氰化钾K4[Fe(CN)6]又称黄血盐,可用于检验Fe3+,与CN-互为等电子体的阴离子为_________ (任写一种);含有120molσ键的K4[Fe(CN)6]的物质的量为_____ mol。
(3)H 2SO4的酸性强于H2SO3酸性的原因是_______ 。
(4)FeS2晶体的晶胞结构如图所示。在晶胞中,Fe2+位于 所形成的
所形成的______ (填“正四面体”或“正八面体”)空隙;若晶胞参数为 a nm,密度为ρg∙cm−3,阿伏加德罗常数的值为NA ,则FeS2的摩尔质量 M=_______ (用含 a、ρ、 NA的代数式表示)。

(1)基态下Fe2+共有
(2)Fe2+形成的配合物亚铁氰化钾K4[Fe(CN)6]又称黄血盐,可用于检验Fe3+,与CN-互为等电子体的阴离子为
(3)H 2SO4的酸性强于H2SO3酸性的原因是
(4)FeS2晶体的晶胞结构如图所示。在晶胞中,Fe2+位于
 所形成的
所形成的
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铜,硫单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)科学家通过X射线测得胆矾结构示意图可简单表示如下:
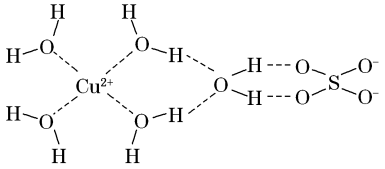
图中虚线表示的作用力为___________ 。Cu2+的核外电子排布式:___________ ,该结构中氢,氧,硫这三种元素电负性由大到小的顺序:___________ (用元素符号表示)
(2)SO2分子的立体结构是___________ ,相同条件下SO2与CO2分子在水中的溶解度较大的是___________ (写分子式),理由是___________ 。
(3)第一电离能介于B、N之间的第二周期元素有___________ 种。S单质的常见形式为S8,其环状结构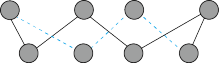 ,S原子采用的轨道杂化方式是
,S原子采用的轨道杂化方式是___________
(4)分子或离子中的大π键可表示为 ,其中x表示参与形成大π键原子总数,y表示π电子数,已知π电子数=价电子总数-(σ电子对数+孤电子对数)×2.则SO3的大π键可表示为
,其中x表示参与形成大π键原子总数,y表示π电子数,已知π电子数=价电子总数-(σ电子对数+孤电子对数)×2.则SO3的大π键可表示为___________ 。
(1)科学家通过X射线测得胆矾结构示意图可简单表示如下:

图中虚线表示的作用力为
(2)SO2分子的立体结构是
(3)第一电离能介于B、N之间的第二周期元素有
 ,S原子采用的轨道杂化方式是
,S原子采用的轨道杂化方式是(4)分子或离子中的大π键可表示为
 ,其中x表示参与形成大π键原子总数,y表示π电子数,已知π电子数=价电子总数-(σ电子对数+孤电子对数)×2.则SO3的大π键可表示为
,其中x表示参与形成大π键原子总数,y表示π电子数,已知π电子数=价电子总数-(σ电子对数+孤电子对数)×2.则SO3的大π键可表示为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】CuBr为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备CuBr的流程如下: 平衡。
平衡。
请回答下列问题:
(1)“浸取”阶段的产物为[Cu(NH3)2]Br。___________  键。
键。
②其他条件不变,Cu浸出率与温度关系如图所示。
请解释 以前随温度升高,Cu浸出率增大的原因:
以前随温度升高,Cu浸出率增大的原因:___________ 。
③该阶段被氧化的铜元素与被还原的铜元素质量之比为___________ 。
(2)“氧化”阶段试剂X选用___________ (填“液氨”“浓氨水”或“稀氨水”)更好,试从平衡移动角度解释其原因:___________ 。
(3)补全“沉铜”阶段的离子方程式:___________ =CuBr↓+2NH 。
。
(4)洗涤时宜选用___________ (填“冷水”或“乙醇”)。

 平衡。
平衡。请回答下列问题:
(1)“浸取”阶段的产物为[Cu(NH3)2]Br。

 键。
键。②其他条件不变,Cu浸出率与温度关系如图所示。
请解释
 以前随温度升高,Cu浸出率增大的原因:
以前随温度升高,Cu浸出率增大的原因:③该阶段被氧化的铜元素与被还原的铜元素质量之比为
(2)“氧化”阶段试剂X选用
(3)补全“沉铜”阶段的离子方程式:
 。
。(4)洗涤时宜选用
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】O、S、Se、Te是元素周期表中第ⅥA族元素。
(1)第ⅥA族元素原子的价层电子排布式为_______ 。
(2)常压下, 、
、 、
、 的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为
的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为_______ 。
(3)半胱氨酸亚金钠可用于配制无氰镀金溶液,其结构简式如图所示。
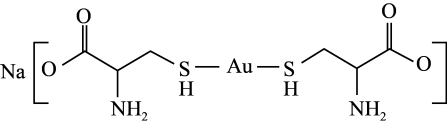
①半胱氨酸亚金钠中,碳原子的杂化轨道类型为_______ 。
②半胱氨酸亚金钠晶体中,不存在的化学键是_______ (填标号)。
A.共价键 B.离子键 C.金属键 D.配位键
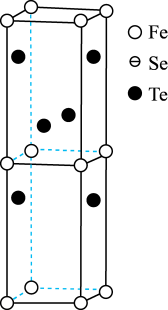
(4)FexSeyTez是一种准二维结构的铁系超导材料,其晶胞示意图如图所示。
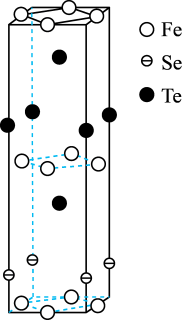
①
_______ 。
②若以铁原子为晶胞顶点,请在图中补画出铁、硒原子_______ 。
(1)第ⅥA族元素原子的价层电子排布式为
(2)常压下,
 、
、 、
、 的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为
的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为(3)半胱氨酸亚金钠可用于配制无氰镀金溶液,其结构简式如图所示。
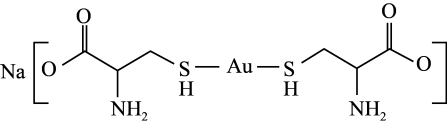
①半胱氨酸亚金钠中,碳原子的杂化轨道类型为
②半胱氨酸亚金钠晶体中,不存在的化学键是
A.共价键 B.离子键 C.金属键 D.配位键
(4)FexSeyTez是一种准二维结构的铁系超导材料,其晶胞示意图如图所示。

①

②若以铁原子为晶胞顶点,请在图中补画出铁、硒原子

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】元素周期表中第三、四周期的某些元素在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
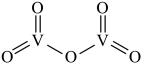
①钒的价电子排布图是___________ ;
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为____________ ;若将V2O5溶解在NaOH溶液中,可得到锐酸钠(Na3VO4),该盐中阴离子的立体构型为_____________ ,写出与VO43-空间构型相同的一种阳离子____________ (填化学式)。
(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_______ 。
a.氯化铝是分子晶体 b.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂 d.Al2Cl6中存在配位键
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pmo在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_________________________ 。
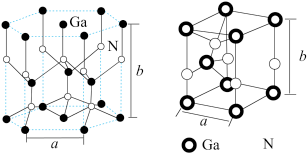
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图所示。已知六棱柱底边边长为acm,高为bcm,阿伏加 德罗常数的值为NA。则晶胞中Ga原子采用的密堆积方式为______________ ,每个Ga原子周围距离最近的Ga原子数目为____ ;GaN的密度为_____________ gem-3(用含a、b、NA的代数式表示)。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为

(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是
a.氯化铝是分子晶体 b.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂 d.Al2Cl6中存在配位键
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pmo在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图所示。已知六棱柱底边边长为acm,高为bcm,阿伏加 德罗常数的值为NA。则晶胞中Ga原子采用的密堆积方式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】下列各图为几种晶体或晶胞的结构示意图。
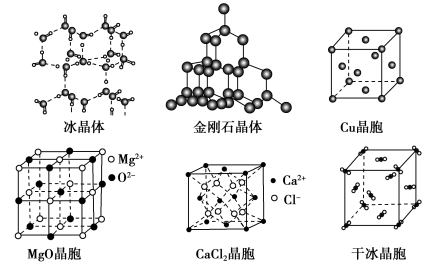
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体的是____ 。
(2)冰、金刚石、CaCl2、干冰4种晶体的熔点由高到低的顺序是____ 。
(3)NaCl晶胞与MgO晶胞结构相同,NaCl晶胞的熔、沸点、硬度较MgO晶体的____ (填“大于”或“小于”),原因是____ 。
(4)每个Cu晶胞中实际含有____ 个Cu原子,CaCl2晶体中每个Ca2+周围距离最近且相等的Cl-有____ 个。

请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体的是
(2)冰、金刚石、CaCl2、干冰4种晶体的熔点由高到低的顺序是
(3)NaCl晶胞与MgO晶胞结构相同,NaCl晶胞的熔、沸点、硬度较MgO晶体的
(4)每个Cu晶胞中实际含有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】2020年12月17日凌晨1时59分,“嫦娥五号”首次实现了我国地外天体采样返回,标志着我国航天事业迈出了一大步。带回的月壤中包含了H、O、C、N、S等多种元素。回答下列问题:
(1)CH4、NH3、H2S中键长最短的是___________ ,该分子的空间构型为___________ 。
(2)CH3NH 中N原子的杂化方式为
中N原子的杂化方式为___________ ,从化学键的角度解释由甲胺CH3NH2形成CH3NH 的过程:
的过程:___________ 。
(3) 是某有机物与甘氨酸形成的离子化合物,常温下为液体而非固态,原因是
是某有机物与甘氨酸形成的离子化合物,常温下为液体而非固态,原因是___________ 。
(4)H2NCH2CH2NH2形成配合物[TiCl4(H2NCH2CH2NH2)]后,H-N-H键角将___________ (填“增大”“减少”或“不变”);化合物 与
与 相比,水溶性较好的是
相比,水溶性较好的是___________ 。
(5)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如图所示。

每个基本结构单元(图中实线圈部分)中四个N原子(图中虚线圈所示)被O原子代替,形成O掺杂的g-C3N4(OPCN)。OPCN的化学式为___________ 。
(1)CH4、NH3、H2S中键长最短的是
(2)CH3NH
 中N原子的杂化方式为
中N原子的杂化方式为 的过程:
的过程:(3)
 是某有机物与甘氨酸形成的离子化合物,常温下为液体而非固态,原因是
是某有机物与甘氨酸形成的离子化合物,常温下为液体而非固态,原因是(4)H2NCH2CH2NH2形成配合物[TiCl4(H2NCH2CH2NH2)]后,H-N-H键角将
 与
与 相比,水溶性较好的是
相比,水溶性较好的是(5)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如图所示。

每个基本结构单元(图中实线圈部分)中四个N原子(图中虚线圈所示)被O原子代替,形成O掺杂的g-C3N4(OPCN)。OPCN的化学式为
您最近一年使用:0次



