在碱性溶液中Na2Sx与NaClO反应,生成两种可溶盐溶液。在该混合液中加入BaCl2或AgNO3溶液都会生成不溶于稀酸的白色沉淀。经测试:1molNa2Sx与消耗6molNaOH恰好完全反应。x的值为._______ ;Na2Sx与NaClO反应的离子方程式是_______ 。
2007高二·安徽·竞赛 查看更多[1]
更新时间:2021-08-07 16:22:38
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】Ⅰ(1)标准状况下,1.7 g NH3与_______ L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________ 。
(3)常温常压下22.4升CO2中分子个数___ 64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______ mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________ mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________ 。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2mol•L﹣1、0.25mol•L﹣1、0.4mol•L﹣1,则c(SO42﹣)=__________ .
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________ 。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________ ,NH3的体积分数为______________ .
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________ mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________ 。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________ 。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________ 。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________ 。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________ 。
(2)2 mol的CO2与3 mol的SO3的原子数之比是
(3)常温常压下22.4升CO2中分子个数
(4)标准状况下,33.6L的NH3所含电子的物质的量约为
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2mol•L﹣1、0.25mol•L﹣1、0.4mol•L﹣1,则c(SO42﹣)=
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:
(2)铁与水蒸气高温下反应的化学方程式:
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】磷是一种重要的元素。回答下列问题:
(1)磷的氢化物在空气中能自燃,写出磷的最简单氢化物的电子式:_______ ,白磷也能自燃且有剧毒, 溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:
溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:________
_______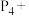 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(2)次磷酸( )是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g
)是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g  最多可中和100 mL 1mol·L
最多可中和100 mL 1mol·L NaOH溶液,则次磷酸中磷的化合价为
NaOH溶液,则次磷酸中磷的化合价为_______ 价,它是_______ 元酸。利用 和
和 溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:
溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:_______ 。
(3)已知 是二元酸,常温下电离常数分别为0.01、
是二元酸,常温下电离常数分别为0.01、 。
。
① 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为_______ ,下列对 的分类中错误的是
的分类中错误的是_______ (填字母)。
A.酸式盐 B.正盐 C.钠盐 D.磷酸盐
②亚磷酸可使酸性 溶液褪色,该反应生成
溶液褪色,该反应生成 和
和 的离子方程式为
的离子方程式为_______ 。
③常温下, ,则
,则 与足量
与足量 溶液混合反应时,消耗的酸与盐的物质的量之比为
溶液混合反应时,消耗的酸与盐的物质的量之比为_______ 。
(1)磷的氢化物在空气中能自燃,写出磷的最简单氢化物的电子式:
 溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:
溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:_______
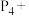 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(2)次磷酸(
 )是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g
)是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g  最多可中和100 mL 1mol·L
最多可中和100 mL 1mol·L NaOH溶液,则次磷酸中磷的化合价为
NaOH溶液,则次磷酸中磷的化合价为 和
和 溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:
溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:(3)已知
 是二元酸,常温下电离常数分别为0.01、
是二元酸,常温下电离常数分别为0.01、 。
。①
 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 的分类中错误的是
的分类中错误的是A.酸式盐 B.正盐 C.钠盐 D.磷酸盐
②亚磷酸可使酸性
 溶液褪色,该反应生成
溶液褪色,该反应生成 和
和 的离子方程式为
的离子方程式为③常温下,
 ,则
,则 与足量
与足量 溶液混合反应时,消耗的酸与盐的物质的量之比为
溶液混合反应时,消耗的酸与盐的物质的量之比为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】(Ⅰ)地壳中含量第一的金属元素构成的单质A与化合物B(分子量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B。则
(1)写出构成金属单质A的元素在周期表中的位置为____________ 。
(2)写出D与水蒸气反应的化学方程式____________ 。
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
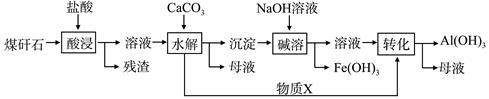
(3)物质X的化学式为___________ 。“碱溶”时反应的离子方程式为_____________ 。
(4)为加快“酸浸”时的速率,可采取的措施有____________ 、___________ 等。(填两种即可)
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是______________ 。
(1)写出构成金属单质A的元素在周期表中的位置为
(2)写出D与水蒸气反应的化学方程式
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

(3)物质X的化学式为
(4)为加快“酸浸”时的速率,可采取的措施有
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。
(1)实验室制取乙炔的化学方程式为___________________________ 。
(2)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图A所示。用CO2和氨气合成尿素的热化学方程式为___________________________ 。
(3)合理利用CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸(△H<0)。在不同温度下催化剂的催化效率与乙酸的生成速率分别如上图B所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________ 。250℃和400℃时乙酸的生成速率几乎相等,实际生产中应选择的温度为_________ ℃。
(4)T℃时,将等物质的量的NO和CO充入体积为2L的 密闭容器中发生反应2NO+2CO 2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将______ (填“向左”、“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______ (填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____________ (任答一条即可)。
(5)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,可用电解原理将溶液中的氨氮物质完全氧化除去。该过程分为两步:第一步:电解产生氯气;第二步:利用氯气将氨氮物质氧化为N2。
①第二步反应的化学方程式为____________________ 。
②若垃圾渗滤液中氨氮物质的质量分数为0. 034% ,理论上用电解法净化It该污水,
电路中转移的电子数为__________ 。
(1)实验室制取乙炔的化学方程式为
(2)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图A所示。用CO2和氨气合成尿素的热化学方程式为

(3)合理利用CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸(△H<0)。在不同温度下催化剂的催化效率与乙酸的生成速率分别如上图B所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是
(4)T℃时,将等物质的量的NO和CO充入体积为2L的 密闭容器中发生反应2NO+2CO
 2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将
②图中a、b分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
(5)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,可用电解原理将溶液中的氨氮物质完全氧化除去。该过程分为两步:第一步:电解产生氯气;第二步:利用氯气将氨氮物质氧化为N2。
①第二步反应的化学方程式为
②若垃圾渗滤液中氨氮物质的质量分数为0. 034% ,理论上用电解法净化It该污水,
电路中转移的电子数为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: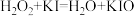 ;
;
反应②: 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。

4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为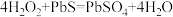 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
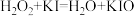 ;
;反应②:
 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.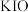 | D. |
A.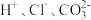 | B.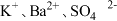 |
C. | D.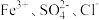 |

4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为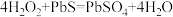 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.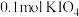 | B.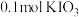 | C.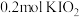 | D.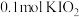 |
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】燃料电池在工业生产中有重要用途,肼燃料电池产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示。回答下列问题
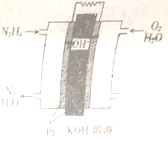
(1)该燃料电池中,负极通入的气体是_________ ,正极通入的气体是_________ .
(2)电池工作时,OH-向_____ 极移动,负极的电极反应式为_________ .
(3)肼在工业上常以氨和次氯酸钠为原料制得,其反应的化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,该反应中每生成1molN2H4时,转移电子的物质的量为______ 。

(1)该燃料电池中,负极通入的气体是
(2)电池工作时,OH-向
(3)肼在工业上常以氨和次氯酸钠为原料制得,其反应的化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,该反应中每生成1molN2H4时,转移电子的物质的量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】实验室常用NH4Cl(饱和)与NaNO2(饱和)加热制备N2。
(1)该制备反应的离子方程式为_______ 。
(2)用该方法制得的N2气中常含有H2O、NO、O2、NH3等杂质,请分别写出除去O2和NH3所用的化学物质,O2:_______ ;NH3_______ 。
(3)上述除杂实验装置中,除去杂质_______ 的装置应该放在最后一步。
(1)该制备反应的离子方程式为
(2)用该方法制得的N2气中常含有H2O、NO、O2、NH3等杂质,请分别写出除去O2和NH3所用的化学物质,O2:
(3)上述除杂实验装置中,除去杂质
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】镅(Am)是一种用途广泛的铜系元素。241Am的放射性强度是镭的3倍,在我国各地商场里常常可见到241Am骨密度测定仪,检测人体是否缺钙:用241Am制作的烟雾监测元件已广泛用于我国各地建筑物的火警报警器(制作火警报警器的1片241Am我国批发价仅10元左右)。镅在酸性水溶液里的氧化态和标准电极电势(E /V)如下,图中2.62是Am4+/Am3+的标准电极电势,-2.07是Am3+/Am的标准电极电势,等等。一般而言,发生自发的氧化还原反应的条件是氧化剂的标准电极电势大于还原剂的标准电极电势。
/V)如下,图中2.62是Am4+/Am3+的标准电极电势,-2.07是Am3+/Am的标准电极电势,等等。一般而言,发生自发的氧化还原反应的条件是氧化剂的标准电极电势大于还原剂的标准电极电势。

试判断金属镅溶于过量稀盐酸溶液后将以什么离子形态存在_____ 。简述理由_____ 。
附:E (H+/H2)=0V;E
(H+/H2)=0V;E (Cl2/Cl-)=1.36V;E
(Cl2/Cl-)=1.36V;E (O2/H2O)=1.23V。
(O2/H2O)=1.23V。
 /V)如下,图中2.62是Am4+/Am3+的标准电极电势,-2.07是Am3+/Am的标准电极电势,等等。一般而言,发生自发的氧化还原反应的条件是氧化剂的标准电极电势大于还原剂的标准电极电势。
/V)如下,图中2.62是Am4+/Am3+的标准电极电势,-2.07是Am3+/Am的标准电极电势,等等。一般而言,发生自发的氧化还原反应的条件是氧化剂的标准电极电势大于还原剂的标准电极电势。
试判断金属镅溶于过量稀盐酸溶液后将以什么离子形态存在
附:E
 (H+/H2)=0V;E
(H+/H2)=0V;E (Cl2/Cl-)=1.36V;E
(Cl2/Cl-)=1.36V;E (O2/H2O)=1.23V。
(O2/H2O)=1.23V。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】最近美国科学家在《自然》杂志上称,研制出了全球最纤薄的发电机,这种发电机的材料由单个原子厚度的二硫化钼(MoS2) 制得。
(1)高温硫化法是目前研究比较成熟的方法,即在高温下以硫或硫化氢对单质钼或三氧化钼进行硫化制得纳米MoS2。若在高温下硫化氢进行硫化三氧化钼时,还生成一种硫单质(分子结构可表示为 )。写出该反应的化学方程式
)。写出该反应的化学方程式_______ 。
(2)目前工业上冶炼钼是以辉钼矿(主要成分是MoS2)为原料,其反应原理如下:
①2MoS2+7O2=2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③2(NH4)2MoO4+2HCl=H2MoO4+2NH4Cl
④H2MoO4=MoO3+H2O
实践证明该生产方法在原理①煅烧过程有3%的钼损失,在后续氨浸过程中又有5%的钼损失。假设工业上要生产1t的MoO3,需要_______ t含82%MoS2的精钼矿。上述方法的缺点是要损失较多的钼,为了克服该缺点可改用次氯酸钠制作为氧化浸出剂.(在浸出过程中, Mo被氧化为钼酸盐进入溶液中,硫元素被氧化为硫酸盐)。若用次氯酸钠作为氧化浸出剂,要生产1tMoO3需要消耗_______ t次氯酸钠。
(1)高温硫化法是目前研究比较成熟的方法,即在高温下以硫或硫化氢对单质钼或三氧化钼进行硫化制得纳米MoS2。若在高温下硫化氢进行硫化三氧化钼时,还生成一种硫单质(分子结构可表示为
 )。写出该反应的化学方程式
)。写出该反应的化学方程式(2)目前工业上冶炼钼是以辉钼矿(主要成分是MoS2)为原料,其反应原理如下:
①2MoS2+7O2=2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③2(NH4)2MoO4+2HCl=H2MoO4+2NH4Cl
④H2MoO4=MoO3+H2O
实践证明该生产方法在原理①煅烧过程有3%的钼损失,在后续氨浸过程中又有5%的钼损失。假设工业上要生产1t的MoO3,需要
您最近一年使用:0次



