亚硫酸钠和硫代硫酸钠(Na2S2O3)都是重要的含硫化合物。某化学兴趣小组进行以下有关实验,填写下列空白。
实验I:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有_______ (填标号)。
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是_______ 。
实验I:制取硫代硫酸钠晶体
利用如图所示装置进行实验,已知硫代硫酸钠能与酸发生反应。

(2)装置d中发生反应的化学方程式为_______ 。
(3)装置C的作用是_______ 。
(4)装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是_______ ,待d中溶液冷却后,倒入蒸发皿,蒸发浓缩,冷却、结晶……获得硫代硫酸钠晶体。
实验III:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用nmol·L-1I2标准溶液滴定(发生反应:2 +I2=
+I2= +2I-),至滴定终点共消耗标准溶液VmL。
+2I-),至滴定终点共消耗标准溶液VmL。
(5)样品中Na2S2O3的百分含量为_______ (用代数式表示)。
实验I:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是
实验I:制取硫代硫酸钠晶体
利用如图所示装置进行实验,已知硫代硫酸钠能与酸发生反应。

(2)装置d中发生反应的化学方程式为
(3)装置C的作用是
(4)装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是
实验III:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用nmol·L-1I2标准溶液滴定(发生反应:2
 +I2=
+I2= +2I-),至滴定终点共消耗标准溶液VmL。
+2I-),至滴定终点共消耗标准溶液VmL。(5)样品中Na2S2O3的百分含量为
更新时间:2021-08-16 10:03:09
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】硫酸盐(含 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: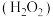 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。
① 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生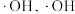 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:
反应Ⅰ: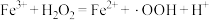 (慢反应);
(慢反应);
反应Ⅱ: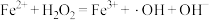 (快反应).
(快反应).
下列说法正确的是________ (填选项字母)。
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气, 氧化
氧化 的反应速率加快
的反应速率加快
D.与 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高
②研究表明 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:
Ⅰ.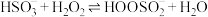 ;
;
Ⅱ.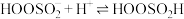 ;
;
Ⅲ.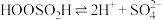 。
。
由此可判断,该条件下的 值为
值为__________ (填“ ”“
”“ ”或“
”或“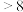 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:____________ 。
(2) 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
Ⅰ.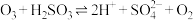 ;
;
Ⅱ. ;
;
Ⅲ.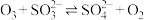 。
。
在含硫微粒总的物质的量为 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得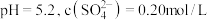 ,则
,则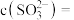
____________ (保留两位有效数字,请写出计算过程)。
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示: 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠________________ 形成;写出 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:____________________ 。
②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是________________ 。
 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: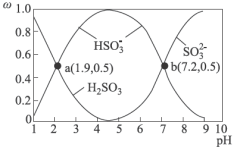
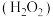 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。①
 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生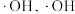 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:反应Ⅰ:
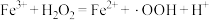 (慢反应);
(慢反应);反应Ⅱ:
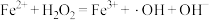 (快反应).
(快反应).下列说法正确的是
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气,
 氧化
氧化 的反应速率加快
的反应速率加快D.与
 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高②研究表明
 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:Ⅰ.
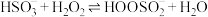 ;
;Ⅱ.
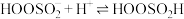 ;
;Ⅲ.
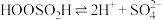 。
。由此可判断,该条件下的
 值为
值为 ”“
”“ ”或“
”或“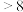 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:(2)
 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:Ⅰ.
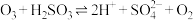 ;
;Ⅱ.
 ;
;Ⅲ.
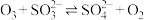 。
。在含硫微粒总的物质的量为
 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得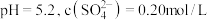 ,则
,则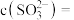
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示:
 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】大气污染物的主要成分是SO2、NO2、NO、CO及可吸入颗粒等,其主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)下列物质,能吸收SO2同时得到化肥的是___________。
(2)硫及其部分化合物的“价-类”二维图如下图所示,下列说法正确的是___________。
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收废气中的SO2并制备(NH4)2SO3·H2O,过程如下图所示:___________ 。
A.变大 B.变小 C.不变
“制备”过程中,溶液B中发生反应的化学方程式为___________ 。
(4)硫酸盐(含 、
、 )气溶胶是PM2.5的成分之一,PM2.5指的是空气中直径≤2.5微米的颗粒物。科研人员通过研究提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程如下图所示:
)气溶胶是PM2.5的成分之一,PM2.5指的是空气中直径≤2.5微米的颗粒物。科研人员通过研究提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程如下图所示:
(5)工业上以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。
①“脱硫”时,控制溶液的pH=5.5,将烟气中的SO2转化为 ,已知0.1mol·L-1100mLNaClO溶液,可以恰好吸收0.01molSO2。该反应的离子方程式为
,已知0.1mol·L-1100mLNaClO溶液,可以恰好吸收0.01molSO2。该反应的离子方程式为___________ 。
②“脱硝”时,在酸性NaClO溶液中,HClO氧化NO生成 和N
和N ,该过程应在避光条件下进行,其可能的原因是
,该过程应在避光条件下进行,其可能的原因是___________ 。
(6)汽车尾气中的NO和CO在催化剂作用下发生反应转化为CO2和N2,下列说法正确的是___________。(NA为阿伏加德罗常数的值)
(7)回收利用工业废气中的CO2和SO2,原理示意图如下图。___________ 。
A.废气中 排放到大气中会形成酸雨
排放到大气中会形成酸雨
B.装置 中溶液显碱性的原因是
中溶液显碱性的原因是 的水解程度大于
的水解程度大于 的电离程度
的电离程度
C.装置 中溶液的作用是吸收废气中的
中溶液的作用是吸收废气中的 和
和
D.装置2中电极b和电源的正极相连
写出装置2中电极a的反应式___________ 。
(1)下列物质,能吸收SO2同时得到化肥的是___________。
| A.碱石灰 | B.酸性KMnO4溶液 | C.氨水 | D.浓H2SO4 |
(2)硫及其部分化合物的“价-类”二维图如下图所示,下列说法正确的是___________。
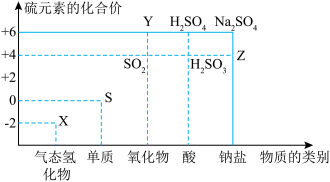
| A.X可与SO2反应生成S | B.Y可由S和O2化合生成 |
| C.Z的水溶液一定呈碱性 | D.不能用浓硫酸干燥SO2 |
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收废气中的SO2并制备(NH4)2SO3·H2O,过程如下图所示:

A.变大 B.变小 C.不变
“制备”过程中,溶液B中发生反应的化学方程式为
(4)硫酸盐(含
 、
、 )气溶胶是PM2.5的成分之一,PM2.5指的是空气中直径≤2.5微米的颗粒物。科研人员通过研究提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程如下图所示:
)气溶胶是PM2.5的成分之一,PM2.5指的是空气中直径≤2.5微米的颗粒物。科研人员通过研究提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程如下图所示:
| A.PM2.5的颗粒为胶体粒子 | B.该过程中有硫氧键生成 |
| C.硫酸盐气溶胶呈碱性 | D.该过程中有H2O参与 |
(5)工业上以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。
①“脱硫”时,控制溶液的pH=5.5,将烟气中的SO2转化为
 ,已知0.1mol·L-1100mLNaClO溶液,可以恰好吸收0.01molSO2。该反应的离子方程式为
,已知0.1mol·L-1100mLNaClO溶液,可以恰好吸收0.01molSO2。该反应的离子方程式为②“脱硝”时,在酸性NaClO溶液中,HClO氧化NO生成
 和N
和N ,该过程应在避光条件下进行,其可能的原因是
,该过程应在避光条件下进行,其可能的原因是(6)汽车尾气中的NO和CO在催化剂作用下发生反应转化为CO2和N2,下列说法正确的是___________。(NA为阿伏加德罗常数的值)
| A.生成1molCO2转移电子的数目为4NA | B.催化剂能提高CO的转化率 |
| C.NO是氧化剂 | D.CO2是还原产物 |
(7)回收利用工业废气中的CO2和SO2,原理示意图如下图。
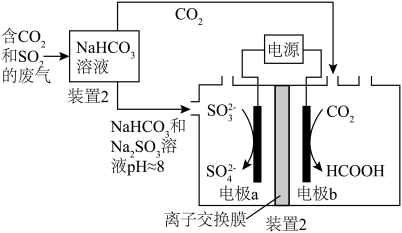
A.废气中
 排放到大气中会形成酸雨
排放到大气中会形成酸雨B.装置
 中溶液显碱性的原因是
中溶液显碱性的原因是 的水解程度大于
的水解程度大于 的电离程度
的电离程度C.装置
 中溶液的作用是吸收废气中的
中溶液的作用是吸收废气中的 和
和
D.装置2中电极b和电源的正极相连
写出装置2中电极a的反应式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】化合物X(仅含两种元素)可通过淡黄色固体单质甲与 浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。
浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。

已知:气体乙在标准状况下的密度为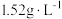 ;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
请回答:
(1)写出组成X的元素符号_______ ,乙的电子式_______ 。
(2)X与足量盐酸反应的化学方程式为_______ 。
(3)气体丙与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(4)请设计实验方案检验溶液丁中的金属阳离子_______ 。
 浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。
浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。
已知:气体乙在标准状况下的密度为
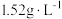 ;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。请回答:
(1)写出组成X的元素符号
(2)X与足量盐酸反应的化学方程式为
(3)气体丙与
 溶液反应的离子方程式为
溶液反应的离子方程式为(4)请设计实验方案检验溶液丁中的金属阳离子
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】2008年6月,云南九大高原湖泊之一的阳宗海发生震惊全国的砷污染事件。在众多环保、水污染治理公司束手无策的情况下,已经73岁高龄、从事冶金研究的中国工程院陈景院士主动请缨,带领团队“跨界”进行阳宗海砷污染治理研究。他和他的团队采用最原始的“抛洒氯化铁”技术,利用铁盐和种形成铁砂共沉淀物,仅用3年,就将阳宗海水质从劣V类重新提升为Ⅱ类。
(1)一种铁砷共沉淀物的化学式为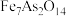 ,其中二价铁和三价铁的个数比为
,其中二价铁和三价铁的个数比为_____ (砷元素为其最高价态)。
阳宗海治理的“功臣”—— 的实验室制备步骤如下:
的实验室制备步骤如下:
I.称取一定量的铁屑于锥形瓶中,加入过量的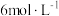 的盐酸,在通风橱中充分反应;
的盐酸,在通风橱中充分反应;
Ⅱ.根据 的理论产量,加入足量的
的理论产量,加入足量的 ;
;
Ⅲ. 溶液通过一系列操作制得无水
溶液通过一系列操作制得无水 。
。
已知不同温度下 在水中的溶解度如下:
在水中的溶解度如下:
(2)步骤Ⅱ及反应的离子方程式为_____ 。检验 可用的试剂是
可用的试剂是_____ 。加入该试剂后出现的现象是_____ 。
(3)从 溶液制得
溶液制得 的操作步骤是:加入足量
的操作步骤是:加入足量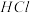 后,
后,_____ 、_____ 、过滤、洗涤、干燥。
(4)过滤后用少量乙醇洗涤 ,选用乙醇原因是
,选用乙醇原因是_____ 。
(5)通常用碘量法测定 的质量分数:称取
的质量分数:称取 无水
无水 样品,溶于稀盐酸,配制成
样品,溶于稀盐酸,配制成 溶液;取出
溶液;取出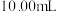 溶液,加入稍过量的
溶液,加入稍过量的 溶液,充分反应后,滴入几滴淀粉溶液,并用
溶液,充分反应后,滴入几滴淀粉溶液,并用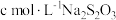 标准液滴定,消耗
标准液滴定,消耗 标准液
标准液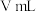 (已知:
(已知: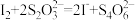 )。
)。
①在测定 质量分数的实验过程中,下列说法正确的是
质量分数的实验过程中,下列说法正确的是_____ 。
A.滴定时,眼睛始终注视滴定管内液面的变化
B.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验测定结果偏低
C.滴定过程中,向锥形瓶中加入少量的蒸馏水,对实验结果无影响
D.若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中 的质量分数的测定结果偏高
的质量分数的测定结果偏高
②滴定至终点的现象是_____ 。
③实验测得的 质量分数为
质量分数为_____  (用含c、V的代数式表示),
(用含c、V的代数式表示),
(6)用无水 配制
配制 溶液时,不能将
溶液时,不能将 直接溶于蒸馏水,而应将其溶于
直接溶于蒸馏水,而应将其溶于_____ 中,结合化学方程式解释原因_____ 。
(1)一种铁砷共沉淀物的化学式为
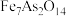 ,其中二价铁和三价铁的个数比为
,其中二价铁和三价铁的个数比为阳宗海治理的“功臣”——
 的实验室制备步骤如下:
的实验室制备步骤如下:I.称取一定量的铁屑于锥形瓶中,加入过量的
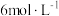 的盐酸,在通风橱中充分反应;
的盐酸,在通风橱中充分反应;Ⅱ.根据
 的理论产量,加入足量的
的理论产量,加入足量的 ;
;Ⅲ.
 溶液通过一系列操作制得无水
溶液通过一系列操作制得无水 。
。已知不同温度下
 在水中的溶解度如下:
在水中的溶解度如下:温度/ | 0 | 20 | 80 | 100 |
溶解度/(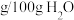 ) ) | 74.4 | 91.8 | 525.8 | 535.7 |
(2)步骤Ⅱ及反应的离子方程式为
 可用的试剂是
可用的试剂是(3)从
 溶液制得
溶液制得 的操作步骤是:加入足量
的操作步骤是:加入足量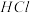 后,
后,(4)过滤后用少量乙醇洗涤
 ,选用乙醇原因是
,选用乙醇原因是(5)通常用碘量法测定
 的质量分数:称取
的质量分数:称取 无水
无水 样品,溶于稀盐酸,配制成
样品,溶于稀盐酸,配制成 溶液;取出
溶液;取出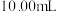 溶液,加入稍过量的
溶液,加入稍过量的 溶液,充分反应后,滴入几滴淀粉溶液,并用
溶液,充分反应后,滴入几滴淀粉溶液,并用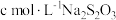 标准液滴定,消耗
标准液滴定,消耗 标准液
标准液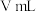 (已知:
(已知: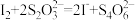 )。
)。①在测定
 质量分数的实验过程中,下列说法正确的是
质量分数的实验过程中,下列说法正确的是A.滴定时,眼睛始终注视滴定管内液面的变化
B.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验测定结果偏低
C.滴定过程中,向锥形瓶中加入少量的蒸馏水,对实验结果无影响
D.若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中
 的质量分数的测定结果偏高
的质量分数的测定结果偏高②滴定至终点的现象是
③实验测得的
 质量分数为
质量分数为 (用含c、V的代数式表示),
(用含c、V的代数式表示),(6)用无水
 配制
配制 溶液时,不能将
溶液时,不能将 直接溶于蒸馏水,而应将其溶于
直接溶于蒸馏水,而应将其溶于
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】二草酸合铜( II )酸钾晶体{K2[Cu(C2O4)2]·2H2O},微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。
I.用氧化铜和草酸为原料制备二草酸合铜(II)酸钾晶体的流程如下:
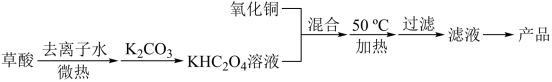
已知:H2C2O4 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
回答下列问题:
(1)将H2C2O4晶体加入去离子水中,微热。
(2)将CuO与KHC2O4的混合液在50℃下充分反应,该反应的化学方程式为_________ 。
(3)50oC时,加热至反应充分后的操作是___________ (填字母)。
A.放于冰水中冷却后过滤 B.蒸发浓缩、冷却后过滤 C.自然冷却后过滤 D.趁热过滤
II.以CuSO4·5H2O晶体和K2C2O4固体为原料制备二草酸合铜( II )酸钾晶体。
实验步骤:将CuSO4·5H2O晶体和K2C2O4固体分别用去离子水溶解后,将K2C2O4溶液逐滴加入硫酸铜溶液中,有晶体析出后放在冰水中冷却,过滤,用酒精洗涤,在水浴锅上炒干。炒时不断搅拌,得到产品。
(4)用酒精而不用冷水洗涤的目的是___________ 。
Ⅲ.产品纯度的测定:准确称取制得的晶体试样ag溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL,再加入10 mL稀硫酸,用b mol·L-1的KMnO4标准液滴定,消耗KMnO4标准液V mL。
(5)滴定时,下列滴定方式中,最合理的是___________ (填字母)。(夹持部分略去)
A.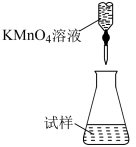 B.
B.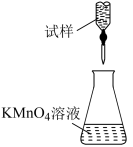 C.
C.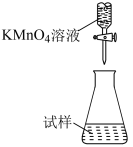
(6)滴定终点时的实验现象为___________ 。
(7)该产品的纯度为___________ (写出表达式)。
I.用氧化铜和草酸为原料制备二草酸合铜(II)酸钾晶体的流程如下:

已知:H2C2O4
 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O回答下列问题:
(1)将H2C2O4晶体加入去离子水中,微热。
(2)将CuO与KHC2O4的混合液在50℃下充分反应,该反应的化学方程式为
(3)50oC时,加热至反应充分后的操作是
A.放于冰水中冷却后过滤 B.蒸发浓缩、冷却后过滤 C.自然冷却后过滤 D.趁热过滤
II.以CuSO4·5H2O晶体和K2C2O4固体为原料制备二草酸合铜( II )酸钾晶体。
实验步骤:将CuSO4·5H2O晶体和K2C2O4固体分别用去离子水溶解后,将K2C2O4溶液逐滴加入硫酸铜溶液中,有晶体析出后放在冰水中冷却,过滤,用酒精洗涤,在水浴锅上炒干。炒时不断搅拌,得到产品。
(4)用酒精而不用冷水洗涤的目的是
Ⅲ.产品纯度的测定:准确称取制得的晶体试样ag溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL,再加入10 mL稀硫酸,用b mol·L-1的KMnO4标准液滴定,消耗KMnO4标准液V mL。
(5)滴定时,下列滴定方式中,最合理的是
A.
 B.
B. C.
C.
(6)滴定终点时的实验现象为
(7)该产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】次氯酸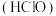 是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。
是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。
I.某学习小组设计下列装置制备 并验证其氧化性(夹持仪器及降温装置已省略)。
并验证其氧化性(夹持仪器及降温装置已省略)。
已知:①次氯酸的浓溶液呈黄色
② 为棕黄色气体,极易溶于水并迅速反应生成
为棕黄色气体,极易溶于水并迅速反应生成

回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为___________ , 的结构式为
的结构式为___________ , 俗称
俗称___________ (写出一个即可)。
(2)制备 时要打开
时要打开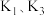 ,关闭
,关闭 ,待装置
,待装置 中反应结束时再通入一段时间
中反应结束时再通入一段时间 。
。
①仪器 中制备
中制备 时,发生反应为
时,发生反应为 ,该反应的氧化剂为
,该反应的氧化剂为___________ (填化学式)。
②仪器B、D中的试剂分别为___________ (填字母)。
a.浓 b.饱和食盐水、
b.饱和食盐水、 c.饱和食盐水、浓
c.饱和食盐水、浓
③搅拌器的作用主要是___________ 。
(3)验证 的氧化性时要向
的氧化性时要向 中加入过量
中加入过量 并充分搅拌,待溶液变澄清时停止搅拌。反应结束时,
并充分搅拌,待溶液变澄清时停止搅拌。反应结束时, 的溶液中含有的离子主要有
的溶液中含有的离子主要有 ,写出反应的离子方程式
,写出反应的离子方程式___________ 。
II. 是次氯酸工业重要的衍生产品,某实验小组的同学测定
是次氯酸工业重要的衍生产品,某实验小组的同学测定 晶体的纯度过程如下:取样品
晶体的纯度过程如下:取样品 配制成
配制成 溶液,从中取出
溶液,从中取出 ,加入足量
,加入足量 固体和适量稀
固体和适量稀 ,再滴加几滴淀粉溶液,(已知:
,再滴加几滴淀粉溶液,(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为
标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为 (已知:
(已知: )。
)。
(4)下列滴定操作会导致测量结果偏低的是___________ (填字母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体浅出
c.滴定终点时俯视读数 d.滴定管滴定前有气泡,滴定后气泡消失
(5)样品中 的纯度为
的纯度为___________ (用含 的代数式表示)。
的代数式表示)。
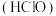 是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。
是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。I.某学习小组设计下列装置制备
 并验证其氧化性(夹持仪器及降温装置已省略)。
并验证其氧化性(夹持仪器及降温装置已省略)。已知:①次氯酸的浓溶液呈黄色
②
 为棕黄色气体,极易溶于水并迅速反应生成
为棕黄色气体,极易溶于水并迅速反应生成

回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为 的结构式为
的结构式为 俗称
俗称(2)制备
 时要打开
时要打开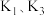 ,关闭
,关闭 ,待装置
,待装置 中反应结束时再通入一段时间
中反应结束时再通入一段时间 。
。①仪器
 中制备
中制备 时,发生反应为
时,发生反应为 ,该反应的氧化剂为
,该反应的氧化剂为②仪器B、D中的试剂分别为
a.浓
 b.饱和食盐水、
b.饱和食盐水、 c.饱和食盐水、浓
c.饱和食盐水、浓
③搅拌器的作用主要是
(3)验证
 的氧化性时要向
的氧化性时要向 中加入过量
中加入过量 并充分搅拌,待溶液变澄清时停止搅拌。反应结束时,
并充分搅拌,待溶液变澄清时停止搅拌。反应结束时, 的溶液中含有的离子主要有
的溶液中含有的离子主要有 ,写出反应的离子方程式
,写出反应的离子方程式II.
 是次氯酸工业重要的衍生产品,某实验小组的同学测定
是次氯酸工业重要的衍生产品,某实验小组的同学测定 晶体的纯度过程如下:取样品
晶体的纯度过程如下:取样品 配制成
配制成 溶液,从中取出
溶液,从中取出 ,加入足量
,加入足量 固体和适量稀
固体和适量稀 ,再滴加几滴淀粉溶液,(已知:
,再滴加几滴淀粉溶液,(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为
标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为 (已知:
(已知: )。
)。(4)下列滴定操作会导致测量结果偏低的是
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体浅出
c.滴定终点时俯视读数 d.滴定管滴定前有气泡,滴定后气泡消失
(5)样品中
 的纯度为
的纯度为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】莫尔盐[(NH4)2Fe(SO4)2・6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
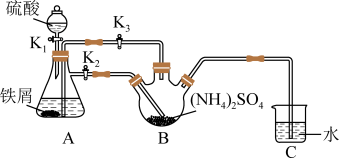
回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检查装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______ (填仪器名称),将6.0g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______ ,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____ 、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为____ ,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1mol・L-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____ ,该样品的纯度为____

回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检查装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、
④装置C的作用为
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1mol・L-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】MnO2在工业上具有广泛的用途,例如用作干电池去极剂、合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
I.在实验室中,可以用MnO2催化分解H2O2或KClO3制备O2。
(1)设计简单的实验验证MnO2对H2O2的分解起催化作用________ 。
(2)如果用MnO2催化分解KCIO3制备并收集O2,应选用的实验装置是_______ 。
若用B装置制备少量的NH3,则a中盛放的药品是_______ 。
II.MnO2是实验室中常见的氧化剂,某化学兴趣小组探究在常温下,MnO2能否氧化酸性NaI溶液。可选用的试剂和仪器有:0.5mol/LNaI溶液,稀硫酸、稀盐酸、CCl4、酒精、分液漏斗、烧杯、漏斗、玻璃棒、酒精灯、温度计、牛角管、锥形瓶、石棉网、铁架台(带铁圈、铁夹)。
实验的步骤如下:
①在小烧杯中加入15mLNaI溶液,加硫酸使其酸化,加适量的MnO2,充分搅拌。
②将所得溶液过滤,观察滤液颜色。
③向滤液中加入5mL萃取剂,充分振荡。
④置于铁架台铁圈上静置。
⑤分液。
⑥将下层得到的含I2溶液进行蒸馏使得到单质I2。
请回答下列问题:
(1)写出步骤①中发生的离子方程式___________ 。
(2)观察步骤②所得滤液的颜色为_______ ,初步判定有单质I2生成。
(3)萃取滤液中的碘单质所用的仪器名称为_______ ,选择的萃取剂是______ 。
(4)步骤④静置后,观察到的现象是_______ 。
(5)简述分液的操作:________ 。
(6)步骤⑥中组装蒸馏装置还缺少的仪器是___________ 。
I.在实验室中,可以用MnO2催化分解H2O2或KClO3制备O2。
(1)设计简单的实验验证MnO2对H2O2的分解起催化作用
(2)如果用MnO2催化分解KCIO3制备并收集O2,应选用的实验装置是

若用B装置制备少量的NH3,则a中盛放的药品是
II.MnO2是实验室中常见的氧化剂,某化学兴趣小组探究在常温下,MnO2能否氧化酸性NaI溶液。可选用的试剂和仪器有:0.5mol/LNaI溶液,稀硫酸、稀盐酸、CCl4、酒精、分液漏斗、烧杯、漏斗、玻璃棒、酒精灯、温度计、牛角管、锥形瓶、石棉网、铁架台(带铁圈、铁夹)。
实验的步骤如下:
①在小烧杯中加入15mLNaI溶液,加硫酸使其酸化,加适量的MnO2,充分搅拌。
②将所得溶液过滤,观察滤液颜色。
③向滤液中加入5mL萃取剂,充分振荡。
④置于铁架台铁圈上静置。
⑤分液。
⑥将下层得到的含I2溶液进行蒸馏使得到单质I2。
请回答下列问题:
(1)写出步骤①中发生的离子方程式
(2)观察步骤②所得滤液的颜色为
(3)萃取滤液中的碘单质所用的仪器名称为
(4)步骤④静置后,观察到的现象是
(5)简述分液的操作:
(6)步骤⑥中组装蒸馏装置还缺少的仪器是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜、粗碲等,以实现有害废料的资源化利用,工艺流程如下:
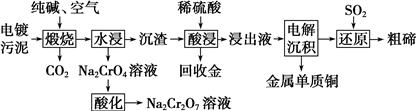
已知:煅烧时Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时Cr2O3发生反应的化学方程式为______________ 。
(2)为提高酸浸速率,可采用的措施是____________ (答出两条)。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________ (填化学式)。电解沉积过程中析出单质铜的电极为_______ 极。
(4)工业上用铬酸钠(Na2Cr2O7)母液生产各酸钾(K2Cr2O7)工艺流程如下图所示:

通过冷却结晶能析出大量K2Cr2O7的原因是____________ 。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为_____________ 。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为_______ ﹪(已知M(K2Cr2O7)=294,计算结果保留三位有效数字)。
(6)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)为3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全_________ (填“是”或“否”)。[已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31]。

已知:煅烧时Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)煅烧时Cr2O3发生反应的化学方程式为
(2)为提高酸浸速率,可采用的措施是
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有
(4)工业上用铬酸钠(Na2Cr2O7)母液生产各酸钾(K2Cr2O7)工艺流程如下图所示:

通过冷却结晶能析出大量K2Cr2O7的原因是
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为
(6)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)为3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】化学小组同学在课外书中看到:“Na着火时不能用CO2熄灭。”它们决定探究CO2与Na反应的产物。
提出猜想:CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
查阅资料:①Na很活泼,易与O2、H2O等物质反应
②向PdCl2溶液中通入CO,能产生黑色沉淀
③Na2CO3是白色固体,易溶于水
④Na2O是白色固体,与H2O反应生成NaOH
⑤CaCl2、NaCl、Na2CO3、NaOH四种溶液分别与无色酚酞溶液作用比较:
实验过程,同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)
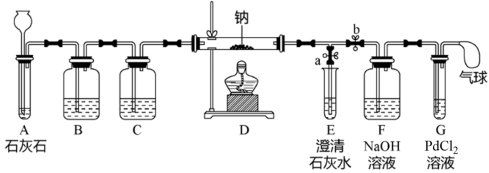
(1)实验记录
(2)实验反思
①实验记录②中,E中出现浑浊再点燃酒精灯的目的是_______
②C中的试剂是_______
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,_______
提出猜想:CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
查阅资料:①Na很活泼,易与O2、H2O等物质反应
②向PdCl2溶液中通入CO,能产生黑色沉淀
③Na2CO3是白色固体,易溶于水
④Na2O是白色固体,与H2O反应生成NaOH
⑤CaCl2、NaCl、Na2CO3、NaOH四种溶液分别与无色酚酞溶液作用比较:
| 分别向右侧溶液中加入无色酚酞溶液 | CaCl2 | NaCl | Na2CO3 | NaOH |
| 主要实验现象 | 无色 | 无色 | 由无色变为红色 | 由无色变为红色 |

(1)实验记录
| 序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
| ① | 打开a,关闭b,由长颈漏斗注入盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的离子方程式为: |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟,内壁附着黑色、白色固体,G中产生黑色沉淀 | 反应产物一定 有 |
| ③ | 取D中白色固体于试管中,加水溶解,再加入几滴CaCl2溶液 | 产生白色沉淀 | 反应产物还有 |
①实验记录②中,E中出现浑浊再点燃酒精灯的目的是
②C中的试剂是
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】如图所示是实验室快速制备氨气与验证氨气性质的装置(部分固定装置已省略)。
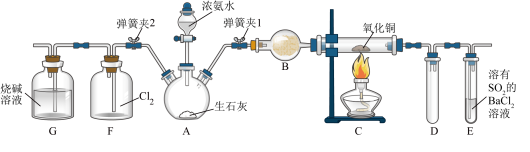
(1)连接好装置后,若要检查 装置的气密性,其操作是先关闭
装置的气密性,其操作是先关闭______ 和______ ,打开______ ,在 中装入水后,用酒精灯微热
中装入水后,用酒精灯微热 ,观察到
,观察到 中有气泡产生,移开酒精灯,
中有气泡产生,移开酒精灯, 中导管有水柱形成,则说明
中导管有水柱形成,则说明 装置的气密性良好。
装置的气密性良好。
(2)请解释 中制取氨气的原理:
中制取氨气的原理:_____________ 。
(3)装置 中盛放的试剂是
中盛放的试剂是______ 。
(4)关闭弹簧夹2,打开弹簧夹1,从分液漏斗中放出浓氨水至浸没烧瓶中的生石灰后,关闭分液漏斗活塞,点燃 处酒精灯,装置
处酒精灯,装置 中黑包固体逐渐变红,装置
中黑包固体逐渐变红,装置 中
中______ (填实验现象);从装置 中逸出的气体可以直接排入空气中,请写出装置
中逸出的气体可以直接排入空气中,请写出装置 中发生反应的化学方程式:
中发生反应的化学方程式:____________ 。
(5)反应结束后,关闭弹簧夹1,打开弹簧夹2,残余气体进入装置 中,很快发现装置
中,很快发现装置 中产生白烟,同时发现装置
中产生白烟,同时发现装置 中溶液发生倒吸流入装置
中溶液发生倒吸流入装置 中,写出装置
中,写出装置 中产生白烟的反应的化学方程式:
中产生白烟的反应的化学方程式:______ ,装置G中溶液发生倒吸的原因是_______ 。

(1)连接好装置后,若要检查
 装置的气密性,其操作是先关闭
装置的气密性,其操作是先关闭 中装入水后,用酒精灯微热
中装入水后,用酒精灯微热 ,观察到
,观察到 中有气泡产生,移开酒精灯,
中有气泡产生,移开酒精灯, 中导管有水柱形成,则说明
中导管有水柱形成,则说明 装置的气密性良好。
装置的气密性良好。(2)请解释
 中制取氨气的原理:
中制取氨气的原理:(3)装置
 中盛放的试剂是
中盛放的试剂是(4)关闭弹簧夹2,打开弹簧夹1,从分液漏斗中放出浓氨水至浸没烧瓶中的生石灰后,关闭分液漏斗活塞,点燃
 处酒精灯,装置
处酒精灯,装置 中黑包固体逐渐变红,装置
中黑包固体逐渐变红,装置 中
中 中逸出的气体可以直接排入空气中,请写出装置
中逸出的气体可以直接排入空气中,请写出装置 中发生反应的化学方程式:
中发生反应的化学方程式:(5)反应结束后,关闭弹簧夹1,打开弹簧夹2,残余气体进入装置
 中,很快发现装置
中,很快发现装置 中产生白烟,同时发现装置
中产生白烟,同时发现装置 中溶液发生倒吸流入装置
中溶液发生倒吸流入装置 中,写出装置
中,写出装置 中产生白烟的反应的化学方程式:
中产生白烟的反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】半导体生产中常需要使用掺杂剂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
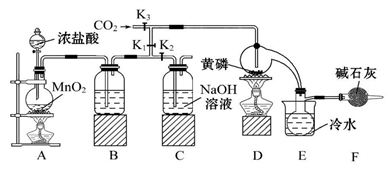
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生成H3PO3和HCl;③PCl3遇O2会生成POCl3,POCl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)B中所装的试剂是____________________ ,F中碱石灰的作用是_____________________________________ 。
(2)实验时,检查装置气密性后,先打开K3、关闭K1,通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是__________ ,通过控制K1、K2能除去A、B装置中的空气,具体的操作是________________________________ 。
(3)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过________ (填实验操作名称),即可得到较纯净的PCl3。
(4)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入淀粉作为指示剂
③向其中加入0.1000 mol·L-1碘水,充分反应,当达到终点时消耗碘水溶液6.9mL。已知:H3PO3+H2O+I2===H3PO4+2HI,假设测定过程中没有其他反应。
滴定时,滴定终点的现象是_________________________________ ,配制0.1000 mol·L-1的碘水溶液的过程中,下列操作会使所得溶液浓度偏大的是___________
A烧杯中溶液转移至容量瓶中时,未洗涤烧杯
B定容时俯视刻度线
C定容时仰视刻度线
D容量瓶未干燥
E移液时有少量液体溅出
F溶解碘时放热,未冷却至室温就转移至容量瓶并定容
根据上述数据,该产品中PCl3的质量分数为________ 。

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生成H3PO3和HCl;③PCl3遇O2会生成POCl3,POCl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装的试剂是
(2)实验时,检查装置气密性后,先打开K3、关闭K1,通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是
(3)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过
(4)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入淀粉作为指示剂
③向其中加入0.1000 mol·L-1碘水,充分反应,当达到终点时消耗碘水溶液6.9mL。已知:H3PO3+H2O+I2===H3PO4+2HI,假设测定过程中没有其他反应。
滴定时,滴定终点的现象是
A烧杯中溶液转移至容量瓶中时,未洗涤烧杯
B定容时俯视刻度线
C定容时仰视刻度线
D容量瓶未干燥
E移液时有少量液体溅出
F溶解碘时放热,未冷却至室温就转移至容量瓶并定容
根据上述数据,该产品中PCl3的质量分数为
您最近一年使用:0次



