氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。_______ ;装置B内的试剂是_______ 。
②装置D中发生反应的离子方程式是_______ ,铜丝可抽动的优点是_______ 。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为_______ 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
用NaOH溶液吸收氮氧化物的最佳条件为:α=_______ ,c(NaOH)=_______ 。
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为_______ 。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
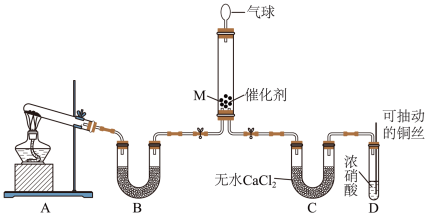
②装置D中发生反应的离子方程式是
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
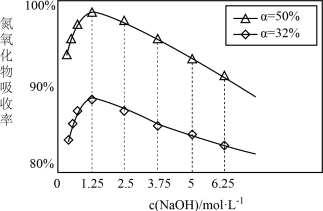
用NaOH溶液吸收氮氧化物的最佳条件为:α=
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为
20-21高一下·山东聊城·期末 查看更多[12]
山东省聊城市2020-2021学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期第一次月考化学试题山东省临沂第一中学2021-2022学年高一下学期第二次教学检测(4月线上)化学试题河北省定州市第二中学2021-2022学年高一下学期期末考试化学试题河北省石家庄精英中学2022-2023高二上学期开学考试化学试题陕西西安三中2022-2023学年高一下学期第二次月考化学试题“贵百河”2023-2024学年高二上学期10月新高考月考测试化学试题广东省高州市第四中学2023-2024学年高一下学期3月月考化学试题江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷 广州市第七十五中学2023-2024学年高一下学期第一次阶段考试化学试题河南省信阳高级中学2023-2024学年高一下学期6月月考化学试卷
更新时间:2021-08-23 20:58:28
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】亚氯酸钠(NaClO2)是一种高效氧化、杀菌及漂白剂,其生产工艺如下:

(1)过程I在生成ClO2的同时,还会得到另一种常见的盐,请写出其化学方程式:_______ 。
(2)过程I中常伴有少量Cl2生成。结合下表,设计实验方案除去ClO2中的Cl2_______ 。
(3)过程Ⅱ中H2O2的作用是_______ 。(填“氧化剂”或“还原剂”)。
(4)理论上每生成1molNaClO2,消耗SO2的质量是_______ 。
(5)已知:i.压强越大,物质的沸点越高。
ii.NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O,38~60℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl
①过程III采用“减压蒸发”操作的原因是_______ 。
②补充完整过程Ⅲ的操作:_______ ,结晶后过滤,可得NaClO2粗产品。

(1)过程I在生成ClO2的同时,还会得到另一种常见的盐,请写出其化学方程式:
(2)过程I中常伴有少量Cl2生成。结合下表,设计实验方案除去ClO2中的Cl2
| ClO2 | Cl2 | |
| 在水中的溶解性 | 易溶 | 溶 |
| 在CCl4中的溶解性 | 难溶 | 溶 |
(4)理论上每生成1molNaClO2,消耗SO2的质量是
(5)已知:i.压强越大,物质的沸点越高。
ii.NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O,38~60℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl
①过程III采用“减压蒸发”操作的原因是
②补充完整过程Ⅲ的操作:
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐2】北京时间10月7日,2020年诺贝尔化学奖揭晓。法国科学家Emmanuelle Charpentier和美国科学家JenniferA.Doudna获奖,以表彰她们“开发出一种基因组编辑方法”。利用CRISPR/Cas9“基因剪刀”,现在可以在几周的时间内改变生命密码。研究表明,该“基因剪刀”中的Cas9蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸(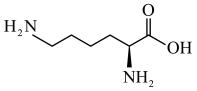 )。工业上制备赖氨酸有很多方法:
)。工业上制备赖氨酸有很多方法:
(1)由葡萄糖在一定的条件下进行耗氧发酵,生成赖氨酸的化学方程式为 。该反应的理论产率是
。该反应的理论产率是___________ (精确到0.1%,已知理论产率=目标产物的质量/反应物的质量,产物和反应物均只指有机物)。
(2)由尼龙-6生产过程中的废料(A)经过下列途径也可制备赖氨酸(E)。
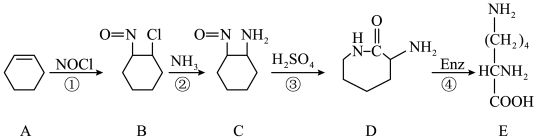
①物质A的名称是___________ ,赖氨酸中官能团的名称是___________ 。
②反应①的类型是___________ 。
③反应②的化学方程式为___________ 。
④C、D两种物质的关系是___________ 。
⑤E的同分异构体很多,同时满足下列条件的E的同分异构体有___________ 种(不含立体异构)。
A.能发生银镜反应和水解反应 B.分子中含两个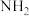 但不含
但不含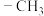
其中一氯取代物有三种的结构简式是___________ 。
(3)工业上也可用己内酰胺为原料,通过下述途径生产赖氨酸。

请补充完整该合成路线___________ 。
 )。工业上制备赖氨酸有很多方法:
)。工业上制备赖氨酸有很多方法:(1)由葡萄糖在一定的条件下进行耗氧发酵,生成赖氨酸的化学方程式为
 。该反应的理论产率是
。该反应的理论产率是(2)由尼龙-6生产过程中的废料(A)经过下列途径也可制备赖氨酸(E)。

①物质A的名称是
②反应①的类型是
③反应②的化学方程式为
④C、D两种物质的关系是
⑤E的同分异构体很多,同时满足下列条件的E的同分异构体有
A.能发生银镜反应和水解反应 B.分子中含两个
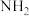 但不含
但不含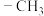
其中一氯取代物有三种的结构简式是
(3)工业上也可用己内酰胺为原料,通过下述途径生产赖氨酸。

请补充完整该合成路线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成
在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成 的方法是先制备
的方法是先制备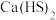 ,再与
,再与 (氰氨基化钙)反应得到
(氰氨基化钙)反应得到 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。 易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体
易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体 。
。
实验步骤如下:
①实验前先检查装置气密性,然后加入药品,关闭 ,打开
,打开 ,通入
,通入 一段时间。
一段时间。
②关闭 ,打开
,打开 ,至反应结束后关闭
,至反应结束后关闭 ,打开
,打开 ,再通入
,再通入 一段时间。
一段时间。
③撤走搅拌器,打开 ,水浴加热
,水浴加热 中三颈烧瓶,在80℃时合成硫脲。
中三颈烧瓶,在80℃时合成硫脲。
④将 中三颈烧瓶内的混合物过滤后,结晶得到粗产品。
中三颈烧瓶内的混合物过滤后,结晶得到粗产品。
回答下列问题:
(1)写出硫脲 的结构式:
的结构式:_______ 。
(2)工业上制备硫脲时,常利用足量碳将 高温下还原为
高温下还原为 ,然后再利用
,然后再利用 进一步合成硫脲,试写出足量碳与
进一步合成硫脲,试写出足量碳与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)B中最合适的试剂可选择_______ (填序号)。
①饱和 溶液 ②饱和
溶液 ②饱和 溶液 ③饱和
溶液 ③饱和 溶液 ④
溶液 ④ 溶液
溶液
(4)步骤①中通入 的目的是
的目的是_______ 。
(5)请配平合成硫脲的反应方程式:_______ 。
_______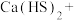 _______
_______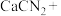 _______
_______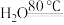 _______
_______ _______
_______
(6)步骤③中控制温度在80℃,不宜过高的原因是_______ 。
(7)产品纯度的测定:称取 粗产品,配制成
粗产品,配制成 溶液,量取
溶液,量取 该溶液,用
该溶液,用 的酸性
的酸性 溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性
溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性 溶液的体积为
溶液的体积为 。该产品的纯度为
。该产品的纯度为_______  (化为最简式)。已知:
(化为最简式)。已知: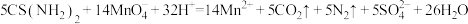 。
。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成
在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成 的方法是先制备
的方法是先制备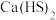 ,再与
,再与 (氰氨基化钙)反应得到
(氰氨基化钙)反应得到 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。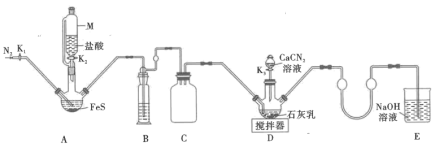
 易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体
易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体 。
。实验步骤如下:
①实验前先检查装置气密性,然后加入药品,关闭
 ,打开
,打开 ,通入
,通入 一段时间。
一段时间。②关闭
 ,打开
,打开 ,至反应结束后关闭
,至反应结束后关闭 ,打开
,打开 ,再通入
,再通入 一段时间。
一段时间。③撤走搅拌器,打开
 ,水浴加热
,水浴加热 中三颈烧瓶,在80℃时合成硫脲。
中三颈烧瓶,在80℃时合成硫脲。④将
 中三颈烧瓶内的混合物过滤后,结晶得到粗产品。
中三颈烧瓶内的混合物过滤后,结晶得到粗产品。回答下列问题:
(1)写出硫脲
 的结构式:
的结构式:(2)工业上制备硫脲时,常利用足量碳将
 高温下还原为
高温下还原为 ,然后再利用
,然后再利用 进一步合成硫脲,试写出足量碳与
进一步合成硫脲,试写出足量碳与 发生反应的化学方程式为
发生反应的化学方程式为(3)B中最合适的试剂可选择
①饱和
 溶液 ②饱和
溶液 ②饱和 溶液 ③饱和
溶液 ③饱和 溶液 ④
溶液 ④ 溶液
溶液(4)步骤①中通入
 的目的是
的目的是(5)请配平合成硫脲的反应方程式:
_______
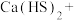 _______
_______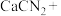 _______
_______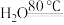 _______
_______ _______
_______
(6)步骤③中控制温度在80℃,不宜过高的原因是
(7)产品纯度的测定:称取
 粗产品,配制成
粗产品,配制成 溶液,量取
溶液,量取 该溶液,用
该溶液,用 的酸性
的酸性 溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性
溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性 溶液的体积为
溶液的体积为 。该产品的纯度为
。该产品的纯度为 (化为最简式)。已知:
(化为最简式)。已知: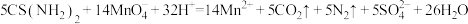 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:

(1)实验室制备氨气的化学方程式为_______ 。
(2)用装置 收集氨气时,氨气的进气口是
收集氨气时,氨气的进气口是______ (填“ ”或“
”或“ ”),理由是
”),理由是__________ 。
(3)打开装置 中的止水夹
中的止水夹 ,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是
,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________ 、______________ 。

(1)实验室制备氨气的化学方程式为
(2)用装置
 收集氨气时,氨气的进气口是
收集氨气时,氨气的进气口是 ”或“
”或“ ”),理由是
”),理由是(3)打开装置
 中的止水夹
中的止水夹 ,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是
,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学兴趣小组拟采用如下图所示装置(部分夹持装置略去)制取氨基钾(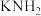 )。已知氨基钾很容易与空气中的水和二氧化碳反应。
)。已知氨基钾很容易与空气中的水和二氧化碳反应。

回答下列问题:
(1) 装置装药品前应检验气密性,操作是
装置装药品前应检验气密性,操作是___________ 。浓氨水与生石灰混合能迅速产生氨气,主要利用生石灰吸水且遇水放热升温减小氨气溶解度,以及___________ (从平衡角度回答)。
(2)整套装置的连接顺序为
___________ (装置不重复使用)。
(3)实验开始时应先打开分液漏斗的活塞,再点燃酒精灯,目的是___________ 。药品 为
为___________ (填字母标号)。
A. 无水氯化钙 B. 碱石灰 C. 五氧化二磷 D. 硅胶
(4) 中硬质玻璃管内发生反应的化学方程式为
中硬质玻璃管内发生反应的化学方程式为___________ 。
(5) 装置的作用是
装置的作用是___________ 。
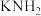 )。已知氨基钾很容易与空气中的水和二氧化碳反应。
)。已知氨基钾很容易与空气中的水和二氧化碳反应。
回答下列问题:
(1)
 装置装药品前应检验气密性,操作是
装置装药品前应检验气密性,操作是(2)整套装置的连接顺序为

(3)实验开始时应先打开分液漏斗的活塞,再点燃酒精灯,目的是
 为
为A. 无水氯化钙 B. 碱石灰 C. 五氧化二磷 D. 硅胶
(4)
 中硬质玻璃管内发生反应的化学方程式为
中硬质玻璃管内发生反应的化学方程式为(5)
 装置的作用是
装置的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】磺酰胺[SO2(NH2)2]易溶于醇,溶于热水,不溶于冷水,在酸性、中性、碱性水溶液中性质稳定,主要用于制造医药、农药、染料等。制备磺酰胺的装置如下,其原理为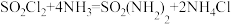 。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
Ⅰ.磺酰胺的制备____________ 。
(2)装置B中盛放的试剂为____________ (填字母)。
a.碱石灰 b.浓硫酸 c.P2O5 d.无水CaCl2
(3)写出 SO2Cl2水解的化学方程式:____________ 。
(4)装置C中多孔球泡的作用是____________ 。
Ⅱ.用如下装置测定产品SO2(NH2)2的含量(假设只含NH4Cl杂质,部分装置已省略)____________ ,单向阀的作用是____________ 。
(6)滴定:将液封装置2中的水放入锥形瓶中,再将锥形瓶中的溶液倒入容量瓶中配制成500 mL的溶液,取20 mL溶液用c2 mol/L的NaOH标准溶液滴定过量的H2SO4,共消耗NaOH标准溶液V2 mL,产品中SO2(NH2)2的含量是____________ (列出计算式)。
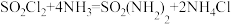 。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。Ⅰ.磺酰胺的制备

(2)装置B中盛放的试剂为
a.碱石灰 b.浓硫酸 c.P2O5 d.无水CaCl2
(3)写出 SO2Cl2水解的化学方程式:
(4)装置C中多孔球泡的作用是
Ⅱ.用如下装置测定产品SO2(NH2)2的含量(假设只含NH4Cl杂质,部分装置已省略)
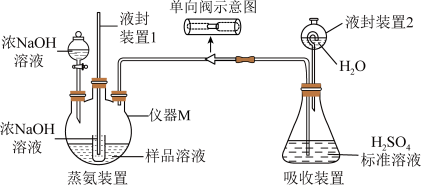
(6)滴定:将液封装置2中的水放入锥形瓶中,再将锥形瓶中的溶液倒入容量瓶中配制成500 mL的溶液,取20 mL溶液用c2 mol/L的NaOH标准溶液滴定过量的H2SO4,共消耗NaOH标准溶液V2 mL,产品中SO2(NH2)2的含量是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。

(1)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①A的电子式为___________ ,B的化学式为___________ 。
②实验室制取B时,收集方法是___________ 。
③C与水反应的化学方程式为___________ 。
(2)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
①由B生成C时,每生成1molC,消耗W的物质的量为___________ 。
②C溶于水形成化合物D,在加热的情况下,D的浓溶液与Cu反应的化学方程式为___________ 。
(3)A为一元强碱溶液,W是形成酸雨的主要气体。
①则B到C的离子方程式为___________ 。
②请画出向含0.01molB和0.01molC的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像。______


(1)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①A的电子式为
②实验室制取B时,收集方法是
③C与水反应的化学方程式为
(2)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
①由B生成C时,每生成1molC,消耗W的物质的量为
②C溶于水形成化合物D,在加热的情况下,D的浓溶液与Cu反应的化学方程式为
(3)A为一元强碱溶液,W是形成酸雨的主要气体。
①则B到C的离子方程式为
②请画出向含0.01molB和0.01molC的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像。

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
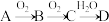
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___________ ,检验D的稀溶液中主要阴离子的试剂是___________ 。
②在工业生产中,B气体的大量排放被雨水吸收后会形成___________ 而污染环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为___________ 、___________ 。
②写出 转化的化学方程式
转化的化学方程式___________ 。
③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________ ,该反应中D体现的性质有___________ 。
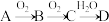
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中,B气体的大量排放被雨水吸收后会形成
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为
②写出
 转化的化学方程式
转化的化学方程式③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色气体。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。

请回答下列问题:
(1)B的电子式为_______ ,Y的化学式为_______ ,E的名称为_______ 。
(2)Y与氧化铜反应,每生成1mol B消耗3mol氧化铜,该反应的化学方程式为:_______ 。
(3)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?(填“有”或“没有”)_______ ,理由是_______ 。

(4)G的浓溶液通常略显黄色,请用化学方程式解释原因_______ 。

请回答下列问题:
(1)B的电子式为
(2)Y与氧化铜反应,每生成1mol B消耗3mol氧化铜,该反应的化学方程式为:
(3)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?(填“有”或“没有”)

(4)G的浓溶液通常略显黄色,请用化学方程式解释原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
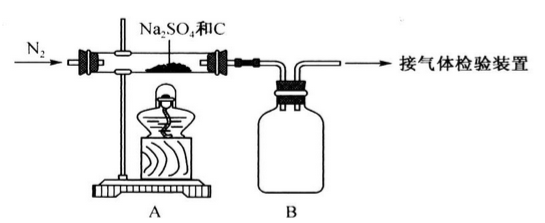
【推荐1】某校合作学习小组的同学设计实验验证Na2SO4与焦炭高温加热后的产物。回答下列问题。
(1)Na2SO4与焦炭反应的实验装置如下图所示:
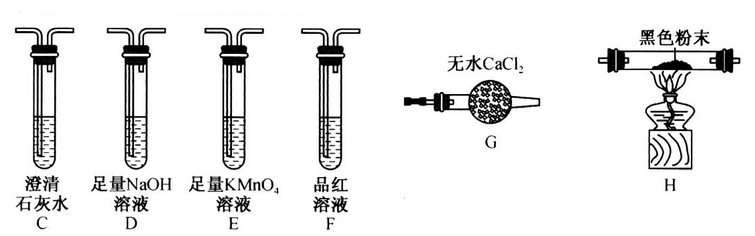
(2)该同学认为气体产物中可能含有CO2、CO 及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
(3)某同学利用下图装置验证固态产物,能证明固态产物中含有Na2S的现象是___________ 。若实验中发现固态产物完全反应后,锥形瓶底部还产生少量黄色沉淀,说明固体产物中除含有Na2S外,还含有少量的___________ (填一种可能的物质)。
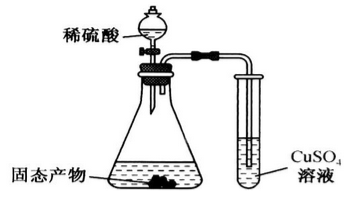
(1)Na2SO4与焦炭反应的实验装置如下图所示:

①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是
②装置B的作用是
(2)该同学认为气体产物中可能含有CO2、CO 及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①实验装置连接的合理顺序为A、B、
②能证明产物中有CO的现象是
③若含有SO2,E装置的作用是
(3)某同学利用下图装置验证固态产物,能证明固态产物中含有Na2S的现象是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】三氯化磷(PCl3)是一种基础化工原料使用广泛需求量大。实验室可用白磷与氯气反应制备三氯化磷,实验装置如图所示(夹持装置未画出)。

已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
回答下列问题:
(1)仪器X的名称是___ ;装置A中发生反应的离子方程式为___ 。
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是__ 。
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量__ (填“干沙”或“ 水”)。
水”)。
(4)装置E的烧杯中冰盐水的作用是___ 。
(5)装置F的作用:一是防止空气中水蒸气的进入;二是___ 。
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是___ 。

已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
| 熔点 | 沸点 | |
| PCl3 | -112℃ | 76℃ |
| PCl5 | 146℃ | 200℃分解 |
回答下列问题:
(1)仪器X的名称是
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量
 水”)。
水”)。(4)装置E的烧杯中冰盐水的作用是
(5)装置F的作用:一是防止空气中水蒸气的进入;二是
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】某课外活动小组欲利用CuO与氨反应,研究氨的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
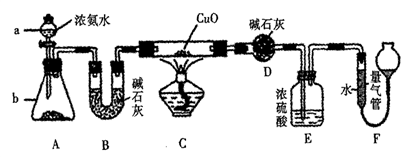
(1)仪器a的名称为_________ 。
(2)实验室中,利用装置A,还可制取的无色气体是_________ (填字母)。
A.Cl2 B.04 C.C02 D.N02
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有________ 性,写出相应的化学方程式 __________ 。
(4)D装置的作用是__________ 。
(5)E装置中浓硫酸的作用是__________ 。
(6)读取气体体积前,应对装置F进行的操作是__________ 。

(1)仪器a的名称为
(2)实验室中,利用装置A,还可制取的无色气体是
A.Cl2 B.04 C.C02 D.N02
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有
(4)D装置的作用是
(5)E装置中浓硫酸的作用是
(6)读取气体体积前,应对装置F进行的操作是
您最近一年使用:0次



