氧化锌在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中应用广泛。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
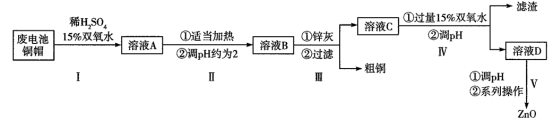
已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、Zn(OH)2均为两性化合物。
(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有___________ (填名称)。
(2)写出第I步中Cu参加反应的离子方程式:___________ 。
(3)假设溶液C中c(Fe2+)=0.01 mol·L-1、c(Zn2+)=1 mol·L-1,常温下,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10-5 mol·L-1时认为沉淀完全):
①上表中的a=___________ (假设第IV步中溶液体积变化忽略不计)。
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因是___________ 。
(4)第V步中“系列操作”指的是过滤、洗涤和煅烧,检验Zn(OH)2沉淀洗涤干净的方法是___________ (写出实验操作、现象和结论)。

已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、Zn(OH)2均为两性化合物。
(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有
(2)写出第I步中Cu参加反应的离子方程式:
(3)假设溶液C中c(Fe2+)=0.01 mol·L-1、c(Zn2+)=1 mol·L-1,常温下,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10-5 mol·L-1时认为沉淀完全):
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 2.3 | 7.3 | 6.2 |
| 沉淀完全的pH | a | 8.8.37 |
①上表中的a=
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因是
(4)第V步中“系列操作”指的是过滤、洗涤和煅烧,检验Zn(OH)2沉淀洗涤干净的方法是
更新时间:2021-09-11 09:49:28
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某小组欲探究反应2Fe2++I2 2Fe3++2I—,完成如下实验:
2Fe3++2I—,完成如下实验:
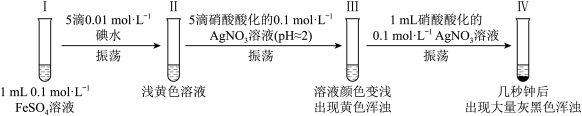
资料:AgI是黄色固体,不溶于稀硝酸;新制的AgI见光会少量分解。
一、经检验,I、II中均无 ,III中含
,III中含 。
。
(1)II中未检出 的实验操作及现象是:取少量Ⅱ中溶液,
的实验操作及现象是:取少量Ⅱ中溶液,___________ 。
(2)III中的黄色浑浊是___________ 。
(3)研究III中 产生的原因
产生的原因
①甲同学对此做出如下假设:
假设a:空气中存在 ,由于
,由于___________ (用离子方程式表示),可产生 ;
;
假设b:酸性溶液中___________ (填化学式)具有氧化性,可产生 ;
;
假设c:溶液中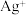 具有氧化性,可产生
具有氧化性,可产生 ;
;
通过实验证实a、b、c不是产生 的主要原因,实验方案和现象是
的主要原因,实验方案和现象是___________ 。
②进一步实验表明,产生 时的氧化剂是
时的氧化剂是 ,从物质性质的角度分析
,从物质性质的角度分析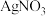 溶液作用是
溶液作用是___________ 。
二、继续研究III→IV过程中出现灰黑色浑浊的原因:
(4)完成如下实验:
实验1:检验出IV中灰黑色浑浊中含有AgI和Ag。验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,___________ 。
实验2:向1mL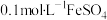 溶液中加入1mL
溶液中加入1mL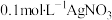 溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中
溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中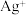 浓度随反应时间的变化如下图。
浓度随反应时间的变化如下图。
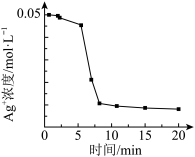
实验3:实验开始时,先向试管中加入几滴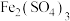 溶液,重复实验2,实验结果与实验2相同。
溶液,重复实验2,实验结果与实验2相同。
①实验2中发生反应的离子方程式是___________ 。
②IV中迅速出现灰黑色浑浊的可能的原因是___________ 。
 2Fe3++2I—,完成如下实验:
2Fe3++2I—,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸;新制的AgI见光会少量分解。
一、经检验,I、II中均无
 ,III中含
,III中含 。
。(1)II中未检出
 的实验操作及现象是:取少量Ⅱ中溶液,
的实验操作及现象是:取少量Ⅱ中溶液,(2)III中的黄色浑浊是
(3)研究III中
 产生的原因
产生的原因①甲同学对此做出如下假设:
假设a:空气中存在
 ,由于
,由于 ;
;假设b:酸性溶液中
 ;
;假设c:溶液中
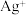 具有氧化性,可产生
具有氧化性,可产生 ;
;通过实验证实a、b、c不是产生
 的主要原因,实验方案和现象是
的主要原因,实验方案和现象是②进一步实验表明,产生
 时的氧化剂是
时的氧化剂是 ,从物质性质的角度分析
,从物质性质的角度分析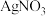 溶液作用是
溶液作用是二、继续研究III→IV过程中出现灰黑色浑浊的原因:
(4)完成如下实验:
实验1:检验出IV中灰黑色浑浊中含有AgI和Ag。验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,
实验2:向1mL
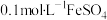 溶液中加入1mL
溶液中加入1mL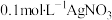 溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中
溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中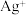 浓度随反应时间的变化如下图。
浓度随反应时间的变化如下图。
实验3:实验开始时,先向试管中加入几滴
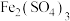 溶液,重复实验2,实验结果与实验2相同。
溶液,重复实验2,实验结果与实验2相同。①实验2中发生反应的离子方程式是
②IV中迅速出现灰黑色浑浊的可能的原因是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】中学化学中几种常见物质的转化关系如下:
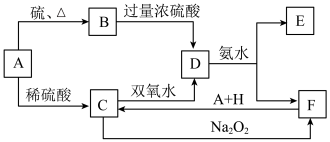
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________________________________ 。
(2)写出B的化学式:B________ 。
(3)①H2O2分子的电子式:__________________________________ 。
②写出C的酸性溶液与双氧水反应的离子方程式:_________________________ 。
(4)写出鉴定E中阳离子的实验方法和现象:____________________________ 。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:______________________________________________________ 。

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:
(2)写出B的化学式:B
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式:
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:
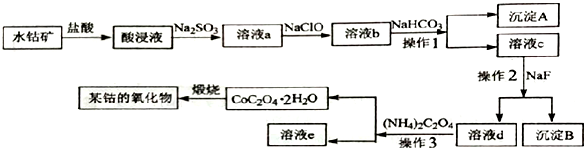
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________ (任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________ 。
(3)溶液a中加入NaClO的作用为_______________________________ 。
(4)沉淀A 的成分为__________________ 。操作2的名称是___________________ 。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时溶液中c(Ca2+)最大等于_________ mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________ 。

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式
(3)溶液a中加入NaClO的作用为
(4)沉淀A 的成分为
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时溶液中c(Ca2+)最大等于
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
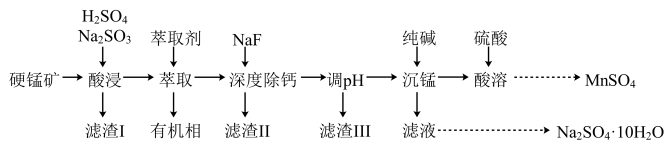
【推荐1】硫酸锰广泛用于基肥、拌种、食品加工和无机化工生产。以硬锰矿(组成为 ,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
已知: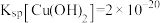 、
、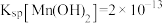 、-
、- 。
。
(1)Mn2+的价电子排布式为___________ ,“酸浸”时MnO2溶解反应的化学方程式为___________ 。
(2)“萃取”时发生的反应: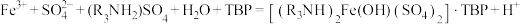 ,Fe3+的萃取率与溶液pH的关系如图所示。当pH=
,Fe3+的萃取率与溶液pH的关系如图所示。当pH= 时Fe3+萃取率最大的原因为
时Fe3+萃取率最大的原因为___________ 。

(3)若省去“深度除钙”工序,会导致的后果为___________ 。
(4)若要使“调pH”后所得滤液中
 、
、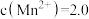
 ,则“调pH”的合理范围为
,则“调pH”的合理范围为___________ 。
(5)“沉锰”所得滤液经处理后得到Na2SO4溶液,由该溶液制备芒硝( )的操作为
)的操作为___________ (硫酸钠的溶解度随温度的变化如图所示)。

(6)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为 ,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320
,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320 KMnO4溶液滴定(
KMnO4溶液滴定( 被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数
被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数___________ 。(写计算过程,保留两位有效数字)
 ,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
已知:
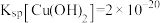 、
、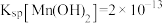 、-
、- 。
。(1)Mn2+的价电子排布式为
(2)“萃取”时发生的反应:
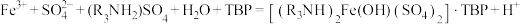 ,Fe3+的萃取率与溶液pH的关系如图所示。当pH=
,Fe3+的萃取率与溶液pH的关系如图所示。当pH= 时Fe3+萃取率最大的原因为
时Fe3+萃取率最大的原因为
(3)若省去“深度除钙”工序,会导致的后果为
(4)若要使“调pH”后所得滤液中

 、
、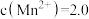
 ,则“调pH”的合理范围为
,则“调pH”的合理范围为(5)“沉锰”所得滤液经处理后得到Na2SO4溶液,由该溶液制备芒硝(
 )的操作为
)的操作为
(6)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为
 ,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320
,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320 KMnO4溶液滴定(
KMnO4溶液滴定( 被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数
被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。

(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________ 。
(2)滤渣的主要成分是________________ (写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____ mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________ 。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________ 。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________ 。
②粗产品中钒的质量分数表达式为________ (以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____ (填“偏高”、“偏低”或“无影响”)。

(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为
(2)滤渣的主要成分是
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是
②粗产品中钒的质量分数表达式为
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________ (用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________ (用离子方程式表示)。
Ⅱ、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________ ;②____________________________ ;③____________________________ 。
(2)溶液中共有__________ 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________ ,浓度为0.002mol·L-1的是____________ 。
(4)__________ 和__________ 两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO 的电离程度
的电离程度_________ (填“大于”、“小于”或“等于”)HSO 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________ 。
Ⅲ、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:

(1)绿矾为FeSO4·7H2O,反应(Ⅰ)中FeSO4与Cr2O72﹣ 的物质的量之比为_________ .
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______ .(Ksp[Cr(OH)3]=6.0×10﹣31)
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是
Ⅱ、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①
(2)溶液中共有
(3)在这些粒子中,浓度为0.01mol·L-1的是
(4)
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO
 的电离程度
的电离程度 的水解程度。
的水解程度。②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为
Ⅲ、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:

(1)绿矾为FeSO4·7H2O,反应(Ⅰ)中FeSO4与Cr2O72﹣ 的物质的量之比为
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色。
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用。
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因__________ 。
(2)写出检验步骤②中沉淀是否洗涤干净的操作__________________ 。
(二)为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表:

(3)写出氯酸钾分解反应的化学方程式,并用双线桥表示电子转移的方向和数目________ 。
(4)上述实验中的“待测数据”是指___________________ 。
(5)图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装面成,此处用滴定管是________ (填“酸式”或“碱式”)滴定管。
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积[V(O2)]随时间(t)变化的曲线(注明必要的标识)________ 。
(一)制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色。
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用。
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因
(2)写出检验步骤②中沉淀是否洗涤干净的操作
(二)为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表:

| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ③ | 1.2g | 无其他物质 | a |
| ④ | 1.2g | CuO 0.5g | b |
| ⑤ | 1.2g | MnO20.5g | c |
(4)上述实验中的“待测数据”是指
(5)图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装面成,此处用滴定管是
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积[V(O2)]随时间(t)变化的曲线(注明必要的标识)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】回收锑冶炼厂的砷碱渣中砷的过程可表示为:

已知:①砷碱渣主要含Na3AsO4、Na[Sb(OH)6]、SiO2即少量砷的硫化物;
②25 ℃ Ka1(H3AsO4)=6×10-3、Ka[HSb(OH)6]=2.8×10-3、Ksp[Ca(OH)2]=a、Ksp[Ca5(AsO4)3(OH)]=b。
(1)“水浸”后所得溶液呈碱性,其原因可能是_______ 。
(2)“沉砷”过程发生反应: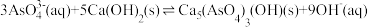 ,该反应的平衡常数K可以表示为
,该反应的平衡常数K可以表示为_______ (用含a、b的表达式作答)。
(3)在常温下,调节“过滤1”所得滤液的pH,沉砷率与滤液初始pH的关系如图所示。pH<12时,沉砷率随pH增大而增大的原因可能是_______ 。
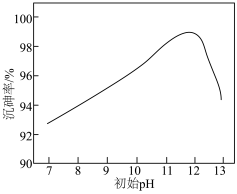
(4)已知:硫代锑酸钠(Na3SbS4)易溶于水,在碱性溶液中较稳定。
①“过滤2”所得滤液中加入Na2S可以将Na[Sb(OH)6]转化为Na3SbS4,该反应的离子方程式为_______ 。
② Na2S须过量,原因是_______ 。
(5)“还原”步骤中,Ca5(AsO4)3(OH)先分解为Ca3(AsO4)2, Ca3(AsO4)2与C反应生成CO和砷蒸气,其物质的量之比为10:1。蒸气中砷分子为正四面体结构,其化学式为_______ 。
(6)砷的硫化物在自然界中主要为As4S6、As4S4等。已知As4S6中所有原子均为8电子稳定结构,且不存在四元环结构,不含As-As键和S-S键。其结构式可表示为_______ 。

已知:①砷碱渣主要含Na3AsO4、Na[Sb(OH)6]、SiO2即少量砷的硫化物;
②25 ℃ Ka1(H3AsO4)=6×10-3、Ka[HSb(OH)6]=2.8×10-3、Ksp[Ca(OH)2]=a、Ksp[Ca5(AsO4)3(OH)]=b。
(1)“水浸”后所得溶液呈碱性,其原因可能是
(2)“沉砷”过程发生反应:
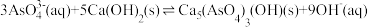 ,该反应的平衡常数K可以表示为
,该反应的平衡常数K可以表示为(3)在常温下,调节“过滤1”所得滤液的pH,沉砷率与滤液初始pH的关系如图所示。pH<12时,沉砷率随pH增大而增大的原因可能是

(4)已知:硫代锑酸钠(Na3SbS4)易溶于水,在碱性溶液中较稳定。
①“过滤2”所得滤液中加入Na2S可以将Na[Sb(OH)6]转化为Na3SbS4,该反应的离子方程式为
② Na2S须过量,原因是
(5)“还原”步骤中,Ca5(AsO4)3(OH)先分解为Ca3(AsO4)2, Ca3(AsO4)2与C反应生成CO和砷蒸气,其物质的量之比为10:1。蒸气中砷分子为正四面体结构,其化学式为
(6)砷的硫化物在自然界中主要为As4S6、As4S4等。已知As4S6中所有原子均为8电子稳定结构,且不存在四元环结构,不含As-As键和S-S键。其结构式可表示为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
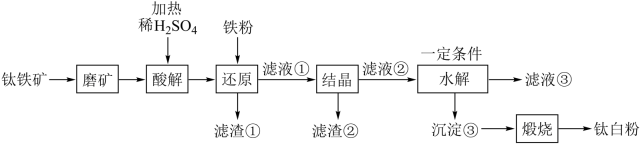
【推荐3】钛白粉学名二氧化钛(TiO2)是性能最佳、应用最广、用量最大的白色颜料。钛铁矿(FeTiO3)中往往含有Fe2O3、MgO、CaO、Al2O3、SiO2等杂质。一种硫酸法钛白粉生产工艺如图:
已知:
①酸解后,钛主要以 形式存在。强电解质
形式存在。强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
②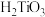 不溶于水和稀酸。
不溶于水和稀酸。
(1)磨矿的目的是___________ 。
(2)滤渣①的主要成分是___________ 。
(3)酸解过程中,写出 发生反应的化学方程式
发生反应的化学方程式___________ 。
(4)还原过程中,加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做如下尝试:
。为探究最佳反应条件,某实验室做如下尝试:
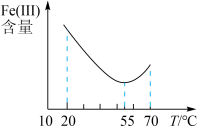
①在其它条件不变的情况下。体系中Fe(Ⅲ)含量随pH变化如图,试分析在pH介于4~6之间时,Fe(III)含量基本保持不变的原因:___________ 。
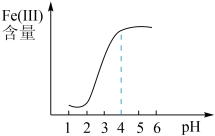
②保持其它条件不变的情况下,体系中Fe(III)含量随温度变化如图,55℃后,Fe(III)含量增大的原因是因为温度升高, 易被体系中的
易被体系中的 氧化,写出反应的离子方程式
氧化,写出反应的离子方程式___________ 。
(5)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为___________ 。
②一定量 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理___________ 。

已知:
①酸解后,钛主要以
 形式存在。强电解质
形式存在。强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。②
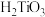 不溶于水和稀酸。
不溶于水和稀酸。(1)磨矿的目的是
(2)滤渣①的主要成分是
(3)酸解过程中,写出
 发生反应的化学方程式
发生反应的化学方程式(4)还原过程中,加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做如下尝试:
。为探究最佳反应条件,某实验室做如下尝试:①在其它条件不变的情况下。体系中Fe(Ⅲ)含量随pH变化如图,试分析在pH介于4~6之间时,Fe(III)含量基本保持不变的原因:

②保持其它条件不变的情况下,体系中Fe(III)含量随温度变化如图,55℃后,Fe(III)含量增大的原因是因为温度升高,
 易被体系中的
易被体系中的 氧化,写出反应的离子方程式
氧化,写出反应的离子方程式
(5)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为
②一定量
 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
您最近一年使用:0次



