以冶炼铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
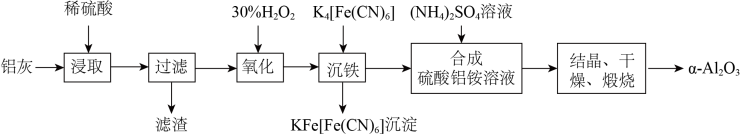
(1)写出铝灰与硫酸反应涉及的所有离子方程式___________ 、___________ 、___________ 。
(2)图中“滤渣”的主要成分为___________ (填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为___________ 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是___________ (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有___________ (填化学式)。
③KMnO4溶液褪色(MnO 被还原为Mn2+),发生的离子反应方程式为
被还原为Mn2+),发生的离子反应方程式为___________ 。

(1)写出铝灰与硫酸反应涉及的所有离子方程式
(2)图中“滤渣”的主要成分为
(3)加30%H2O2溶液发生的离子反应方程式为
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]
 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
①集气瓶中收集到的气体是
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有
③KMnO4溶液褪色(MnO
 被还原为Mn2+),发生的离子反应方程式为
被还原为Mn2+),发生的离子反应方程式为
2014·江苏南京·一模 查看更多[17]
湖南省宁乡市第一高级中学2023届高三第七次月考化学试题湖南省衡阳八中2022-2023学年高三第四次月考化学试题青海省西宁市2021-2022学年高三上学期期末统考化学试题西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)陕西省榆林市第十二中学2021届高三上学期第二次月考化学试题贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题安徽省滁州市定远县重点中学2019-2020学年高二下学期期中考试化学试题四川省成都石室中学2019-2020学年高二入学考试化学试题【全国百强校】广西自治区桂林市第十八中学2018-2019学年高二下学期开学考试化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (题型专练)河北省衡水市安平中学2018届高三上学期期中考试化学试题2017届湖南省长沙市长郡中学高三模拟一化学试卷2015-2016学年福建省龙海二中高二下学期期末化学试卷(已下线)2014届江苏省南京市、盐城市高三第一次模拟考试化学试卷2017届湖南省长沙市长郡中学高三第一次模拟考试理综化学试卷
更新时间:2021-09-26 16:59:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
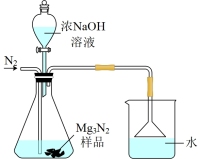
【推荐1】Mg3N2是一种新型无机材料,在工业上应用非常广泛,可用于制备特殊的陶瓷材料或用于制造特种玻璃。实验室可以利用氮气和镁在高温下直接化合来制备Mg3N2。已知:室温下,纯净的氮化镁为黄绿色的粉末,遇水发生水解反应,需密封保存。现提供如图装置利用纯净的氮气和镁反应制取Mg3N2。

(1)Mg3N2是一种离子化合物,写出该化合物的电子式:____ ,Mg3N2能溶于酸,写出其与盐酸溶液反应的化学方程式:____ 。
(2)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为:____ 。
(3)请从图中选择合适的装置,按顺序组装一套装置利用纯净的氮气和镁反应制取Mg3N2(装置可以根据需要重复使用):____ (填字母)。装置B中盛放的液体是___ ,装置B的作用是____ 。
(4)实验结束后,取装置D的硬质玻璃管中的少量固体于试管中,加适量蒸馏水充分振荡,再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是____ 。
(5)Mg3N2制备过程中存在一些副反应导致产品不纯。某同学取2.250g Mg3N2样品与浓NaOH溶液充分反应,将产生的氨气用水吸收来测定Mg3N2的纯度(假设杂质与碱不反应,忽略NH3在强碱溶液中的溶解)。当反应完全后持续通入氮气将生成的氨气全部吹入烧杯中被水吸收,将烧杯中的溶液转移到250mL的容量瓶中,加水定容配制成250mL溶液,用____ 量取25.00mL氨水于锥形瓶中并加入几滴____ 作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸的体积为36.00mL,经计算得Mg3N2的纯度为____ 。(保留到小数点后2位)

(1)Mg3N2是一种离子化合物,写出该化合物的电子式:
(2)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为:
(3)请从图中选择合适的装置,按顺序组装一套装置利用纯净的氮气和镁反应制取Mg3N2(装置可以根据需要重复使用):
(4)实验结束后,取装置D的硬质玻璃管中的少量固体于试管中,加适量蒸馏水充分振荡,再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是
(5)Mg3N2制备过程中存在一些副反应导致产品不纯。某同学取2.250g Mg3N2样品与浓NaOH溶液充分反应,将产生的氨气用水吸收来测定Mg3N2的纯度(假设杂质与碱不反应,忽略NH3在强碱溶液中的溶解)。当反应完全后持续通入氮气将生成的氨气全部吹入烧杯中被水吸收,将烧杯中的溶液转移到250mL的容量瓶中,加水定容配制成250mL溶液,用

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
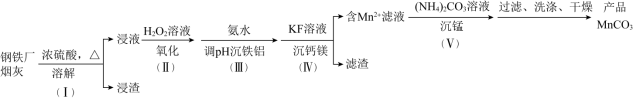
【推荐2】一种利用钢铁厂烟灰 含Fe、Mn、
含Fe、Mn、 ,少量的
,少量的 、CaO及
、CaO及 制备
制备 的工艺流程如下:
的工艺流程如下:
已知 时,下列难溶物的溶度积常数:
时,下列难溶物的溶度积常数:
回答下列问题:
 步骤
步骤 Ⅰ
Ⅰ 浸渣的主要成分是
浸渣的主要成分是________  填化学式
填化学式 。
。
 步骤
步骤 Ⅱ
Ⅱ 加
加 溶液时反应的离子方程式为
溶液时反应的离子方程式为________ ;加氨水调节pH沉铁铝时,步骤 Ⅲ
Ⅲ 应调节的pH适宜范围为
应调节的pH适宜范围为________ 。 部分金属离子开始沉淀与沉淀完全的pH范围如下
部分金属离子开始沉淀与沉淀完全的pH范围如下
 步骤
步骤 Ⅳ
Ⅳ 用KF溶液沉钙镁时,要使
用KF溶液沉钙镁时,要使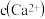 、
、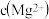 均小于
均小于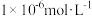 ,则应控制反应液中
,则应控制反应液中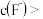
________  ;反应
;反应 的平衡常数
的平衡常数
________ 。
 步骤Ⅴ沉锰时,在
步骤Ⅴ沉锰时,在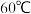 按投料比
按投料比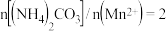 ,溶液的pH对
,溶液的pH对 产率的影响如图
产率的影响如图 所示;
所示; ,按投料比
,按投料比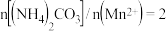 ,反应温度对
,反应温度对 产率的影响如图
产率的影响如图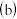 所示。
所示。
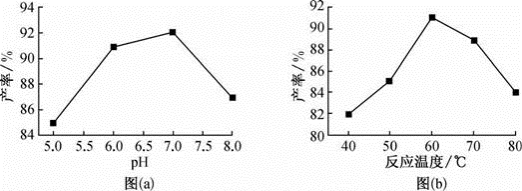
 图
图 中,在
中,在 时,pH越小产率
时,pH越小产率________  填“越高”或“越低”
填“越高”或“越低” ;在
;在 时,pH越大产率越低且纯度也降低,其原因是
时,pH越大产率越低且纯度也降低,其原因是________ 。
 图
图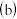 中,温度高于
中,温度高于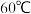 时,温度越高产率越低且纯度也越低,主要原因是
时,温度越高产率越低且纯度也越低,主要原因是________ 。
 含Fe、Mn、
含Fe、Mn、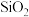 ,少量的
,少量的 、CaO及
、CaO及 制备
制备 的工艺流程如下:
的工艺流程如下:
已知
 时,下列难溶物的溶度积常数:
时,下列难溶物的溶度积常数:| 难溶物 | 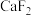 | 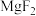 |  |  |
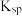 | 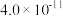 |  | 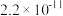 | 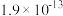 |
回答下列问题:
 步骤
步骤 Ⅰ
Ⅰ 浸渣的主要成分是
浸渣的主要成分是 填化学式
填化学式 。
。 步骤
步骤 Ⅱ
Ⅱ 加
加 溶液时反应的离子方程式为
溶液时反应的离子方程式为 Ⅲ
Ⅲ 应调节的pH适宜范围为
应调节的pH适宜范围为 部分金属离子开始沉淀与沉淀完全的pH范围如下
部分金属离子开始沉淀与沉淀完全的pH范围如下
| 金属离子 |  |  | 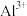 | 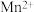 | 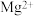 |
| 沉淀pH范围 |  |  | 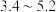 |  |  |
 步骤
步骤 Ⅳ
Ⅳ 用KF溶液沉钙镁时,要使
用KF溶液沉钙镁时,要使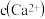 、
、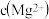 均小于
均小于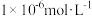 ,则应控制反应液中
,则应控制反应液中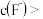
 ;反应
;反应 的平衡常数
的平衡常数
 步骤Ⅴ沉锰时,在
步骤Ⅴ沉锰时,在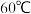 按投料比
按投料比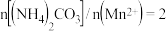 ,溶液的pH对
,溶液的pH对 产率的影响如图
产率的影响如图 所示;
所示; ,按投料比
,按投料比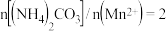 ,反应温度对
,反应温度对 产率的影响如图
产率的影响如图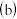 所示。
所示。
 图
图 中,在
中,在 时,pH越小产率
时,pH越小产率 填“越高”或“越低”
填“越高”或“越低” ;在
;在 时,pH越大产率越低且纯度也降低,其原因是
时,pH越大产率越低且纯度也降低,其原因是 图
图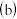 中,温度高于
中,温度高于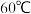 时,温度越高产率越低且纯度也越低,主要原因是
时,温度越高产率越低且纯度也越低,主要原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如图:

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl 形式存在,写出相应反应的离子方程式
形式存在,写出相应反应的离子方程式__ 。
(2)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
分析40℃时TiO2·xH2O转化率最高的原因__ 。
(3)Li2Ti5O15中Ti的化合价为+4,则1molLi2Ti5O15中含过氧根离子的数目为__ 。
(4)若“滤液②”中c(Mg2+)=0.02mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成___ ?已知:FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式___ 。

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl
 形式存在,写出相应反应的离子方程式
形式存在,写出相应反应的离子方程式(2)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因
(3)Li2Ti5O15中Ti的化合价为+4,则1molLi2Ti5O15中含过氧根离子的数目为
(4)若“滤液②”中c(Mg2+)=0.02mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】过氧化钙( )微溶于水,可作医用防腐剂、消毒剂,以下是制备
)微溶于水,可作医用防腐剂、消毒剂,以下是制备 的一种方法。
的一种方法。
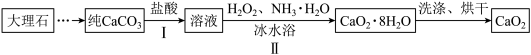
回答下列问题:
(1)步骤Ⅰ中反应的离子方程式是_______ 。
(2)步骤Ⅱ中反应的化学方程式是(有 生成):
生成):_______ 。
(3)反应在冰水浴中进行,是为了防止 分解、
分解、_______ 。(答1条即可)
(4)用乙醇代替蒸馏水洗涤过滤得到的白色结晶的原因是_______ 。
(5) 与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是
与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是_______ 。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是工艺简单、操作简单,产品的缺点是_______ 。
 )微溶于水,可作医用防腐剂、消毒剂,以下是制备
)微溶于水,可作医用防腐剂、消毒剂,以下是制备 的一种方法。
的一种方法。
回答下列问题:
(1)步骤Ⅰ中反应的离子方程式是
(2)步骤Ⅱ中反应的化学方程式是(有
 生成):
生成):(3)反应在冰水浴中进行,是为了防止
 分解、
分解、(4)用乙醇代替蒸馏水洗涤过滤得到的白色结晶的原因是
(5)
 与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是
与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是工艺简单、操作简单,产品的缺点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面:锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)从废料中回收氧化钴(CoO)的工艺流程如下:
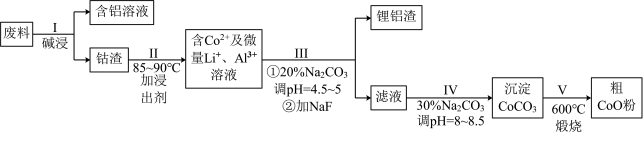
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是____________ 。
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为_________________ 。
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根)_______________________________________ 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________________________________ 。
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式__________________________________ 。
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ ,Co2+是否沉淀完全? __________ (填“是”或“否”)。
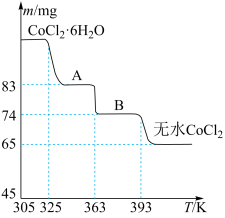
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是____________________ 。

已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根)
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是

您最近一年使用:0次
【推荐3】利用黄铁矿(主要成分为FeS2)与软锰矿(主要成分为MnO2)制备MnSO4·H2O并回收单质硫的部分工艺流程如下:

已知:酸浸液主要含有Mn2+、Fe2+、Fe3+等金属阳离子。
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图所示。
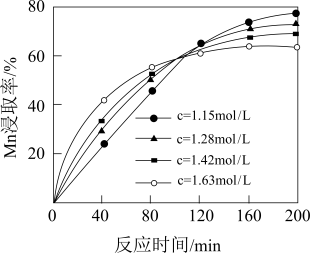
①基态Fe2+的价电子排布式为___________ 。
②酸浸时反应生成Fe3+和S的离子方程式为___________ 。
③100 min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是___________ 。
④酸浸液中还含有Cd2+等重金属阳离子,请结合数据计算说明能否用MnS除去Cd2+?[Ksp(MnS) = 1.2×10-14,Ksp(CdS) = 3.6×10-29]___________ 。
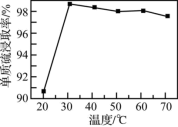
(2)(NH4)2S溶液浸取滤渣时的反应为(n-1) S + S2- =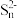 ,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是___________ 。

已知:酸浸液主要含有Mn2+、Fe2+、Fe3+等金属阳离子。
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图所示。

①基态Fe2+的价电子排布式为
②酸浸时反应生成Fe3+和S的离子方程式为
③100 min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是
④酸浸液中还含有Cd2+等重金属阳离子,请结合数据计算说明能否用MnS除去Cd2+?[Ksp(MnS) = 1.2×10-14,Ksp(CdS) = 3.6×10-29]
(2)(NH4)2S溶液浸取滤渣时的反应为(n-1) S + S2- =
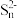 ,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是
您最近一年使用:0次



