下列叙述正确的是
| A.甲烷的燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 |
| B.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH=2×(-57.3)kJ·mol-1 |
| C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0)kJ/mol |
D.2SO2(g)+O2(g) 2SO3(g) ΔH=-196.3kJ·mol-1,则1mol SO2、0.5mol O2充分反应后,放出热量98.3kJ 2SO3(g) ΔH=-196.3kJ·mol-1,则1mol SO2、0.5mol O2充分反应后,放出热量98.3kJ |
21-22高二上·福建龙岩·阶段练习 查看更多[5]
福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)天津市静海区四校2021-2022学年高二上学期11月阶段性检测化学试题黑龙江省哈尔滨市松北区第九中学校2022-2023学年高二上学期12月期中考试化学试题黑龙江省哈尔滨市第九中学校2023-2024学年高二上学期12月考试化学试卷
更新时间:2021-10-07 15:07:53
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol-1②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列说法中错误的是
| A.①式表示25 ℃,101 kpa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ |
| B.2H2(g)+O2(g)===2H2O(g)中ΔH大于-571.6 kJ·mol-1 |
| C.将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ |
| D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列说法正确的是( )
| A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据 |
| B.升高温度或加入催化剂,可以改变化学反应的反应热 |
| C.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| D.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是
| A.相同条件下,等物质的量的硫蒸气和硫粉分别完全燃烧,前者放出热量多 |
B.已知 、 、 条件下: 条件下: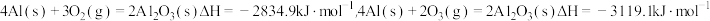 ,则 ,则 比 比 稳定 稳定 |
C.根据热化学方程式: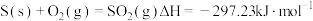 ,可推知 ,可推知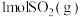 的能量总和大于 的能量总和大于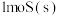 和 和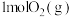 的能量总和 的能量总和 |
D.在稀水溶液中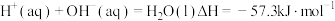 ,将含 ,将含 的浓硫酸与含 的浓硫酸与含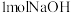 的溶液混合时,放出的热量小于 的溶液混合时,放出的热量小于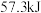 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】下列有关化学反应与热效应的说法正确的是
| A.反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H大于0 |
| B.已知P4(白磷,s)=4P(红磷,s)△H<0,则白磷比红磷稳定 |
| C.H2的燃烧热为285.5kJ/mol,则水电解的热化学方程式为2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol |
| D.已知稀溶液中H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与足量稀醋酸完全中和,放出热量大于57.3kJ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】下列有关热化学方程式的叙述中,正确的是( )
| A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol |
| B.已知2C(s)+2O2(g)===2CO2(g) ΔH1, 2C(s)+O2(g)===2CO(g) ΔH2;则ΔH1<ΔH2 |
| C.已知2H2(g)+O2(g)===2H2O(g) ΔH =-483.6 kJ/mol,则H2的燃烧热为241.8 kJ/mol |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
您最近一年使用:0次
【推荐1】已知:①2Na(s)+O2(g)=Na2O2(s) ΔΗ1=-akJ·mol−1
②C(s,石墨)+O2(g)=CO2(g) ΔΗ2=-bkJ·mol−1
③2Na(s)+C(s,石墨)+ O2(g)=Na2CO3(s) ΔΗ3=-ckJ·mol−1
O2(g)=Na2CO3(s) ΔΗ3=-ckJ·mol−1
④CO2(g)+Na2O2(s)=Na2CO3(s)+ O2(g) ΔΗ4
O2(g) ΔΗ4
下列说法不正确的是
②C(s,石墨)+O2(g)=CO2(g) ΔΗ2=-bkJ·mol−1
③2Na(s)+C(s,石墨)+
 O2(g)=Na2CO3(s) ΔΗ3=-ckJ·mol−1
O2(g)=Na2CO3(s) ΔΗ3=-ckJ·mol−1④CO2(g)+Na2O2(s)=Na2CO3(s)+
 O2(g) ΔΗ4
O2(g) ΔΗ4下列说法不正确的是
| A.石墨的燃烧热ΔΗ=-bkJ·mol−1 |
B.C(s,石墨)+ O2(g)=CO(g) ΔΗ>-bkJ·mol−1 O2(g)=CO(g) ΔΗ>-bkJ·mol−1 |
| C.反应④中,ΔΗ4=(c-a-b)kJ·mol−1 |
| D.若将①设计成原电池,则32gO2在正极反应转移2mol电子 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列热化学方程式叙述正确的是(△H的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1376.0kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=57.3kJ/mol(中和热) |
| C.2S(s)+3O2(g)=2SO3(g) △H =-269KJ/mol(燃烧热) |
| D.2NO2(g)=O2(g) + 2NO(g) △H=+116.2kJ/mol (反应热) |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐3】下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1>ΔH2 |
| D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=+QkJ•mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-QkJ•mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】已知:X(g)+2Y(g) 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是| A.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol |
| B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化 |
| C.达到化学平衡状态时,反应放出的总热量可达a kJ |
| D.升高反应温度,逆反应速率增大,正反应速率减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】在某密闭容器中,一定条件下,对于反应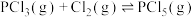 ,下列说法错误的是
,下列说法错误的是
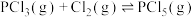 ,下列说法错误的是
,下列说法错误的是| A.该反应为可逆反应 |
| B.升高温度,正反应速率增大 |
C.该反应达到平衡状态时,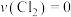 |
| D.加入合适的催化剂,该反应的正逆反应速率均加快 |
您最近一年使用:0次

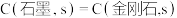
 ,则金刚石比石墨稳定
,则金刚石比石墨稳定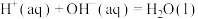
 ,则
,则 和NaOH稀溶液反应生成1mol液态水时放出的热量小于57.3kJ
和NaOH稀溶液反应生成1mol液态水时放出的热量小于57.3kJ
 ,则
,则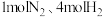 在此条件下充分反应,放出热量为92.4kJ
在此条件下充分反应,放出热量为92.4kJ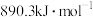 ,则:
,则:



