回答问题
(1)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂条件下,使CCl4转化为重要的化工原料氯仿(CHCl3)。在一个固定容积为2 L的密闭容器中发生反应:CCl4(g)+H2(g) CHCl3(g)+HCl(g),达到平衡后,测得实验数据见表:
CHCl3(g)+HCl(g),达到平衡后,测得实验数据见表:
① 请利用“三段式”计算此反应在110 ℃时的平衡常数___________ 。(要求写出详细过程)
② 实验1中CCl4的转化率为___________ 。
③ 判断该反应的正反应是吸热反应还是放热反应,并说明理由。___________ ,理由为___________ 。
(2)向一个2 L的密闭容器中充入7 mol A气体和5 mol B气体,充分混合后在一定条件下反应:3A(g)+B(g) 2C(s)+xD(g),经5 min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·(L·min)-1 ,求:
2C(s)+xD(g),经5 min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·(L·min)-1 ,求:
①B的转化率___________ ;
②x的值为___________ ;
③平衡时压强与初始时压强之比___________ ;
④此温度下此反应的平衡常数的值为___________ 。
(1)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂条件下,使CCl4转化为重要的化工原料氯仿(CHCl3)。在一个固定容积为2 L的密闭容器中发生反应:CCl4(g)+H2(g)
 CHCl3(g)+HCl(g),达到平衡后,测得实验数据见表:
CHCl3(g)+HCl(g),达到平衡后,测得实验数据见表:| 实验序号 | 温度/C | 初始n(CCl4)/mol | 初始n(H2)/mol | 平衡时n(CHCl3)/mol |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
② 实验1中CCl4的转化率为
③ 判断该反应的正反应是吸热反应还是放热反应,并说明理由。
(2)向一个2 L的密闭容器中充入7 mol A气体和5 mol B气体,充分混合后在一定条件下反应:3A(g)+B(g)
 2C(s)+xD(g),经5 min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·(L·min)-1 ,求:
2C(s)+xD(g),经5 min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·(L·min)-1 ,求:①B的转化率
②x的值为
③平衡时压强与初始时压强之比
④此温度下此反应的平衡常数的值为
更新时间:2021-10-13 23:51:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:________________________ 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=___________ kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=_______ 。
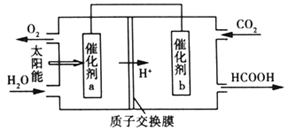
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________ 。
(5)氮氧化物进入水体可转化为 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
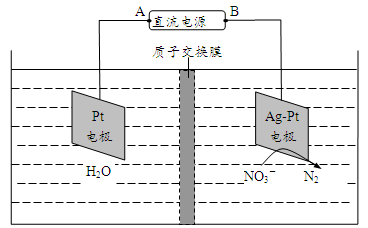
电源正极为_______ (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的 为
为_________ g。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为

(5)氮氧化物进入水体可转化为
 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为
 为
为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】 、
、 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。
Ⅰ.已知: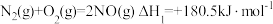
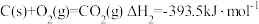
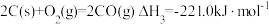
(1)某反应的平衡常数表达式为 ,此反应的热化学方程式为:
,此反应的热化学方程式为:___________ 。
(2)向绝热恒容密闭容器中充入等量的 和
和 进行反应,能判断反应已达到化学平衡状态的是
进行反应,能判断反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的压强不变b.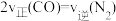
c.气体的平均相对分子质量保持34.2不变d.该反应平衡常数保持不变
e. 和
和 的体积比保持不变
的体积比保持不变
Ⅱ. 可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:
可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:

(3)用离子方程式表示 溶液具有碱性的原因
溶液具有碱性的原因___________ 。 与氯水反应的离子方程式是
与氯水反应的离子方程式是___________ 。
(4)含 的烟气可用
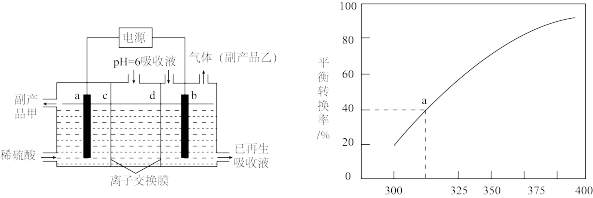
的烟气可用 溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为
溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为___________ 。(任写一个)。离子交换膜___________ (填标号)为阴离子交换膜。
(5)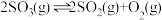 ,将一定量的
,将一定量的 放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知
放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知 的起始压强为
的起始压强为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 、
、 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。Ⅰ.已知:
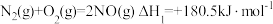
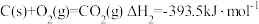
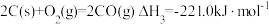
(1)某反应的平衡常数表达式为
 ,此反应的热化学方程式为:
,此反应的热化学方程式为:(2)向绝热恒容密闭容器中充入等量的
 和
和 进行反应,能判断反应已达到化学平衡状态的是
进行反应,能判断反应已达到化学平衡状态的是a.容器中的压强不变b.
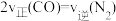
c.气体的平均相对分子质量保持34.2不变d.该反应平衡常数保持不变
e.
 和
和 的体积比保持不变
的体积比保持不变Ⅱ.
 可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:
可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:
(3)用离子方程式表示
 溶液具有碱性的原因
溶液具有碱性的原因 与氯水反应的离子方程式是
与氯水反应的离子方程式是(4)含
 的烟气可用
的烟气可用 溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为
溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为
(5)
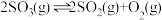 ,将一定量的
,将一定量的 放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知
放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知 的起始压强为
的起始压强为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
您最近一年使用:0次
【推荐3】含碳物质的转化,有利于“减碳”和可持续性发展,有重要的研究价值。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)⇌NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) △H2=+72.5kJ/mol
总反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) △H3=-87.0kJ/mol
①反应I的△H1=________ kJ/mol。
②一定温度下,在体积固定的密闭容器中按化学计量数比投料进行反应Ⅲ,下列不能说明反应I达到化学平衡状态的是_______ 。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)用惰性电极电解KHCO3溶液可将空气中的CO2转化为甲酸根(HCOO-)和 ,则该电极反应式为
,则该电极反应式为______ ;若电解过程中转移1mol电子,则阳极生成气体的体积为______ L(标准状况)。
(3)利用工业废气中的CO2可以制取甲醇,CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),一定条件下往恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的反应是_______ (填“反应I”、“反应II”、“反应III”)。
②b点v(正)_______ v(逆)(填“>”、“<”、“=”)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_____ 。
④c点时总压强为p,该反应的平衡常数=_____ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)⇌NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) △H2=+72.5kJ/mol
总反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) △H3=-87.0kJ/mol
①反应I的△H1=
②一定温度下,在体积固定的密闭容器中按化学计量数比投料进行反应Ⅲ,下列不能说明反应I达到化学平衡状态的是
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)用惰性电极电解KHCO3溶液可将空气中的CO2转化为甲酸根(HCOO-)和
 ,则该电极反应式为
,则该电极反应式为(3)利用工业废气中的CO2可以制取甲醇,CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),一定条件下往恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的反应是
②b点v(正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是
④c点时总压强为p,该反应的平衡常数=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g) + H2O(1) + SO2(g)=(NH4)2SO3(aq) ΔH=akJ/mol
2NH4HSO3(aq)=((NH4)2SO3 (aq) + H2O(l) + SO2(g) ΔH =bkJ/mol
2(NH4)2SO3(aq) + O2(g)= 2(NH4)2SO4 (aq) ΔH = ckJ/mol
反应2NH3(g) + 2NH4HSO3(aq)+O2(g)= 2(NH4)2SO4+(aq)的 ΔH =_______ kJ/mol(用含a、 b、c的代数式表示)。
(2)H2S与CO2在高温下发生反应: H2S(g) + CO2(g) COS(g)+ H2O(g)。在610K时,将。0.40 mol H2S与0.20 mol CO2充入5 L的空钢瓶中,反应达到平衡后水的物质的量分数为0.2。
COS(g)+ H2O(g)。在610K时,将。0.40 mol H2S与0.20 mol CO2充入5 L的空钢瓶中,反应达到平衡后水的物质的量分数为0.2。
①上述条件下H2S的平衡转化事α1=_______ %。
②若在620 K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH_______ 0(填“<” “>”“<或=”)。
③在610 K时反应H2S(g) + CO2(g) COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是
COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是_______ (填标号)。
A.向容器中通入H2S B.向容器中通入CO2
C.加入催化剂 D.缩小容器的体积
(3)在气体总压强分别为p1和p2时,反应2SO3(g) 2SO2 g) + O2(g)在不同温度下达到平衡, 测得SO3(g)及SO2(g)的物质的量分数如图所示:
2SO2 g) + O2(g)在不同温度下达到平衡, 测得SO3(g)及SO2(g)的物质的量分数如图所示:_______ p1(填:“>”或”<”) :判断的理由是_______ 。
②若p1=8.1MPa,起始时充入a mol的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=_______ MPa(用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g) + H2O(1) + SO2(g)=(NH4)2SO3(aq) ΔH=akJ/mol
2NH4HSO3(aq)=((NH4)2SO3 (aq) + H2O(l) + SO2(g) ΔH =bkJ/mol
2(NH4)2SO3(aq) + O2(g)= 2(NH4)2SO4 (aq) ΔH = ckJ/mol
反应2NH3(g) + 2NH4HSO3(aq)+O2(g)= 2(NH4)2SO4+(aq)的 ΔH =
(2)H2S与CO2在高温下发生反应: H2S(g) + CO2(g)
 COS(g)+ H2O(g)。在610K时,将。0.40 mol H2S与0.20 mol CO2充入5 L的空钢瓶中,反应达到平衡后水的物质的量分数为0.2。
COS(g)+ H2O(g)。在610K时,将。0.40 mol H2S与0.20 mol CO2充入5 L的空钢瓶中,反应达到平衡后水的物质的量分数为0.2。①上述条件下H2S的平衡转化事α1=
②若在620 K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH
③在610 K时反应H2S(g) + CO2(g)
 COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是
COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是A.向容器中通入H2S B.向容器中通入CO2
C.加入催化剂 D.缩小容器的体积
(3)在气体总压强分别为p1和p2时,反应2SO3(g)
 2SO2 g) + O2(g)在不同温度下达到平衡, 测得SO3(g)及SO2(g)的物质的量分数如图所示:
2SO2 g) + O2(g)在不同温度下达到平衡, 测得SO3(g)及SO2(g)的物质的量分数如图所示: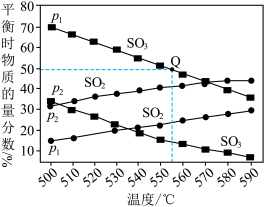
②若p1=8.1MPa,起始时充入a mol的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为
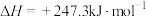 。回答下列问题:
。回答下列问题:
(1)将原料按初始组成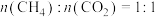 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如下图所示。
体积分数与温度的关系如下图所示。
①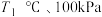 下,
下, (平衡时气体)
(平衡时气体)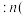 初始气体
初始气体
___________ ;该温度下,此反应的平衡常数
___________ (以分压表示,列出计算式)。
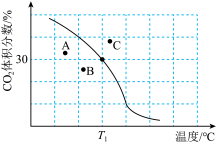
②若A、B、C三点表示不同温度和压强下已达平衡时 的体积分数,
的体积分数,___________ 点对应的平衡常数最小,理由是___________ ;___________ 点对应压强最大,理由是___________ 。
(2) 下,将
下,将 和
和 的混合气体(投料比
的混合气体(投料比 )按一定流速通过盛有炭催化剂的反应器,测得
)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
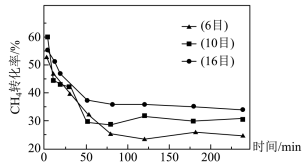
由图可知,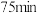 后
后 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为
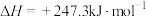 。回答下列问题:
。回答下列问题:(1)将原料按初始组成
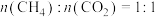 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如下图所示。
体积分数与温度的关系如下图所示。
①
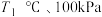 下,
下, (平衡时气体)
(平衡时气体)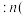 初始气体
初始气体

②若A、B、C三点表示不同温度和压强下已达平衡时
 的体积分数,
的体积分数,(2)
 下,将
下,将 和
和 的混合气体(投料比
的混合气体(投料比 )按一定流速通过盛有炭催化剂的反应器,测得
)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
由图可知,
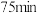 后
后 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】CO可用于合成甲醇,化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)。
(1)图1是反应CO(g)+2H2(g)⇌CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
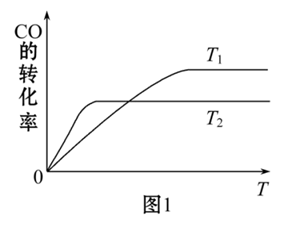
①该反应的焓变ΔH_______ 0(填“>”“<”或“=”)。
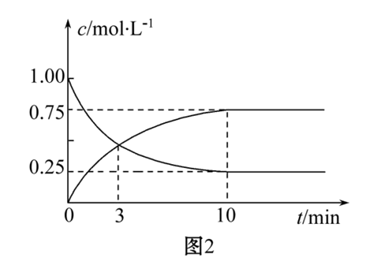
②在T1温度下,往体积为1L的密闭容器中,充入1molCO和2molH2,经测得CO和CH3OH的浓度随时间变化如图2所示。则该反应的平衡常数表达式为K=_______ ,H2的平衡转化率为_______ 。
③若容器容积不变,下列措施可增加CO转化率的是_______ (填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线z对应的温度是_______ ℃;该温度下上述反应的化学平衡常数为_______ 。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为_______ 。
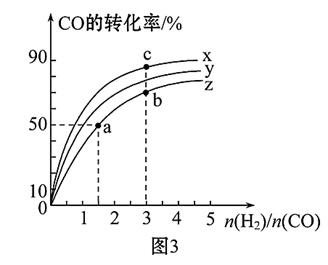
(1)图1是反应CO(g)+2H2(g)⇌CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH
②在T1温度下,往体积为1L的密闭容器中,充入1molCO和2molH2,经测得CO和CH3OH的浓度随时间变化如图2所示。则该反应的平衡常数表达式为K=

③若容器容积不变,下列措施可增加CO转化率的是
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线z对应的温度是

您最近一年使用:0次



