甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)汽油的主要成分之一是辛烷[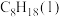 ]。已知:25℃、101kPa时,1mol
]。已知:25℃、101kPa时,1mol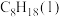 完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为
完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为______ 。
(2)已知:25℃、101kPa时,

相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______ 。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是______ 。
Ⅱ.甲醇的合成
(4)以 和
和 为原料合成甲醇,反应的能量变化如图所示。
为原料合成甲醇,反应的能量变化如图所示。
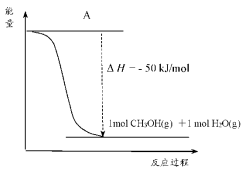
①补全图:图中A处应填入______ 。
②由图可知,该反应中反应物 和
和 的总能量
的总能量______ (填“大于”、“小于”或“等于”)生成物 和
和 的总能量。
的总能量。
(5)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由 合成1mol液态甲醇和1mol液态水将
合成1mol液态甲醇和1mol液态水将______ (填“吸收”或“放出”)______ kJ热量。
(6)已知: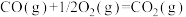
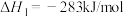
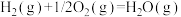
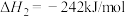
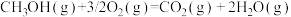
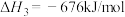
以 和
和 为原料合成甲醇的反应为
为原料合成甲醇的反应为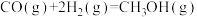 。
。
该反应的 为
为______ kJ/mol。
(1)汽油的主要成分之一是辛烷[
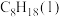 ]。已知:25℃、101kPa时,1mol
]。已知:25℃、101kPa时,1mol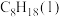 完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为
完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为(2)已知:25℃、101kPa时,
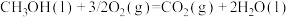

相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是
Ⅱ.甲醇的合成
(4)以
 和
和 为原料合成甲醇,反应的能量变化如图所示。
为原料合成甲醇,反应的能量变化如图所示。
①补全图:图中A处应填入
②由图可知,该反应中反应物
 和
和 的总能量
的总能量 和
和 的总能量。
的总能量。(5)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由
 合成1mol液态甲醇和1mol液态水将
合成1mol液态甲醇和1mol液态水将(6)已知:
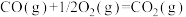
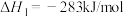
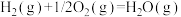
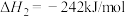
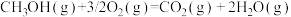
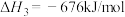
以
 和
和 为原料合成甲醇的反应为
为原料合成甲醇的反应为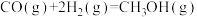 。
。该反应的
 为
为
更新时间:2021-10-25 22:52:38
|
相似题推荐
【推荐1】尽管NOx、SO2、CO都是有毒气体,但是它们在生产、医学领域中都有重要应用。合理利用或转化CO、NOx等污染性气体是人们共同关注的课题。回答下列问题:
(1)已知:①CO(g)+ H2O(g)=CO2(g)+H2(g) △H=-41.0kJ·mol-1
②N2(g)+ O2(g)=2NO(g) △H=+ 180.0kJ· mol-1
③H2(g)+ O2 (g)=H2O(g) △H=- 241.8kJ·mol-l
O2 (g)=H2O(g) △H=- 241.8kJ·mol-l
CO和NO按一定比例混合,在适当催化剂作用下可生成无毒气体实现安全排放,该反应的热化学方程式为_______ 。
(2)研究发现CO和水蒸气在双功能催化剂(能吸附不同粒子)作用下发生反应CO(g)+ H2O(g)=CO2(g) +H2(g) △H<0, 反应机理的变化过程示意图如图所示。(CO吸附在催化剂表面,可用*CO表示,其他物种依次类推):_______ 。
(3)直接电解吸收NOX制备硝酸。用稀硝酸吸收NOx生成HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。_______ 。
②若b极处放出的气体可直接排放到空气中,则该气体物质是_______ ( 写名称)。
(4)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,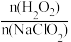 、 溶液pH对脱硫脱硝的影响如图所示:
、 溶液pH对脱硫脱硝的影响如图所示:_______ 。
②根据图示SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是_______ 。
(1)已知:①CO(g)+ H2O(g)=CO2(g)+H2(g) △H=-41.0kJ·mol-1
②N2(g)+ O2(g)=2NO(g) △H=+ 180.0kJ· mol-1
③H2(g)+
 O2 (g)=H2O(g) △H=- 241.8kJ·mol-l
O2 (g)=H2O(g) △H=- 241.8kJ·mol-lCO和NO按一定比例混合,在适当催化剂作用下可生成无毒气体实现安全排放,该反应的热化学方程式为
(2)研究发现CO和水蒸气在双功能催化剂(能吸附不同粒子)作用下发生反应CO(g)+ H2O(g)=CO2(g) +H2(g) △H<0, 反应机理的变化过程示意图如图所示。(CO吸附在催化剂表面,可用*CO表示,其他物种依次类推):

(3)直接电解吸收NOX制备硝酸。用稀硝酸吸收NOx生成HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。

②若b极处放出的气体可直接排放到空气中,则该气体物质是
(4)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,
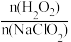 、 溶液pH对脱硫脱硝的影响如图所示:
、 溶液pH对脱硫脱硝的影响如图所示:
②根据图示SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:___ 。
H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) ΔH1=+327kJ·mol-1
O2(g) ΔH1=+327kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110kJ·mol-1
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是___ (填序号)。
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是___ (填字母)。
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
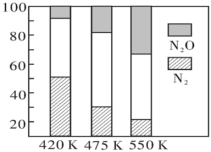
(3)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是__ 。
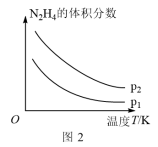
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2L的恒容密闭容器中充入2molN2H4,发生反应N2H4(g) N2(g)+2H2(g),
N2(g)+2H2(g), (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=__ 。

(5)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2___ (填“大于”或“小于”)p1。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:
H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) ΔH1=+327kJ·mol-1
O2(g) ΔH1=+327kJ·mol-1SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110kJ·mol-1
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g)
 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
(3)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2L的恒容密闭容器中充入2molN2H4,发生反应N2H4(g)
 N2(g)+2H2(g),
N2(g)+2H2(g), (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(5)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】丙烯是一种重要的化工原料。可在一固定容积的密闭容器中由丙烷催化脱氢制备。
(1)已知:
①C3H8(g)=C3H6(g)+H2(g)
②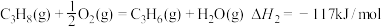
③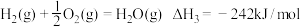
反应①的
________________ 。
(2)欲提高①反应中 的平衡转化率,可采取的措施有________________(填标号)。
的平衡转化率,可采取的措施有________________(填标号)。
(3)能表明该反应①达到平衡状态的是_______________(填字母)。
(4)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为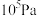 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为__________________ 。该反应的平衡常数
________________ Pa。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)反应④:
在不同催化剂作用下合成甲醇,相同时间内 的转化率随温度变化如图所示,
的转化率随温度变化如图所示,

其中活化能最高,反应速率最慢的所用的催化剂是______ (填“A”、“B”或“C”);请解释温度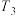 之前催化剂不同转化率不同,高于
之前催化剂不同转化率不同,高于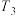 后转化率相同且下降的原因
后转化率相同且下降的原因________________
(1)已知:
①C3H8(g)=C3H6(g)+H2(g)

②
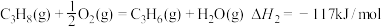
③
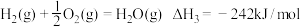
反应①的

(2)欲提高①反应中
 的平衡转化率,可采取的措施有________________(填标号)。
的平衡转化率,可采取的措施有________________(填标号)。A.增大 的浓度 的浓度 | B.提高温度 | C.恒容下通入惰性气体 | D.使用高效催化剂 |
| A.C3H8的转化率等于H2的产率 | B.混合气体的平均相对分子质量不变 |
C.v(C3H8)与 的比值不变 的比值不变 | D.混合气体的密度不变 |
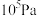 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为
(5)反应④:

在不同催化剂作用下合成甲醇,相同时间内
 的转化率随温度变化如图所示,
的转化率随温度变化如图所示,
其中活化能最高,反应速率最慢的所用的催化剂是
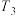 之前催化剂不同转化率不同,高于
之前催化剂不同转化率不同,高于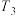 后转化率相同且下降的原因
后转化率相同且下降的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对含氮化合物的处理是环境治理的重要方面。
(1)NH3催化还原NOx是目前应用最广泛的烟气氮氧化物脱除技术。已知
①4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1
②N2(g)+O2(g) 2NO(g) △H2
2NO(g) △H2
③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H=
5N2(g)+6H2O(l) △H=_______ (用△H1、△H2、△H3表示)。
(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2NO(g) N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。
N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。
①10 min内,v(N2)=_____ mol·L-1·min-1,在T℃时,该反应的平衡常数K=____ 。
②在恒容绝热条件下,下列能判断该反应一定达到化学平衡状态的是_____ (填字母)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)已知:25℃时,HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.8×10-5 mol·L-1.实验室可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。
①已知溶液甲为0.1 mol·L-1 NaNO3和0.1 mol·L-1 NaNO2的混合溶液,溶液乙为0.1 mol·L-1的CH3COONa溶液,则两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为_______ ,使溶液甲和溶液乙的pH相等的方法是______ (填字母)。
a.向溶液甲中加适量NaOH b.向溶液甲中加适量水
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
②一定温度下,等体积、等物质的量浓度CH3COONa和NaNO2两溶液中阴离子的总物质的量分别为n1、n2,则n1_______ (填“>”“<”或“=”)n2。
(1)NH3催化还原NOx是目前应用最广泛的烟气氮氧化物脱除技术。已知
①4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1②N2(g)+O2(g)
 2NO(g) △H2
2NO(g) △H2③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H=
5N2(g)+6H2O(l) △H=(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2NO(g)
 N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。
N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。①10 min内,v(N2)=
②在恒容绝热条件下,下列能判断该反应一定达到化学平衡状态的是
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)已知:25℃时,HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.8×10-5 mol·L-1.实验室可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。
①已知溶液甲为0.1 mol·L-1 NaNO3和0.1 mol·L-1 NaNO2的混合溶液,溶液乙为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(
 )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为a.向溶液甲中加适量NaOH b.向溶液甲中加适量水
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
②一定温度下,等体积、等物质的量浓度CH3COONa和NaNO2两溶液中阴离子的总物质的量分别为n1、n2,则n1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】2007年10月24日我国自主研发的第一颗月球探测卫星“嫦娥一号”的成功发射,“嫦娥一号”三级火箭所用的燃料是高性能、高纯度的液氢燃料和液氧氧化剂,氢气不仅是一种高能燃料,也是一种可再生的绿色能源。
(1)氢气的燃烧热为285.8 kJ/mol,写出其燃烧热的热化学方程式:___________ 。
(2)实验测得1 mol H2与1 mol Cl2完全反应放出184.6 kJ的热量,又知1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,1 mol Cl2分子中化学键断裂需要吸收243 kJ的能量。则1 mol HCl分子中化学键断裂时需要吸收_________ 的能量。
(3)已知2H2O(g)=2H2(g)+O2(g);△H=+483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);△H=+67.8 kJ/mol
3H2(g)+N2(g)=2NH3(g);△H=﹣92.0 kJ/mol
则1 mol NH3(g)燃烧生成NO2(g)和H2O(g)的反应热△H=__________ 。
(4)CO2可转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
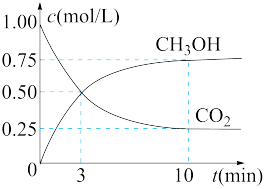
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为________________ 。
②若反应在容积可变的容器中进行。缩小容器体积使压强增大,平衡向__________ 反应方向移动(填“正”或“逆”),平衡常数K值_________ (填“增大”、“减小”或“不变”)。
(1)氢气的燃烧热为285.8 kJ/mol,写出其燃烧热的热化学方程式:
(2)实验测得1 mol H2与1 mol Cl2完全反应放出184.6 kJ的热量,又知1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,1 mol Cl2分子中化学键断裂需要吸收243 kJ的能量。则1 mol HCl分子中化学键断裂时需要吸收
(3)已知2H2O(g)=2H2(g)+O2(g);△H=+483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);△H=+67.8 kJ/mol
3H2(g)+N2(g)=2NH3(g);△H=﹣92.0 kJ/mol
则1 mol NH3(g)燃烧生成NO2(g)和H2O(g)的反应热△H=
(4)CO2可转化为甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为
②若反应在容积可变的容器中进行。缩小容器体积使压强增大,平衡向
您最近一年使用:0次
【推荐3】氮、碳氧化物的排放会对环境造成污染。多年来化学工作者对氮、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) N2O2(g) (快) ∆H1<0;
N2O2(g) (快) ∆H1<0;
v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) 2NO2(g) (慢) ∆H2< 0;
2NO2(g) (慢) ∆H2< 0;
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大___ (填“第一步”或“第二步”)。
②一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________ ;
II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH1>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=______________________ (用含 ΔH1 、ΔH2 、 ΔH3的代数式表示)若固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。


同温度下CO2的平衡转化率大于CH4的平衡转化率,原因是_________ 。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____ v(逆)(填 “大于”“小于”或“等于”)。已知气体分压(p 分)=气体总压(p 总)× 气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x 点对应温度下反应的平衡常数Kp=__________________ 。
III.根据2CrO42﹣+2H+ Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的_________ 极,电解制备过程的总反应化学方程式为_________ 。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为_________ 。若选择用熔融K2CO3作介质的甲烷(CH4)燃料电池充当电源,则负极反应式为________________ 。
I.已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步:2NO(g)
 N2O2(g) (快) ∆H1<0;
N2O2(g) (快) ∆H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)
 2NO2(g) (慢) ∆H2< 0;
2NO2(g) (慢) ∆H2< 0;v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大
②一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH1>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=


同温度下CO2的平衡转化率大于CH4的平衡转化率,原因是
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g)
 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)III.根据2CrO42﹣+2H+
 Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的
您最近一年使用:0次



