化学反应过程中,不仅有物质的变化,同时还伴随有能量的变化。
(1)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s) △H=﹣Q1kJ•mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s) △H=﹣Q2kJ•mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为_____ 。(填正确答案标号)
A. Q1<Q2
B. Q1=Q2
C. Q1>Q2
D. 无法确定
(2)已知拆开1molHCl分子中的化学键需要消耗431kJ能量,根据下面的能量图回答下列问题:
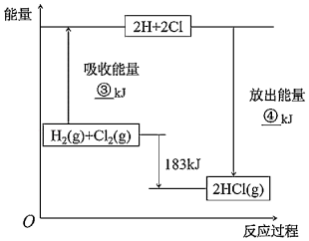
分别写出③、④的数值:
③_____ kJ;
④_____ kJ。
(3)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知64g液态肼和足量H2O2反应,生成氮气和水蒸气,放出Q3kJ的热量。写出该反应的热化学方程式_____ 。
(4)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ•mol﹣1
H2O(l)=H2O(g)△H=+44.0kJ•mol﹣1
写出表示甲醇燃烧热的热化学方程式_____ 。
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ•mol﹣1
C(s)+O2(g)=CO2(g)△H2=﹣393.5kJ•mol﹣1
2C(S)+O2(g)=2CO(g)△H3=﹣221.0kJ•mol﹣1
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_____ 。
(1)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s) △H=﹣Q1kJ•mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s) △H=﹣Q2kJ•mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为
A. Q1<Q2
B. Q1=Q2
C. Q1>Q2
D. 无法确定
(2)已知拆开1molHCl分子中的化学键需要消耗431kJ能量,根据下面的能量图回答下列问题:

分别写出③、④的数值:
③
④
(3)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知64g液态肼和足量H2O2反应,生成氮气和水蒸气,放出Q3kJ的热量。写出该反应的热化学方程式
(4)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ•mol﹣1
H2O(l)=H2O(g)△H=+44.0kJ•mol﹣1
写出表示甲醇燃烧热的热化学方程式
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ•mol﹣1
C(s)+O2(g)=CO2(g)△H2=﹣393.5kJ•mol﹣1
2C(S)+O2(g)=2CO(g)△H3=﹣221.0kJ•mol﹣1
若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式
更新时间:2021-10-28 17:08:10
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) N2O2(g) (快) ∆H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) ∆H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) 2NO2(g) (慢) ∆H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) ∆H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) 2NO2(g)的反应速率主要是由
2NO2(g)的反应速率主要是由______ (填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________ ;
已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步:2NO(g)
 N2O2(g) (快) ∆H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) ∆H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)第二步:N2O2(g)+O2(g)
 2NO2(g) (慢) ∆H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) ∆H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)①2NO(g)+O2(g)
 2NO2(g)的反应速率主要是由
2NO2(g)的反应速率主要是由②一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:①C(s)+H2O(g) =CO(g)+H2(g) ΔH1
②2CO(g)+O2(g)= 2CO2(g) ΔH2
③H2O(g)=H2(g)+ O2(g) ΔH3
O2(g) ΔH3
则C(s)+ O2(g)=CO2(g)的 ΔH=___________ (用ΔH1、ΔH2、ΔH3表示)。
②2CO(g)+O2(g)= 2CO2(g) ΔH2
③H2O(g)=H2(g)+
 O2(g) ΔH3
O2(g) ΔH3则C(s)+ O2(g)=CO2(g)的 ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】煤作为燃料,可以有下列两种途径(把煤看成由碳组成):
途径Ⅰ:C(s)+O2(g)= CO2(g) ΔH=-a kJ·mol-1
途径Ⅱ:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-d kJ·mol-1
试回答下列问题:
(1)燃烧等质量的煤,途径Ⅰ放出的热量____ 途径Ⅱ放出的热量(填“大于”、“小于”或“等于”)。
(2)b的数学关系式是______________ (用a、c、d表示)。
(3)由于制取水煤气反应中,反应物具有的总能量________ (填“大于”、“小于”或“等于”)生成物所具有的总能量,在反应时,反应物需要______ (填“吸收”或“放出”)能量才能转化为生成物。
(4)简述煤通过途径Ⅱ作为燃料的意义___________________________________ 。
途径Ⅰ:C(s)+O2(g)= CO2(g) ΔH=-a kJ·mol-1
途径Ⅱ:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-d kJ·mol-1
试回答下列问题:
(1)燃烧等质量的煤,途径Ⅰ放出的热量
(2)b的数学关系式是
(3)由于制取水煤气反应中,反应物具有的总能量
(4)简述煤通过途径Ⅱ作为燃料的意义
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
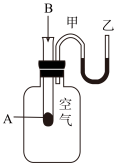
①该反应为____ 反应(填“放热”或“吸热”)。
②A和B的总能量比C和D的总能量____ (填“高”或“低”)。
③反应物化学键断裂吸收的能量____ (填“大”或“小”)于生成物化学键形成放出的能量。
(2)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为____ 。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为____ 。
(4)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-akJ/mol
途径II:C3H8(g)=C3H6(g)+H2(g) ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量____ (填“大于”、“等于”或“小于”)途径II放出的热量。
(1)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

①该反应为
②A和B的总能量比C和D的总能量
③反应物化学键断裂吸收的能量
(2)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为
(4)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-akJ/mol
途径II:C3H8(g)=C3H6(g)+H2(g) ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】由于人类的活动向大气排放 对环境造成了一定的污染,我国严格控制其排放总量,标志着国家已经从单纯控制
对环境造成了一定的污染,我国严格控制其排放总量,标志着国家已经从单纯控制 向全面控制酸性气体排放的方向走出了新的一步。
向全面控制酸性气体排放的方向走出了新的一步。
用 催化还原
催化还原 可以消除氮氧化合物的污染。例如:
可以消除氮氧化合物的污染。例如:
① ;
; kJ/mol
kJ/mol
② ;
; kJ/mol
kJ/mol
(1)根据上述信息推断正确的是___________
(2)正确的选项是___________
 对环境造成了一定的污染,我国严格控制其排放总量,标志着国家已经从单纯控制
对环境造成了一定的污染,我国严格控制其排放总量,标志着国家已经从单纯控制 向全面控制酸性气体排放的方向走出了新的一步。
向全面控制酸性气体排放的方向走出了新的一步。用
 催化还原
催化还原 可以消除氮氧化合物的污染。例如:
可以消除氮氧化合物的污染。例如:①
 ;
; kJ/mol
kJ/mol②
 ;
; kJ/mol
kJ/mol(1)根据上述信息推断正确的是___________
A.等物质的量的 在反应①、②中转移电子数相同 在反应①、②中转移电子数相同 |
B.由反应②可推知: ; ; kJ/mol kJ/mol |
C. ; ; kJ/mol kJ/mol |
D.若用标准状况下4.48 L  把 把 还原为 还原为 ,整个过程中转移的电子总数为 ,整个过程中转移的电子总数为 |
| A.化学反应中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 |
B.甲烷的燃烧热 kJ/mol,则甲烷燃烧的热化学方程式为: kJ/mol,则甲烷燃烧的热化学方程式为:  kJ/mol kJ/mol |
C.常温常压下: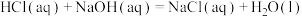 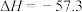 kJ/mol,则: kJ/mol,则: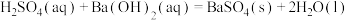  kJ/mol kJ/mol |
D.已知  kJ·mol kJ·mol , ,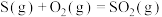  kJ/mol,则 kJ/mol,则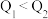 |
您最近一年使用:0次
【推荐3】在 1×105 Pa 和 298 K 时,将 1 mol 气态 AB 分子分离成气态 A 原子和 B 原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知氨分子中有 3 个等价的氮氢共价键):
(1)根据上表中的数据判断工业合成氨的反应:
N2(g)+3H2(g) 2NH3(g)是
2NH3(g)是____________ (填“吸热”或“放热”)反应。
(2)在 298 K 时,取 1 mol 氮气和 3 mol 氢气放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为 Q1,则 Q1=__________ 。
(3)实际生产中,放出或吸收的热量为 Q2,Q1与 Q2比较正确的是_______________ (填选项号)。
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2
| 共价键 | H—H |  | N—H |
| 键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应:
N2(g)+3H2(g)
 2NH3(g)是
2NH3(g)是(2)在 298 K 时,取 1 mol 氮气和 3 mol 氢气放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为 Q1,则 Q1=
(3)实际生产中,放出或吸收的热量为 Q2,Q1与 Q2比较正确的是
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2
您最近一年使用:0次



