肼(N2H4)的熔点2.0℃、沸点113.5℃,极易溶于水,在碱性介质中具有还原性。在强碱性介质中,用次氯酸钠氧化尿素[CO(NH2)2]可得粗肼,再经蒸馏得到肼溶液。
回答下列问题:
I.制备NaClO强碱性溶液

(1)怎样检查上面装置的气密性___________ ?
(2)A为氯气发生装置,A中反应的化学方程式是___________
(3)次氯酸钠高于35℃容易分解。制备NaClO强碱性溶液时需要注意的两个关键问题是:___________
II.制备N2H4

(4)仪器F的名称是___________
(5)通入N2目的是___________
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为___________
(7)向三颈烧瓶中加入NaClO强碱性溶液应当___________ (填“一次大量”或“分批少量”)加入,充分反应后制得粗肼。蒸馏提纯时应调节控温槽的温度略高于___________ ℃,得到肼溶液。
回答下列问题:
I.制备NaClO强碱性溶液

(1)怎样检查上面装置的气密性
(2)A为氯气发生装置,A中反应的化学方程式是
(3)次氯酸钠高于35℃容易分解。制备NaClO强碱性溶液时需要注意的两个关键问题是:
II.制备N2H4

(4)仪器F的名称是
(5)通入N2目的是
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为
(7)向三颈烧瓶中加入NaClO强碱性溶液应当
21-22高三上·湖南常德·阶段练习 查看更多[3]
湖南省临澧县第一中学2021-2022学年高三上学期第四阶段性考试化学试题(已下线)第二章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)新疆和田地区第二中学2022-2023学年高三上学期11月期中考试化学试题
更新时间:2021-10-29 13:23:13
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:

(1)“煅烧氧化”时,1molMnO完全转化为Na2MnO4失去电子的物质的量为____ mol;MnO2煅烧反应的化学方程式为______________ 。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________ 。
(3)“调pH”是将溶液pH调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应生成MnO2和____________ 。
(4)“还原”时有无机含氧酸盐生成,反应的化学方程式为___________ 。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1:准确称取mg产品,加入c1mol/LNa2C2O4溶液V1mL(过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2:用c2mol/LKMnO4标准溶液滴定剩余的Na2C2O4,滴定至终点时消耗KMnO4标准溶液VmL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+l0CO2↑+K2SO4+8H2O)
步骤2达滴定终点时的判断依据是___________ ,产品中MnO2的质量分数为w(MnO2)=______ (列出计算表达式即可)。

(1)“煅烧氧化”时,1molMnO完全转化为Na2MnO4失去电子的物质的量为
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有
(3)“调pH”是将溶液pH调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应生成MnO2和
(4)“还原”时有无机含氧酸盐生成,反应的化学方程式为
(5)测定产品中MnO2质量分数的步骤如下:
步骤1:准确称取mg产品,加入c1mol/LNa2C2O4溶液V1mL(过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2:用c2mol/LKMnO4标准溶液滴定剩余的Na2C2O4,滴定至终点时消耗KMnO4标准溶液VmL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+l0CO2↑+K2SO4+8H2O)
步骤2达滴定终点时的判断依据是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】海洋元素“溴”的单质及其化合物的用途广泛。
(1)Br原子的最外层电子排布式为_______ ,其中未成对电子的电子云形状为_______ 。
(2)能作为溴、碘元素原子得电子能力递变规律的判断依据是_______ (填序号)。
a.IBr中溴为﹣1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)从原子结构角度解释氯的非金属性强于溴的原因:_______ 。
(4)Br2和碱金属单质形成的MBr熔点如表:
NaBr的电子式_______ ,MBr熔点呈现表中趋势的原因是_______ 。
(5)海水提溴过程中,先向酸化的浓缩海水中通入_______ ,将其中的Br—氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_______ mol,反应中氧化产物为_______ 。
(6)随后用硫酸酸化吸收液,得到Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得Br2的质量减少,可能原因是_______ 。
(1)Br原子的最外层电子排布式为
(2)能作为溴、碘元素原子得电子能力递变规律的判断依据是
a.IBr中溴为﹣1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)从原子结构角度解释氯的非金属性强于溴的原因:
(4)Br2和碱金属单质形成的MBr熔点如表:
| MBr | NaBr | KBr | RbBr | CsBr |
| 熔点/℃ | 747 | 734 | 693 | 636 |
(5)海水提溴过程中,先向酸化的浓缩海水中通入
(6)随后用硫酸酸化吸收液,得到Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得Br2的质量减少,可能原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】利用如图所示的装置进行有关实验。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:

(1)该实验的主要目的是研究干燥的氯气是否具有_______ 作用。
(2)浓硫酸的作用是_______ 。
(3)实验过程中观察到B瓶中干燥的有色布条_______ (填“褪”或“不褪”)色。
(4)在该实验中,装置存在缺陷,还应加盛有_______ 的尾气处理装置。
(5)氯水久置或光照条件下均会变成稀盐酸,同时释放出氧气,说明次氯酸_______ ,反应的化学方程式为_______ 。
(6)为了使用方便和使用效果更理想,人们在氯气与水反应原理的基础上,在常温下,通过将Cl2通入NaOH溶液中,可以得到一种漂白液。上述反应的化学方程式为_______ ,该漂白液的有效成分是_______ 。

(1)该实验的主要目的是研究干燥的氯气是否具有
(2)浓硫酸的作用是
(3)实验过程中观察到B瓶中干燥的有色布条
(4)在该实验中,装置存在缺陷,还应加盛有
(5)氯水久置或光照条件下均会变成稀盐酸,同时释放出氧气,说明次氯酸
(6)为了使用方便和使用效果更理想,人们在氯气与水反应原理的基础上,在常温下,通过将Cl2通入NaOH溶液中,可以得到一种漂白液。上述反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室用如图装置制取氯气,并用氯气进行实验。回答下列问题:
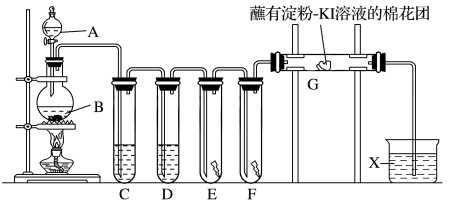
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:_______ 。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是_______ 。
(3)试管C、D中应盛放的试剂名称分别为_______ 、_______ ;
(4)装置G处发生反应的离子方程式为_______ 。
(5)试剂X的作用:_______ ;发生的反应的化学方程式为:_______ 。
(6)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如图。
①“与洁厕灵同时使用”会产生氯气,简述氯气的性质:_______ 。
②“密封保存”的原因:_______ 。

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是
(3)试管C、D中应盛放的试剂名称分别为
(4)装置G处发生反应的离子方程式为
(5)试剂X的作用:
(6)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如图。
| 注意事项: 1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年 |
②“密封保存”的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某学习小组设计以下三个实验探究氯水的组成,请根据下表回答问题。
(1)写出实验①和③的实验现象。a:_______ ,b:_______ 。
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸,你是否同意这个观点?_______ (填“同意”或“不同意”),理由是_______ 。
(3)实验①的化学方程式:_______ 。
(4)若用下图装置检验氯气性质,现关闭活塞 K,若有色布条是干燥的,溶液 A 为浓硫酸,则有色布条_______ ;若溶液 A 为水,则有色布条_______ ;若溶液 A 为饱和的 NaHCO3 溶液,则有色布条_______ 。
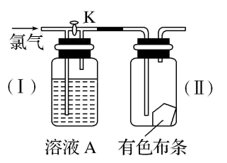
| 实验序号 | 实验方法 | 实验现象 | 实验结论 |
| ① | 将氯水滴加到AgNO3溶液中 | a:_______ | 氯水中含有Cl- |
| ② | 将氯水滴加到含酚酞的NaOH溶液中 | 红色溶液变为无色 | ……… |
| ③ | 将氯水滴加到Na2CO3溶液中 | b:_______ | 氯水中含有H+ |
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸,你是否同意这个观点?
(3)实验①的化学方程式:
(4)若用下图装置检验氯气性质,现关闭活塞 K,若有色布条是干燥的,溶液 A 为浓硫酸,则有色布条

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知无水FeCl3在空气中易潮解,加热易升华。实验室利用如图所示实验装置制取无水FeCl3。

(1)仪器a的名称是___________ ;装置A发生反应的化学方程式为___________ 。
(2)溶液X、Y依次是___________ 、___________ ;装置D发生反应的化学方程式为___________ 。
(3)实验结束时,应先熄灭___________ (填“A”或“D”)处酒精灯;E中冷水的作用是___________ 。
(4)装置F的作用是___________ 。
(5)该实验缺少尾气处理装置,在图中方框内绘制尾气处理装置___________ ,并写出对应的化学方程式___________ 。

(1)仪器a的名称是
(2)溶液X、Y依次是
(3)实验结束时,应先熄灭
(4)装置F的作用是
(5)该实验缺少尾气处理装置,在图中方框内绘制尾气处理装置
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】高铁酸盐在污水处理,水体消杀等方面用途广泛。高铁酸钾(K2FeO4)是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备K2FeO4。回答下列问题:

已知K2FeO4的部分性质如下:
(1)仪器a的名称是___ 。
(2)装置乙可选用下列___ (填标号)。

(3)连接好装置乙后,需对整套装置进行___ 。
(4)装置甲中的试剂X为锰的一种化合物,其化学式是___ 。
(5)制备过程中,装置丙需采用冰水浴,目的是___ ,该装置中制备K2FeO4,的离子方程式是___ 。
(6)装置丁的作用是___ 。

已知K2FeO4的部分性质如下:
| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(2)装置乙可选用下列

(3)连接好装置乙后,需对整套装置进行
(4)装置甲中的试剂X为锰的一种化合物,其化学式是
(5)制备过程中,装置丙需采用冰水浴,目的是
(6)装置丁的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某课外活动小组利用如图所示装置制取氯气。提供的试剂有浓盐酸、饱和NaCl溶液、NaOH溶液、高锰酸钾固体。反应的化学方程式为 。
。

(1)浓盐酸在此反应中显示出来的性质是_______________________ (填序号)。
A.还原性 B.还原性和酸性
C.氧化性 D.氧化性和酸性
(2)装置C中盛放的试剂是_______________________ 。
(3)尾气处理时需关闭弹簧夹a和弹簧夹___________________ ,打开弹簧夹_____________________ 。
(4)若用含1.6mol HCl的浓盐酸与足量的高锰酸钾反应,在标准状况下收集到的氯气体积_______________________ (填序号)。
A. =11.2L B. >11.2L
C. <11.2L D.无法确定
 。
。
(1)浓盐酸在此反应中显示出来的性质是
A.还原性 B.还原性和酸性
C.氧化性 D.氧化性和酸性
(2)装置C中盛放的试剂是
(3)尾气处理时需关闭弹簧夹a和弹簧夹
(4)若用含1.6mol HCl的浓盐酸与足量的高锰酸钾反应,在标准状况下收集到的氯气体积
A. =11.2L B. >11.2L
C. <11.2L D.无法确定
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)明矾净水的原理是___ (用离子方程式表示)。
(2)操作Ⅰ是___ ,操作Ⅱ是蒸发浓缩、___ 、过滤、___ 、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是___ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾的作用:___ 。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:___ ,滤渣2含有的物质是__ 。

回答下列问题:
(1)明矾净水的原理是
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是
(4)在滤液A中加入高锰酸钾的作用:
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
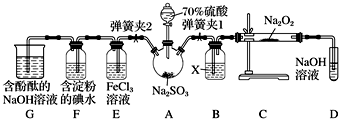
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先__________ ,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是___________ 。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为_____ ;发生反应的离子方程式是________________ 。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。
上述方案是否合理?________ (填“合理”或“不合理”),原因是_____________ 。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:______________________ 。

(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先
(2)装置D中盛放NaOH溶液的作用是
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。
上述方案是否合理?
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】碱式次氯酸镁(化学式Mg(ClO)2·2Mg(OH)2·2H2O,简称BMH)是一种难溶于水的白色粉末,常用作消毒剂。利用碱性NaClO溶液与MgCl2溶液反应可制备BMH:2NaClO + 3MgCl2 + 4NaOH + 2H2O = Mg(ClO)2·2Mg(OH)2·2H2O↓+6NaCl,装置如下图:

请回答下列问题:
(1)装置a中发生反应的化学方程式_______ 。
(2)标出b装置盛装的试剂名称并补全导管 :_______ 。

(3)向装置c中滴加MgCl2溶液之前应进行的操作是_______ 。
(4)反应结束后c中混合物经_______ (填操作名称)、洗涤、干燥后可得BMH产品。干燥产品通常采用吹干、吸干等方式,不采用“高温烘干”的原因是_______ 。
(5)测定产品纯度:称取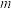 g产品于锥形瓶,加适量稀硫酸和足量KI溶液,充分反应后,滴加几滴淀粉溶液,用
g产品于锥形瓶,加适量稀硫酸和足量KI溶液,充分反应后,滴加几滴淀粉溶液,用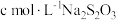 溶液滴定,消耗Na2S2O3溶液体积为V mL。(已知BMH相对分子质量为279,相关反应有:
溶液滴定,消耗Na2S2O3溶液体积为V mL。(已知BMH相对分子质量为279,相关反应有: )
)
① 滴定终点的现象是_______ 。
② 该产品的纯度为_______ (用含m、c、V的代数式表示)。
③ 下列操作会导致实验结果偏小的是_______ (填字母)。
A. 锥形瓶未经干燥 B. 滴定前滴定管尖端无气泡,滴定结束尖端有气泡
C. Na2S2O3溶液部分氧化变质 D. 滴定前平视读数,滴定结束时俯视读数

请回答下列问题:
(1)装置a中发生反应的化学方程式
(2)标出b装置盛装的试剂名称并

(3)向装置c中滴加MgCl2溶液之前应进行的操作是
(4)反应结束后c中混合物经
(5)测定产品纯度:称取
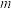 g产品于锥形瓶,加适量稀硫酸和足量KI溶液,充分反应后,滴加几滴淀粉溶液,用
g产品于锥形瓶,加适量稀硫酸和足量KI溶液,充分反应后,滴加几滴淀粉溶液,用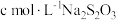 溶液滴定,消耗Na2S2O3溶液体积为V mL。(已知BMH相对分子质量为279,相关反应有:
溶液滴定,消耗Na2S2O3溶液体积为V mL。(已知BMH相对分子质量为279,相关反应有: )
)① 滴定终点的现象是
② 该产品的纯度为
③ 下列操作会导致实验结果偏小的是
A. 锥形瓶未经干燥 B. 滴定前滴定管尖端无气泡,滴定结束尖端有气泡
C. Na2S2O3溶液部分氧化变质 D. 滴定前平视读数,滴定结束时俯视读数
您最近一年使用:0次


 :
:

