海洋资源的利用具有广阔前景。
(1)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是___________ (填序号)
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式___________ 。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是___________ (填字母序号)
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:___________ 。
(2)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为___________ 。
(3)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a、b、c、d括号内数据表示坐标。
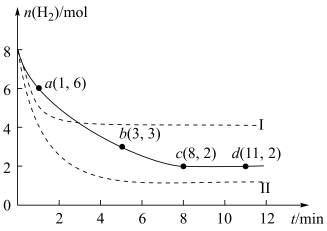
①a点正反应速率___________ (填“大于”“等于”或“小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________ mol/L。
③能够说明该反应达到化学平衡状态的标志是___________ (双选)。
A.单位时间内消耗1 mol CO2,同时生成3 mol H2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
(1)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
③用CCl4提取碘时除了用CCl4还可以选用的试剂是
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:
(2)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为
(3)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a、b、c、d括号内数据表示坐标。

①a点正反应速率
②平衡时CO2的物质的量浓度是
③能够说明该反应达到化学平衡状态的标志是
A.单位时间内消耗1 mol CO2,同时生成3 mol H2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
更新时间:2021-11-01 11:49:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在科研及生产中均有重要的应用。根据已学知识回答下列问题:
I.汽车尾气中发生的反应有:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ•mol-1
(1)已知部分化学键的键能(如表所示)
由以上数据可求得NO的键能为_______ kJ•mol-1。
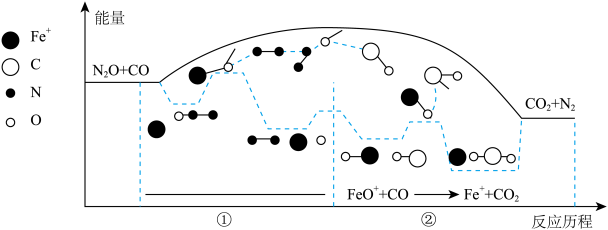
(2)有毒气体N2O、CO在Fe+催化下发生的反应是:N2O(g)+CO(g)=CO2(g)+N2(g),其反应分两步进行(如图所示),写出其中反应①的化学方程式:_______ 。总反应速率的快慢主要由其中一步反应决定,该反应是_______ (填“①”或“②”)。
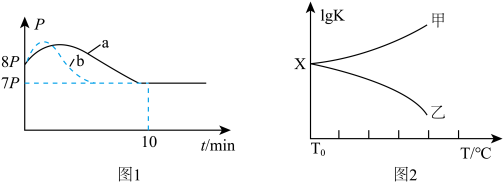
(3)①向体积为2L且带气压计的恒容密闭容器中通入2molNO和2molCO。若反应起始和平衡时温度相同(均为T0℃),测得反应过程中压强(P)随时间(t)的变化如图1曲线a所示,若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图1曲线b所示,则改变的条件是______ ,0~10min内用CO表示的平均反应速率为_______ ,该温度时反应的分压平衡常数为_______ (用p表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图2是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是________ (填“甲”或“乙”)。
Ⅱ.也可用NH3催化消除NO污染:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
(4)将1.0molNH3和1.2molNO加入某恒容密闭容器中,发生上述反应。若在相同时间内,测得NH3的转化率随温度的变化曲线如图。
①下列说法正确的是______ 。

A.若容器内混合气体的平均相对分子质量不变,则反应达到平衡状态
B.图中a、b、c点均为平衡状态
C.图中a点和c点消耗的氨气一样,所以这两点对应的速率相等
②在300℃~400℃之间NH3的转化率快速上升的原因可能有:温度升高加快了化学反应速率、_______ 。
I.汽车尾气中发生的反应有:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ•mol-1
(1)已知部分化学键的键能(如表所示)
| 化学键 | C≡O | N≡N | C=O |
| E(kJ/mol) | 1076 | 945 | 745 |
(2)有毒气体N2O、CO在Fe+催化下发生的反应是:N2O(g)+CO(g)=CO2(g)+N2(g),其反应分两步进行(如图所示),写出其中反应①的化学方程式:

(3)①向体积为2L且带气压计的恒容密闭容器中通入2molNO和2molCO。若反应起始和平衡时温度相同(均为T0℃),测得反应过程中压强(P)随时间(t)的变化如图1曲线a所示,若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图1曲线b所示,则改变的条件是
②图2是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是

Ⅱ.也可用NH3催化消除NO污染:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。(4)将1.0molNH3和1.2molNO加入某恒容密闭容器中,发生上述反应。若在相同时间内,测得NH3的转化率随温度的变化曲线如图。
①下列说法正确的是

A.若容器内混合气体的平均相对分子质量不变,则反应达到平衡状态
B.图中a、b、c点均为平衡状态
C.图中a点和c点消耗的氨气一样,所以这两点对应的速率相等
②在300℃~400℃之间NH3的转化率快速上升的原因可能有:温度升高加快了化学反应速率、
您最近一年使用:0次
【推荐2】NO、NO2是空气中的污染物,将NO、NO2转化为N2(g)是化学工作者的重要研究课题,回答下列问题:
(1)已知反应Ⅰ: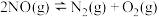 △H1=-180.5 kJ/mol
△H1=-180.5 kJ/mol
反应Ⅱ: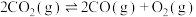 △H2=+566 kJ/mol
△H2=+566 kJ/mol
反应Ⅲ: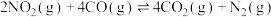 △H3=-1200 kJ/mol
△H3=-1200 kJ/mol
则反应Ⅳ: △H4=
△H4=___________ kJ/mol。
(2)已知NO和O2经反应a和反应b转化为NO2,其能量随反应进程的变化如图所示。

反应a:
 K1
K1
反应b:
 K2
K2
下列说法正确的是___________ (填标号)。
A.反应b的速率大小决定了NO2(g)的生成速率
B.2NO(g)+O2(g) 2NO2(g)的平衡常数K=K1+K2
2NO2(g)的平衡常数K=K1+K2
C.从热力学角度分析,2NO(g)+O2(g) 2NO2(g)能自发进行的原因是熵变的影响大于焓变的影响
2NO2(g)能自发进行的原因是熵变的影响大于焓变的影响
(3)已知
 。T℃时,将一定量的NO2(g)、N2O4(g)充入一个容积为2 L的恒容密闭容器中,各物质浓度随时间变化的关系如下表所示:
。T℃时,将一定量的NO2(g)、N2O4(g)充入一个容积为2 L的恒容密闭容器中,各物质浓度随时间变化的关系如下表所示:
①下列说法可以说明反应达到平衡状态的是___________ (填标号)。
A.混合气体的密度不再发生变化
B.NO2的体积分数不再发生变化
C.
D.混合气体的颜色不再发生变化
②5min时,v正(NO2)___________ (填“>”或“<”)v逆(NO2);0~10 min内,v(N2O4)___________ mol/(L·min);N2O4的平衡转化率为___________ 。
③在该温度下,K=___________ mol/L。
(1)已知反应Ⅰ:
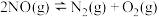 △H1=-180.5 kJ/mol
△H1=-180.5 kJ/mol 反应Ⅱ:
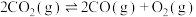 △H2=+566 kJ/mol
△H2=+566 kJ/mol 反应Ⅲ:
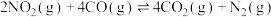 △H3=-1200 kJ/mol
△H3=-1200 kJ/mol 则反应Ⅳ:
 △H4=
△H4=(2)已知NO和O2经反应a和反应b转化为NO2,其能量随反应进程的变化如图所示。

反应a:

 K1
K1反应b:

 K2
K2下列说法正确的是
A.反应b的速率大小决定了NO2(g)的生成速率
B.2NO(g)+O2(g)
 2NO2(g)的平衡常数K=K1+K2
2NO2(g)的平衡常数K=K1+K2C.从热力学角度分析,2NO(g)+O2(g)
 2NO2(g)能自发进行的原因是熵变的影响大于焓变的影响
2NO2(g)能自发进行的原因是熵变的影响大于焓变的影响(3)已知

 。T℃时,将一定量的NO2(g)、N2O4(g)充入一个容积为2 L的恒容密闭容器中,各物质浓度随时间变化的关系如下表所示:
。T℃时,将一定量的NO2(g)、N2O4(g)充入一个容积为2 L的恒容密闭容器中,各物质浓度随时间变化的关系如下表所示:| 时间/min | 0 | 5 | 10 | 20 | 50 |
| c(NO2)/(mol/L) | 0.2 | c | 0.6 | 0.7 | 0.7 |
| c(N2O4)/(mol/L) | 0.6 | c | 0.4 | 0.35 | 0.35 |
A.混合气体的密度不再发生变化
B.NO2的体积分数不再发生变化
C.

D.混合气体的颜色不再发生变化
②5min时,v正(NO2)
③在该温度下,K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I.已知:
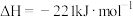 ;
;
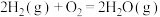
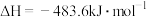 ;
;


(1)请写出一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式________ 。
Ⅱ.工业上用此反应制取氢气,生成的氢气可用来生产燃料甲醇:
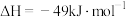 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 浓度随时间的变化如表所示:
浓度随时间的变化如表所示:
(2)H2的平衡转化率为____ 。该条件下上述反应的平衡常数K=________ 。
(3)下列情况,可判断反应达到平衡状态的是_______。
(4)下列措施中能使平衡体系中 增大且不减慢化学反应速率的是______(填字母)。
增大且不减慢化学反应速率的是______(填字母)。
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1______ (填“>”“<”或“=”)c2。
(6)要提高CO2的转化率,可以采取的措施是____ (填字母)。
A.加入催化剂 B.增大CO2的浓度
C.通入惰性气体 D.通入H2 E.分离出甲醇
(7)在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如图所示。

则催化效果最佳的是催化剂______ (填“I”“Ⅱ”或“Ⅲ”)。如果a点已经达到平衡状态,则b点的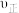
______ (填“>”“<”或“=”)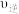 ,c点转化率比a点低的原因是
,c点转化率比a点低的原因是_______ 。
(8)甲醇不仅作燃料,还可用作燃料电池,请写出甲醇碱性燃料电池的负极电极反应式:____ 。

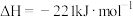 ;
;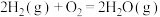
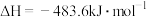 ;
;

(1)请写出一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式
Ⅱ.工业上用此反应制取氢气,生成的氢气可用来生产燃料甲醇:

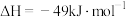 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 浓度随时间的变化如表所示:
浓度随时间的变化如表所示:| 时间/min | 0 | 3 | 5 | 10 | 15 |
浓度/( ) ) | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
(2)H2的平衡转化率为
(3)下列情况,可判断反应达到平衡状态的是_______。
| A.容器压强不再改变 | B.混合气体平均相对分子质量不再改变 |
| C.混合气体密度不再改变 | D.CO2与H2的浓度比为1:3 |
(4)下列措施中能使平衡体系中
 增大且不减慢化学反应速率的是______(填字母)。
增大且不减慢化学反应速率的是______(填字母)。| A.升高温度 | B.充入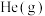 ,使体系压强增大 ,使体系压强增大 |
| C.再充入1molH2 | D.将H2O(g)从体系中分离出去 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1
(6)要提高CO2的转化率,可以采取的措施是
A.加入催化剂 B.增大CO2的浓度
C.通入惰性气体 D.通入H2 E.分离出甲醇
(7)在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如图所示。

则催化效果最佳的是催化剂
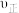
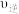 ,c点转化率比a点低的原因是
,c点转化率比a点低的原因是(8)甲醇不仅作燃料,还可用作燃料电池,请写出甲醇碱性燃料电池的负极电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物),冬季空气污染严重也跟冬季燃煤密切相关。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是______ (填字母)。
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ•mol-1
CH3OH(g)+H2O(g) △H=-a kJ•mol-1
2H2(g)+O2(g)=2H2O(g) △H=-b kJ•mol-1
H2O(g)-H2O(l) △H=-c kJ•mol-1
CH3OH(g)=CH3OH(l) △H=-d kJ•mol-1
则表示CH3OH(l)燃烧热的热化学方程式为________________________________ 。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
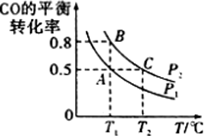
①下列说法不能判断该反应达到化学平衡状态的是______ (填字母)。
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_____ PB (填“>”、“<”或“=”)。
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____________ L。
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:
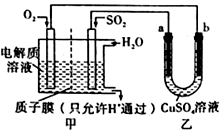
①该电池的负极反应:__________________________________ ;质于膜(只允许H通过)
②当甲中消耗2.24 LO2(标准状况)时,乙中__________ (填“a”或“b”)增重_________ g。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2
 CH3OH+H2O
CH3OH+H2O已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-a kJ•mol-1
CH3OH(g)+H2O(g) △H=-a kJ•mol-1 2H2(g)+O2(g)=2H2O(g) △H=-b kJ•mol-1
H2O(g)-H2O(l) △H=-c kJ•mol-1
CH3OH(g)=CH3OH(l) △H=-d kJ•mol-1
则表示CH3OH(l)燃烧热的热化学方程式为
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24 LO2(标准状况)时,乙中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】世界能源消费的90%以上依靠化学技术。其中清洁燃料氢气(H2)和甲醇(CH3OH)是研究的热点。
(1)工业制氢有多种渠道:
①其中一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g) △H。
已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-394kJ/mol
2C(s,石墨)+O2(g)=2CO(g) △H2=-222kJ/mol
H2(g)+ O2(g)=H2O(g) △H3=-242kJ/mol
O2(g)=H2O(g) △H3=-242kJ/mol
则△H=___ kJ/mol。

②一种“金属(M)氧化物循环制氢”的原理如图1所示。写出该流程制氢的总反应式:___ 。
③氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) △H1、O2(g)+B(l)=A(l)+H2O2(l) △H2,这两个反应均为放热反应,则H2(g)+O2(g)=H2O2(l)的△H___ 0(填“>”、“<”或“=”)。氢气可用于燃料电池,写出碱性氢氧燃料电池的负极反应式:___ 。
(2)图-2为一定条件下1molCH3OH(甲醇)与O2反应时生成CO、CO2或HCHO(甲醛)的能量变化图,反应物O2(g)和生成物H2O(g)略去。如有催化剂,CH3OH与O2反应的主反应式为:___ ;HCHO发生不完全燃烧的热化学方程式为:___ 。
(1)工业制氢有多种渠道:
①其中一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g) △H。
已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-394kJ/mol
2C(s,石墨)+O2(g)=2CO(g) △H2=-222kJ/mol
H2(g)+
 O2(g)=H2O(g) △H3=-242kJ/mol
O2(g)=H2O(g) △H3=-242kJ/mol则△H=

②一种“金属(M)氧化物循环制氢”的原理如图1所示。写出该流程制氢的总反应式:
③氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) △H1、O2(g)+B(l)=A(l)+H2O2(l) △H2,这两个反应均为放热反应,则H2(g)+O2(g)=H2O2(l)的△H
(2)图-2为一定条件下1molCH3OH(甲醇)与O2反应时生成CO、CO2或HCHO(甲醛)的能量变化图,反应物O2(g)和生成物H2O(g)略去。如有催化剂,CH3OH与O2反应的主反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
则该反应的△H=______ kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是( ) 。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______ 。下列各项能说明该反应达到平衡的是( ) 。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________ 。
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(1)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C≡O(CO) |
| 键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
(2)为了加快该反应的速率,可以进行的措施是
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】 溶液和
溶液和 溶液可发生反应:
溶液可发生反应: 。利用下图所示装置(夹持仪器略去)探究影响反应速率的因素,向A中加入一定体积
。利用下图所示装置(夹持仪器略去)探究影响反应速率的因素,向A中加入一定体积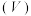 的
的 溶液、
溶液、 溶液和水,充分搅拌;控制体系温度,通过分液漏斗往A中加入醋酸;当导管口气泡均匀稳定冒出时收集气体,用秒表测量收集
溶液和水,充分搅拌;控制体系温度,通过分液漏斗往A中加入醋酸;当导管口气泡均匀稳定冒出时收集气体,用秒表测量收集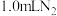 所用时间
所用时间 ,重复多次取平均值。
,重复多次取平均值。
回答下列问题:
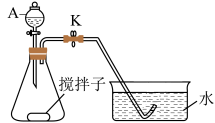
(1)仪器A的名称为_____ 。
(2)若需控制体系温度为 ,采取的合理加热方式为
,采取的合理加热方式为_____ 。
(3)探究反应速率与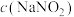 的关系,测得相关实验数据如下表所示。
的关系,测得相关实验数据如下表所示。
①
_____ mL,
_____ mL。
②该实验所得结论为_____ 。
(4)在上述实验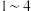 中,甲同学用数字传感器测得溶液中
中,甲同学用数字传感器测得溶液中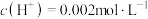 ,甲同学认为
,甲同学认为 作催化剂,增加实验5,用
作催化剂,增加实验5,用 盐酸替代醋酸,若
盐酸替代醋酸,若 ,且反应前后
,且反应前后 不变,则
不变,则
_____ mL。
(5)利用氨水可以将 和
和 吸收,其原理如图所示:
吸收,其原理如图所示:
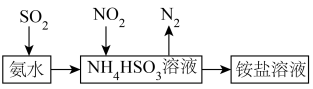
用氨水吸收 能得到含
能得到含 和
和 的吸收液,写出生成
的吸收液,写出生成 反应的离子方程式:
反应的离子方程式:_____ 。若向吸收液中通入过量 ,
, 能与
能与 发生反应生成
发生反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_____ 。
 溶液和
溶液和 溶液可发生反应:
溶液可发生反应: 。利用下图所示装置(夹持仪器略去)探究影响反应速率的因素,向A中加入一定体积
。利用下图所示装置(夹持仪器略去)探究影响反应速率的因素,向A中加入一定体积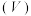 的
的 溶液、
溶液、 溶液和水,充分搅拌;控制体系温度,通过分液漏斗往A中加入醋酸;当导管口气泡均匀稳定冒出时收集气体,用秒表测量收集
溶液和水,充分搅拌;控制体系温度,通过分液漏斗往A中加入醋酸;当导管口气泡均匀稳定冒出时收集气体,用秒表测量收集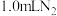 所用时间
所用时间 ,重复多次取平均值。
,重复多次取平均值。回答下列问题:

(1)仪器A的名称为
(2)若需控制体系温度为
 ,采取的合理加热方式为
,采取的合理加热方式为(3)探究反应速率与
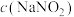 的关系,测得相关实验数据如下表所示。
的关系,测得相关实验数据如下表所示。| 实验编号 |
| 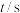 | |||
 溶液 溶液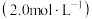 |  溶液 溶液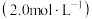 | 盐酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 33 |
| 2 | 6.0 |  |  | 6.0 | 15 |
| 3 |  | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |


②该实验所得结论为
(4)在上述实验
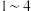 中,甲同学用数字传感器测得溶液中
中,甲同学用数字传感器测得溶液中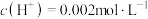 ,甲同学认为
,甲同学认为 作催化剂,增加实验5,用
作催化剂,增加实验5,用 盐酸替代醋酸,若
盐酸替代醋酸,若 ,且反应前后
,且反应前后 不变,则
不变,则
| 实验编号 | 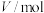 | 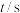 | |||
 溶液 溶液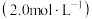 |  溶液 溶液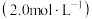 | 盐酸 | 水 | ||
| 5 | 12.0 | 4.0 |  | 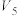 |  |
 和
和 吸收,其原理如图所示:
吸收,其原理如图所示:
用氨水吸收
 能得到含
能得到含 和
和 的吸收液,写出生成
的吸收液,写出生成 反应的离子方程式:
反应的离子方程式: ,
, 能与
能与 发生反应生成
发生反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
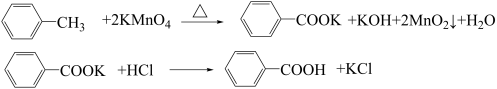
【推荐2】苯甲酸广泛应用于制药和化工行业,实验室可通过甲苯氧化制苯甲酸。反应原理:
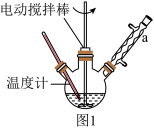
实验装置:制备装置图如图1所示。
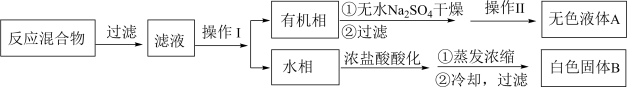
实验方法:将甲苯和KMnO4溶液加热回流一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸的相对分子质量为122,熔点为122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g:纯净固体有机物都有固定熔点。
(1)实验装置图1中仪器a的名称为_______ ,其主要作用是_______ 。
(2)操作Ⅰ为_______ ,操作Ⅱ为_______ ,无色液体A是_______ 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与_______ (填写化学式)的混合物,可通过在水中_______ 的方法进一步提纯苯甲酸。
(4)提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作_______ 。
(5)纯度测定:称取1.220g产品,配成100mL甲醇溶液,每次移取25.00mL溶液。用0.1000mol·L-1的KOH标准溶液滴定,三次滴定平均消耗23.25mL的KOH标准溶液。产品中苯甲酸质量分数为_______ (保留二位有效数字)。
(6)将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌,过滤,滤液静置一段时间,可获得有机合成常用的催化剂苯甲酸铜,混合溶剂中乙醇的作用是_______ 。

实验装置:制备装置图如图1所示。

实验方法:将甲苯和KMnO4溶液加热回流一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

已知:苯甲酸的相对分子质量为122,熔点为122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g:纯净固体有机物都有固定熔点。
(1)实验装置图1中仪器a的名称为
(2)操作Ⅰ为
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与
(4)提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作
(5)纯度测定:称取1.220g产品,配成100mL甲醇溶液,每次移取25.00mL溶液。用0.1000mol·L-1的KOH标准溶液滴定,三次滴定平均消耗23.25mL的KOH标准溶液。产品中苯甲酸质量分数为
(6)将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌,过滤,滤液静置一段时间,可获得有机合成常用的催化剂苯甲酸铜,混合溶剂中乙醇的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
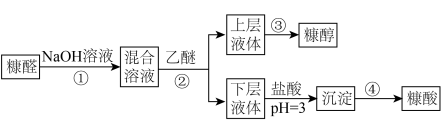
【推荐3】糠酸和糠醇均为重要的化工中间体。工业上利用糠醛发生歧化反应制取这两种物质,反应原理如下:
实验流程如下:
(1)步骤①所用装置如图,仪器a的名称为___________ 。向三颈烧瓶中加入8.2mL(约0.2mol)糠醛,缓慢滴加8mL33% 溶液,控制温度8~12℃,搅拌,回流20min,得到粘稠的黄色浆状物。该步骤中控制温度8~12℃的原因是
溶液,控制温度8~12℃,搅拌,回流20min,得到粘稠的黄色浆状物。该步骤中控制温度8~12℃的原因是___________ 。___________ 。
(3)步骤③,向醚层中加入无水碳酸钾,过滤除去碳酸钾,再蒸馏纯化得到糠醇。无水碳酸钾的作用是___________ 。蒸馏纯化时,收集170℃的馏分,因该温度高于140℃,实验室选用下图中的空气冷凝管而不用直形冷凝管的原因是___________ 。___________ ,将滤液冷却、抽滤、用冷水洗涤,干燥,得到糠酸粗品。进一步将糠酸粗品提纯的方法是___________ 。
(5)糠酸纯度的测定:
取2.240g提纯后的糠酸样品,配成250mL溶液。准确量取25.00mL于锥形瓶中,滴加2~3滴酚酞,用
 溶液(经基准物邻苯二甲酸氢钾标定)滴定,平行滴定三次,平均消耗
溶液(经基准物邻苯二甲酸氢钾标定)滴定,平行滴定三次,平均消耗 溶液21.60mL。样品中糠酸的纯度为
溶液21.60mL。样品中糠酸的纯度为___________ 。在滴定实验中, 溶液通常需要标定,原因是
溶液通常需要标定,原因是___________ 。

| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 糠醛 | 96 | -36 | 161.7 | 微溶于冷水,溶于热水、乙醚( <水) <水) |
| 糠醇 | 98 | -29 | 170 | 能与水混溶但水溶液不稳定,溶于乙醚 |
| 糠酸 | 112 | 133 | 231 | 微溶于冷水,溶于热水、乙醚 |
(1)步骤①所用装置如图,仪器a的名称为
 溶液,控制温度8~12℃,搅拌,回流20min,得到粘稠的黄色浆状物。该步骤中控制温度8~12℃的原因是
溶液,控制温度8~12℃,搅拌,回流20min,得到粘稠的黄色浆状物。该步骤中控制温度8~12℃的原因是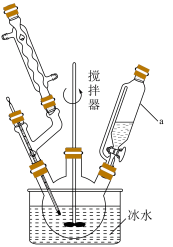
(3)步骤③,向醚层中加入无水碳酸钾,过滤除去碳酸钾,再蒸馏纯化得到糠醇。无水碳酸钾的作用是

(5)糠酸纯度的测定:
取2.240g提纯后的糠酸样品,配成250mL溶液。准确量取25.00mL于锥形瓶中,滴加2~3滴酚酞,用

 溶液(经基准物邻苯二甲酸氢钾标定)滴定,平行滴定三次,平均消耗
溶液(经基准物邻苯二甲酸氢钾标定)滴定,平行滴定三次,平均消耗 溶液21.60mL。样品中糠酸的纯度为
溶液21.60mL。样品中糠酸的纯度为 溶液通常需要标定,原因是
溶液通常需要标定,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】海带含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了如图所示实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的仪器是_________ (从下列仪器中选择所需的仪器,将标号字母填空在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________ ;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是________ 。
(3)步骤④反应的离子方程式是________ 。
(4)步骤④操作中。下列氧化剂最好选用_______ 替代MnO2 (填代号)。
A.浓硫酸 B.过氧化氢溶液 C.酸性高锰酸钾溶液 D.新制氯水
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___________ 。

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
(3)步骤④反应的离子方程式是
(4)步骤④操作中。下列氧化剂最好选用
A.浓硫酸 B.过氧化氢溶液 C.酸性高锰酸钾溶液 D.新制氯水
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法
您最近一年使用:0次
【推荐2】碘及其化合物可广泛用于医药和工业生产等。回答下列问题:
(1)实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、_______ 、_______ 及蒸馏。
(2)灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是______________ 。
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐。现要检验溶液中的I-,需选择的试剂组合及其先后顺序是_____________ 。(选填编号)
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液
(4)在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3-。
请补充完整检验含I2溶液中是否含有IO3-的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②_____________________________________________________________________ 。
(5)分解水可用SO2/I2循环法。该法共涉及三步化学反应:___________________ ;2H2SO4  2SO2↑+ O2↑+ 2H2O;
2SO2↑+ O2↑+ 2H2O;____________________ 。与传统的分解水的方法相比,本法的优点是____________ ;缺点是_____________ 。
(1)实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、
(2)灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐。现要检验溶液中的I-,需选择的试剂组合及其先后顺序是
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液
(4)在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3-。
请补充完整检验含I2溶液中是否含有IO3-的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②
(5)分解水可用SO2/I2循环法。该法共涉及三步化学反应:
 2SO2↑+ O2↑+ 2H2O;
2SO2↑+ O2↑+ 2H2O;
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
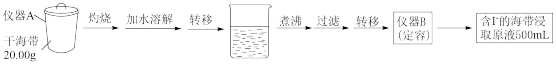
【实验一】碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
回答下列问题:
(1)实验中“灼烧”是在__ (填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__ mL,计算得海带中碘的质量百分含量为__ %。
【实验二】碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__ 作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__ 。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__ (用离子方程式表示)。

【实验一】碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在
(2)用文字具体描述“定容”过程:
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为
【实验二】碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为
(5)若要测定“I2+水溶液”中碘的含量,可以选择
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为
您最近一年使用:0次



