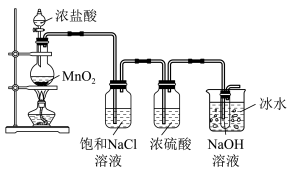
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分置省略)制备KClO3和NaClO,探究其氧化还原性质。
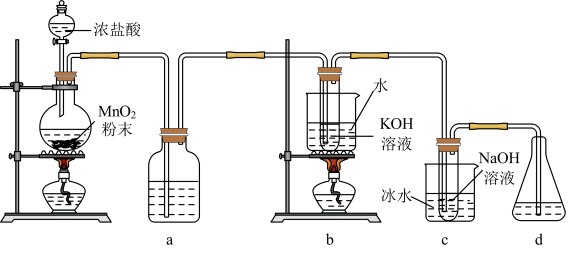
回答下列问题:
(1)制取氯气时,在圆底烧瓶里加入一定量的二氧化锰,通过___ (填写仪器名称)向烧瓶中加入适量的浓盐酸,请写出该反应的化学方程式:___ 。
(2)实验时为了除去氯气中的氯化氢气体,a装置中应加入___ (填写下列编号字母)。
(3)b中采用的加热方式是___ ,c装置用于制取NaClO,发生反应的离子方程式是___ ,采用冰水浴冷却的目的是___ 。
(4)在不同条件下KClO3可将KI氧化为I2或KClO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如表(实验在室温下进行):
①系列a实验的实验目的是___ 。
②设计1号试管实验的作用是___ 。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为:___ 。

回答下列问题:
(1)制取氯气时,在圆底烧瓶里加入一定量的二氧化锰,通过
(2)实验时为了除去氯气中的氯化氢气体,a装置中应加入
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(4)在不同条件下KClO3可将KI氧化为I2或KClO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如表(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol/LKI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol/LH2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水 | 9.0 | 6.0 | 3.0 | 0 |
②设计1号试管实验的作用是
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为:
更新时间:2021-11-15 09:15:01
|
相似题推荐
【推荐1】回答下列问题:
(1)配平并用“双线桥”表示“KMnO4 +H2C2O4+H2SO4→K2SO4 +MnSO4 +CO2↑+H2O”电子转移的方向和数目:__________________ 。
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,被还原的元素是______ ,当生成标准状况下33.6L的N2时,转移电子的数目为______ 。
(3)在肉制品加工中,使用的护色剂——亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是 。
(4)在反应2H2S + SO2 = 3S↓ + 2H2O中,氧化产物与还原产物的物质的量之比为______ 。
(5)在强酸性溶液中可发生如下反应:2Mn2++5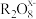 +8H2O=16H++10
+8H2O=16H++10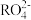 +2
+2 ,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的
,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的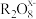 中,x的值是
中,x的值是______ 。
(1)配平并用“双线桥”表示“KMnO4 +H2C2O4+H2SO4→K2SO4 +MnSO4 +CO2↑+H2O”电子转移的方向和数目:
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,被还原的元素是
(3)在肉制品加工中,使用的护色剂——亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是 。
| A.亚硝酸钠是还原剂 | B.维生素C是氧化剂 |
| C.亚硝酸钠被还原 | D.维生素C能把铁离子还原成为亚铁离子 |
(5)在强酸性溶液中可发生如下反应:2Mn2++5
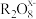 +8H2O=16H++10
+8H2O=16H++10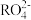 +2
+2 ,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的
,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的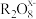 中,x的值是
中,x的值是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如图所示:
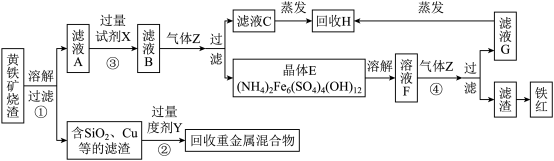
请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__ 。Fe在周期表中的位置为第___ 周期第VIII族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是___ 。过程①溶解烧渣所需试剂中溶质的化学式为___ 。反应②的化学方程式:___ 。
(3)反应③的目的是___ 。气体Z的电子式:___ 。写出反应④的离子方程式:__ 。
(4)将回收的H溶于少量水,所得溶液中所有离子的浓度由大到小依次是___ 。

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是
(3)反应③的目的是
(4)将回收的H溶于少量水,所得溶液中所有离子的浓度由大到小依次是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】短周期元素M、Q、P、X、Y在元素周期表中的位置如下表,已知 的单质通常为黄绿色气体。
的单质通常为黄绿色气体。
(1)M、Q、P、X四种元素中原子半径最小的是___________ (写元素符号);
(2)M、X、Y三种元素的最高价氧化物对应的水化物,按酸性由强到弱的顺序排列为___________ (用化学式表示)。
(3) 元素在周期表中的位置
元素在周期表中的位置___________ ,写出 的最高价氧化物的电子式
的最高价氧化物的电子式___________ ,将等物质的量的 的最简单的氢化物和
的最简单的氢化物和 的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是
的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是___________ (写分子式)。
(4) 元素的单质与水发生反应的离子方程式
元素的单质与水发生反应的离子方程式___________ 。
(5) 、
、 二种元素的氢化物在空气中相遇的现象是
二种元素的氢化物在空气中相遇的现象是___________ 。
(6)物质丁的元素组成和 的最简单的氢化物相同,丁分子具有18电子结构,向盛有一定浓度丁溶液的试管中,加入盐酸酸化的氯化亚铁溶液,发生反应的离子方程式
的最简单的氢化物相同,丁分子具有18电子结构,向盛有一定浓度丁溶液的试管中,加入盐酸酸化的氯化亚铁溶液,发生反应的离子方程式___________ 。
 的单质通常为黄绿色气体。
的单质通常为黄绿色气体。| M | Q | P | |
| X | Y |
(2)M、X、Y三种元素的最高价氧化物对应的水化物,按酸性由强到弱的顺序排列为
(3)
 元素在周期表中的位置
元素在周期表中的位置 的最高价氧化物的电子式
的最高价氧化物的电子式 的最简单的氢化物和
的最简单的氢化物和 的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是
的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是(4)
 元素的单质与水发生反应的离子方程式
元素的单质与水发生反应的离子方程式(5)
 、
、 二种元素的氢化物在空气中相遇的现象是
二种元素的氢化物在空气中相遇的现象是(6)物质丁的元素组成和
 的最简单的氢化物相同,丁分子具有18电子结构,向盛有一定浓度丁溶液的试管中,加入盐酸酸化的氯化亚铁溶液,发生反应的离子方程式
的最简单的氢化物相同,丁分子具有18电子结构,向盛有一定浓度丁溶液的试管中,加入盐酸酸化的氯化亚铁溶液,发生反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组的同学利用如图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:

Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与___ (填装置名称)连接;装置C中的烧瓶内固体宜选用___ 。
a.氯化钙 b.碱石灰 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是__ 。
(3)装置F可用于探究氯气与氨气的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入___ (填名称),然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子___ ,F的烧杯中所装液体为__ ,所起的作用是__ 。
Ⅱ.探究某些物质的性质
(1)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱。将装置A中产生的气体通入盛有NaBr溶液的装置E中,充分反应后取下E,加入CCl4,静置后观察到____ 的实验现象,则证明Br-的还原性强于Cl-。
(2)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。简述检查装置B气密性的操作____ ,F的烧瓶中发生反应的化学方程式为____ 。

Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与
a.氯化钙 b.碱石灰 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是
(3)装置F可用于探究氯气与氨气的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入
Ⅱ.探究某些物质的性质
(1)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱。将装置A中产生的气体通入盛有NaBr溶液的装置E中,充分反应后取下E,加入CCl4,静置后观察到
(2)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。简述检查装置B气密性的操作
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某实验小组利用硫渣(主要成分为Sn,含少量CuS、Pb等)与氯气反应制备四氯化锡,其过程如图所示(夹持、加热及控温装置略)。
相关产物的熔沸点:
(1)仪器b的名称___________ ,为了使浓盐酸顺利滴入烧瓶中,可以将仪器a更换为___________ ,A中盛装试剂为二氧化锰时发生反应的化学方程式为___________ 。
(2)整套装置的连接顺序___________ 。(填写仪器下方字母)
(3)碱石灰的作用为___________ 。
(4)实验结束后,得到粗产品中常溶有少量SnCl2杂质,可用___________ 方法提纯。
(5)产品中含少量SnCl2,测定SnCl4纯度的方法:取2.00g产品溶于50.00mL的稀盐酸中,加入___________ 溶液作指示剂。用0.0100 mol/LKIO3标准溶液滴定至终点,消耗KIO3标准液20.00mL,反应原理为3SnCl2+KIO3+6HCl=3SnCl4+KI+3H2O, +5I-+6H+=3I2+3H2O,判断滴定终点的依据为
+5I-+6H+=3I2+3H2O,判断滴定终点的依据为___________ ,产品的纯度为___________ 。

相关产物的熔沸点:
| 物质性质 | SnCl4 | SnCl2 | CuCl2 | PbCl2 | S |
| 熔点/℃ | -33 | 247 | 426 | 501 | 112 |
| 沸点/℃ | 114 | 623 | 1490 | 950 | 444 |
(1)仪器b的名称
(2)整套装置的连接顺序
(3)碱石灰的作用为
(4)实验结束后,得到粗产品中常溶有少量SnCl2杂质,可用
(5)产品中含少量SnCl2,测定SnCl4纯度的方法:取2.00g产品溶于50.00mL的稀盐酸中,加入
 +5I-+6H+=3I2+3H2O,判断滴定终点的依据为
+5I-+6H+=3I2+3H2O,判断滴定终点的依据为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+C12+SCl2=2SOCl2,部分装置如图所示,回答以下问题:

(1)实验室制取SOCl2在三颈烧瓶中合成,整个装置所选仪器的连接顺序是: ⑥→___ →①②← ___ (用“→”或“←”连接各接口,箭头表示气体流向,某些仪器可以多次使用)。
(2)冷凝管上连接的干燥管的作用是:①吸收逸出的Cl2、SO2防污染 ②____ 。
(3)该实验制取氯气的离子方程式为___
(4)SOCl2与水反应的化学方程式为___ 。
(5)已知SCl2的沸点为50℃。实验结束后,将三颈烧瓶中混合物分离开的实验操作名称是__ 。若反应中消耗的C12的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 6.76g,则SOCl2的产率为__ (保留二位有效数字)

(1)实验室制取SOCl2在三颈烧瓶中合成,整个装置所选仪器的连接顺序是: ⑥→
(2)冷凝管上连接的干燥管的作用是:①吸收逸出的Cl2、SO2防污染 ②
(3)该实验制取氯气的离子方程式为
(4)SOCl2与水反应的化学方程式为
(5)已知SCl2的沸点为50℃。实验结束后,将三颈烧瓶中混合物分离开的实验操作名称是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和 ,制备装置如图所示(部分加持仪器略去),并研究
,制备装置如图所示(部分加持仪器略去),并研究 的氧化性。已知:氯气与碱反应,温度较高时生成
的氧化性。已知:氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。

(1)盛装浓盐酸的仪器名称是_______ 。
(2)装置A烧瓶中反应的化学方程式为_______ 。
(3)装置C中 与试剂a反应的离子方程式为
与试剂a反应的离子方程式为_______ 。
(4)如果缺少装置B,对制取NaClO和 的影响是
的影响是_______ 。
(5)E中可选用试剂有_______ (填标号)。
A.饱和 溶液 B.浓
溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
C.饱和NaCl溶液 D.NaOH溶液
(6)该小组在探究 氧化性时,发现
氧化性时,发现 与
与 的反应速率先增大后减小,反应为
的反应速率先增大后减小,反应为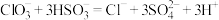 。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究
。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究 对化学反应速率的影响,设计如下实验:
对化学反应速率的影响,设计如下实验:
该实验_______ (填“能”或“不能”)达到实验目的,理由是_______ 。
 ,制备装置如图所示(部分加持仪器略去),并研究
,制备装置如图所示(部分加持仪器略去),并研究 的氧化性。已知:氯气与碱反应,温度较高时生成
的氧化性。已知:氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。
(1)盛装浓盐酸的仪器名称是
(2)装置A烧瓶中反应的化学方程式为
(3)装置C中
 与试剂a反应的离子方程式为
与试剂a反应的离子方程式为(4)如果缺少装置B,对制取NaClO和
 的影响是
的影响是(5)E中可选用试剂有
A.饱和
 溶液 B.浓
溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
C.饱和NaCl溶液 D.NaOH溶液(6)该小组在探究
 氧化性时,发现
氧化性时,发现 与
与 的反应速率先增大后减小,反应为
的反应速率先增大后减小,反应为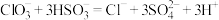 。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究
。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究 对化学反应速率的影响,设计如下实验:
对化学反应速率的影响,设计如下实验:| 实验序号 | 温度 |  | 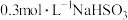 |  盐酸 盐酸 |  |
| ① | 25℃ | 10mL | 10mL | 0mL | 1mL |
| ② | 25℃ | 10mL | 10mL | 1mL | 0mL |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.某实验室需要配制500 mL0.10 mol/LNa2CO3溶液。
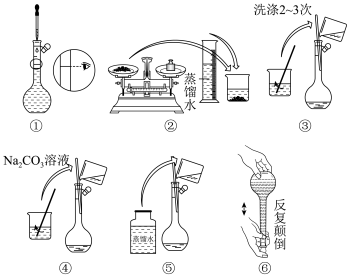
(1)所需玻璃仪器有:玻璃棒、烧杯、量筒、___________ 、 ___________ 。
(2)实验时图中所示操作的先后顺序为___________ (填编号)。
(3)在配制过程中,下列操作对所配溶液浓度如何?(填“偏高”、“偏低”或“无影响”)
①向容量瓶加水定容时俯视液面___________
②摇匀后液面下降,再加水至刻度线___________
(4)所需Na2CO3固体的质量为___________ g;若改用浓溶液稀释。需要量取2mol/LNa2CO3溶液___________ mL。
II.某研究小组制备消毒液(主要成分为NaClO)设计了图示装置
在阅资料得知;在加热情况下卤素单质和碱液发生反应:3X2+6OH- 5X + XO3+3H2O
5X + XO3+3H2O
回答下列问题:
(5)烧瓶中发生反应的化学方程式为___________ 。
(6)装置中饱和NaCl溶液的作用是___________ 。
(7)装置中能不能省去盛冰水的烧杯?___________ (填“ 能”或“不能”)。理由是___________ 。
(8)装置中的试管内发生反应的离子方程式为___________ 。

(1)所需玻璃仪器有:玻璃棒、烧杯、量筒、
(2)实验时图中所示操作的先后顺序为
(3)在配制过程中,下列操作对所配溶液浓度如何?(填“偏高”、“偏低”或“无影响”)
①向容量瓶加水定容时俯视液面
②摇匀后液面下降,再加水至刻度线
(4)所需Na2CO3固体的质量为
II.某研究小组制备消毒液(主要成分为NaClO)设计了图示装置

在阅资料得知;在加热情况下卤素单质和碱液发生反应:3X2+6OH-
 5X + XO3+3H2O
5X + XO3+3H2O回答下列问题:
(5)烧瓶中发生反应的化学方程式为
(6)装置中饱和NaCl溶液的作用是
(7)装置中能不能省去盛冰水的烧杯?
(8)装置中的试管内发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z三种气体都是大气污染物,在工业上通常都用碱溶液吸。已知X是造成酸雨的主要物质;Y是一种单质,其水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,易溶于水。
(1)写出X、Y、Z的化学式: X_______ ; Y _______ ; Z _______ 。
(2)X能使湿润的红布条褪色,通过_______ 方法能使布条颜色复原。
(3)写出下列有关反应的化学方程式:
X在一定条件下与氧气反应_______ 。
Y与NaOH溶液反应_______ 。
Z与水反应_______ 。
(1)写出X、Y、Z的化学式: X
(2)X能使湿润的红布条褪色,通过
(3)写出下列有关反应的化学方程式:
X在一定条件下与氧气反应
Y与NaOH溶液反应
Z与水反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】为探究铜与稀硝酸反应的气体产物及亚硝酸对其反应速率的影响,进行如下实验。
实验一 探究铜与稀硝酸反应的气体产物实验装置如图所示,气密性已检查。

已知: ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是___________ 。
(2)若装置 A中有 NO2气体生成,则装置 B中的实验现象为___________ 。
(3)若装置A中铜与稀硝酸反应只生成 NO气体,写出该反应的离子方程式___________ ,装置B中的实验现象为___________ 。
实验二 实验一的过程中发现铜与稀硝酸反应比较慢,A中产生无色气体。查阅文献得知铜与浓 HNO3反应一旦发生就变快,是因为开始生成的 NO2溶于水形成 HNO2(弱酸,不稳定),使反应加快。为了探究 HNO2对铜与稀硝酸反应速率的影响,采用实验一的实验装置和操作,设计了如下实验。
(4)已知NO2与 H2O反应生成 HNO2和另一种常见的强酸,写出其反应的化学方程式___________ 。
(5)上述实验②中加入1.0g NaNO2固体的作用是___________ 。
(6)实验测得 t1>t2,可得出的结论是___________ 。
实验一 探究铜与稀硝酸反应的气体产物实验装置如图所示,气密性已检查。

已知:
 ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
(2)若装置 A中有 NO2气体生成,则装置 B中的实验现象为
(3)若装置A中铜与稀硝酸反应只生成 NO气体,写出该反应的离子方程式
实验二 实验一的过程中发现铜与稀硝酸反应比较慢,A中产生无色气体。查阅文献得知铜与浓 HNO3反应一旦发生就变快,是因为开始生成的 NO2溶于水形成 HNO2(弱酸,不稳定),使反应加快。为了探究 HNO2对铜与稀硝酸反应速率的影响,采用实验一的实验装置和操作,设计了如下实验。
| 实验序号 | 温度(℃) | 6mol/L硝酸(mL) | 铜片(g) | NaNO2(g) | B中溶液变色的时间(s) |
| ① | 25 | 20 | 5 | 0 | t1 |
| ② | 25 | 20 | 5 | 1.0 | t2 |
(5)上述实验②中加入1.0g NaNO2固体的作用是
(6)实验测得 t1>t2,可得出的结论是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
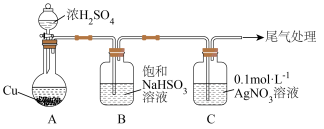
【推荐2】将足量 通入
通入 溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热、夹持等装置略)。
溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热、夹持等装置略)。
资料:ⅰ. 微溶于水;
微溶于水; 难溶于水。
难溶于水。
ⅱ.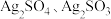 均溶于氮水。
均溶于氮水。
(1)①A中反应的化学方程式:_______ 。
②盛装浓硫酸的仪器名称:_______ 。
③饱和 溶液显酸性,用化学平衡原理解释:
溶液显酸性,用化学平衡原理解释:_______ 。
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
推测白色沉淀 可能为
可能为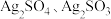 或二者混合物。探究如下:
或二者混合物。探究如下:

实验证实,白色沉淀 中不含
中不含 ,含
,含 。
。
①试剂 是
是_______ 。
②产生白色沉淀 的原因是
的原因是_______ 。
(3)推测灰黑色沉淀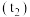 含
含 。探究如下:取灰黑色沉淀,加入足量氨水,部分沉淀溶解,过滤。
。探究如下:取灰黑色沉淀,加入足量氨水,部分沉淀溶解,过滤。_______ (填写操作及试剂),现象是_______ ,证实沉淀含 。
。
(4)通过检测 探究产生
探究产生 的原因。
的原因。
实验: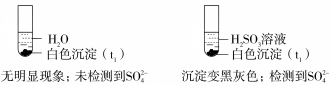 (已排除
(已排除 的影响)
的影响)
① 时,C中
时,C中 的作用是
的作用是_______ 。(用化学方程式表示)
② 时,
时, 中产生白色沉淀的离子方程式是
中产生白色沉淀的离子方程式是_______ 。
综上可知,化学反应的产物与反应速率和限度有关。
 通入
通入 溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热、夹持等装置略)。
溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热、夹持等装置略)。资料:ⅰ.
 微溶于水;
微溶于水; 难溶于水。
难溶于水。ⅱ.
 均溶于氮水。
均溶于氮水。
(1)①A中反应的化学方程式:
②盛装浓硫酸的仪器名称:
③饱和
 溶液显酸性,用化学平衡原理解释:
溶液显酸性,用化学平衡原理解释:(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
| 时间 | 反应开始时 | 一段时间后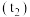 | 较长时间后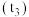 |
| 颜色 | 白色 | 灰黑色 | 灰黑色加深 |
 可能为
可能为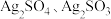 或二者混合物。探究如下:
或二者混合物。探究如下:
实验证实,白色沉淀
 中不含
中不含 ,含
,含 。
。①试剂
 是
是②产生白色沉淀
 的原因是
的原因是(3)推测灰黑色沉淀
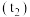 含
含 。探究如下:取灰黑色沉淀,加入足量氨水,部分沉淀溶解,过滤。
。探究如下:取灰黑色沉淀,加入足量氨水,部分沉淀溶解,过滤。 。
。(4)通过检测
 探究产生
探究产生 的原因。
的原因。实验:
 (已排除
(已排除 的影响)
的影响)①
 时,C中
时,C中 的作用是
的作用是②
 时,
时, 中产生白色沉淀的离子方程式是
中产生白色沉淀的离子方程式是综上可知,化学反应的产物与反应速率和限度有关。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】南宁二中“启天化学社”设计如下实验方案制备SO2 (装置图如下),并利用高中所学化学知识探究含硫化合物的相关性质。请回答下列问题:

(1)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是_______ ;加热前,圆底烧瓶中无需加入沸石,其原因是_______ 。
(2)实验室通常使用亚硫酸钠固体与70%硫酸溶液反应制备SO2,此方法与用浓硫酸与铜反应制备SO2相比,优点是:①_______ ,②_______ 。
(3)装置B的作用是_______ ,装置D的作用(请用化学方程式表示)_______ 。
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有二种可能的情况:
I.NaHSO4与NaClO恰好完全反应,此时反应的离子方程式为_______ ;
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
(已知: H2SO3;Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)

(1)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是
(2)实验室通常使用亚硫酸钠固体与70%硫酸溶液反应制备SO2,此方法与用浓硫酸与铜反应制备SO2相比,优点是:①
(3)装置B的作用是
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有二种可能的情况:
I.NaHSO4与NaClO恰好完全反应,此时反应的离子方程式为
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
(已知: H2SO3;Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加入少量CaCO3粉末 | I或II | |
| ② | 滴加少量淀粉-KI溶液,振荡 | 溶液先变蓝后褪色 | |
| ③ | II |
您最近一年使用:0次



