载人航天器中,可将航天员呼出的CO2转化为 H2O,再通过电解 H2O 获得 O2,实现 O2的再 生,同时还能制备 CH4.已知:
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H =571.6kJ/mol
请回答下列问题:
(1)反应①属于_______ (填“吸热”或“放热”)反应。
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H =_______ kJ/mol。
(3)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
①已知2CH4(g)=C2H4(g)+2H2(g) ΔH =+167kJ/mol,则a=_______ 。
②已知5C2H4(g)+12 (aq)+36H+ (aq)=12Mn2+ (aq)+10CO2 (g)+28H2O(l) ΔH =-m kJ·mol-1,当放出的热量为n kJ时,该反应转移电子的物质的量为
(aq)+36H+ (aq)=12Mn2+ (aq)+10CO2 (g)+28H2O(l) ΔH =-m kJ·mol-1,当放出的热量为n kJ时,该反应转移电子的物质的量为_______ mol。(用含m、n 的代数式表示)
③制备合成气反应历程分两步,步骤Ⅰ:CH4(g)⇌ C(ads)+2H2(g);步骤Ⅱ:C(ads)+ CO2(g)⇌ 2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图
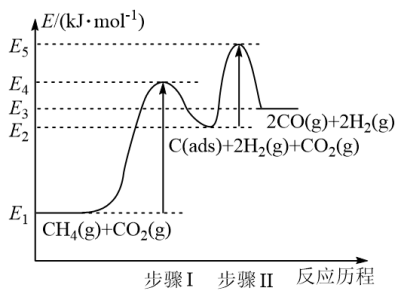
E4-E1表示步骤Ⅰ正反应的_______ ,制备合成气反应可在_______ (填“高温” 或“低温”)下自发进行。
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H =571.6kJ/mol
请回答下列问题:
(1)反应①属于
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H =
(3)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
②已知5C2H4(g)+12
 (aq)+36H+ (aq)=12Mn2+ (aq)+10CO2 (g)+28H2O(l) ΔH =-m kJ·mol-1,当放出的热量为n kJ时,该反应转移电子的物质的量为
(aq)+36H+ (aq)=12Mn2+ (aq)+10CO2 (g)+28H2O(l) ΔH =-m kJ·mol-1,当放出的热量为n kJ时,该反应转移电子的物质的量为③制备合成气反应历程分两步,步骤Ⅰ:CH4(g)⇌ C(ads)+2H2(g);步骤Ⅱ:C(ads)+ CO2(g)⇌ 2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图

E4-E1表示步骤Ⅰ正反应的
更新时间:2021-12-06 23:05:20
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
Ⅰ.完成下列问题
(1)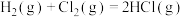 的反应过程如图所示:
的反应过程如图所示:___________ (填“放热”或“吸热”)反应,其吸收或放出的热量为___________ 。
(2)下列变化中属于吸热反应的是___________ (填序号)。
①液态水汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④生石灰与水反应生成熟石灰
⑤ ⑥
⑥ 与固体
与固体 混合
混合
⑦ ⑧Al与盐酸反应
⑧Al与盐酸反应
(3)某化学反应中,设反应物的总能量为 ,生成物的总能量为
,生成物的总能量为 。若
。若 ,则该反应可用图(填“A”或“B”)
,则该反应可用图(填“A”或“B”)___________ 表示。
(4)为了验证 与
与 的氧化性强弱,如图装置能达到实验目的的是
的氧化性强弱,如图装置能达到实验目的的是___________ (填装置序号),其正极的电极反应式为___________ ;若构建该原电池时两个电极的质量相等,当导线中通过0.4mol电子时,两个电极的质量差为___________ g。 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得 定向移向A电极,则
定向移向A电极,则___________ (填“A”或“B”)处电极入口通 。
。
Ⅰ.完成下列问题
(1)
 的反应过程如图所示:
的反应过程如图所示:
(2)下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④生石灰与水反应生成熟石灰
⑤
 ⑥
⑥ 与固体
与固体 混合
混合⑦
 ⑧Al与盐酸反应
⑧Al与盐酸反应(3)某化学反应中,设反应物的总能量为
 ,生成物的总能量为
,生成物的总能量为 。若
。若 ,则该反应可用图(填“A”或“B”)
,则该反应可用图(填“A”或“B”)
(4)为了验证
 与
与 的氧化性强弱,如图装置能达到实验目的的是
的氧化性强弱,如图装置能达到实验目的的是
 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得 定向移向A电极,则
定向移向A电极,则 。
。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________ (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:H2(g)+Cl2(g)=2HCl(g) △H= ___________ kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+ O2(g)=Na2O(s) △H=-414 kJ·mol-1
O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
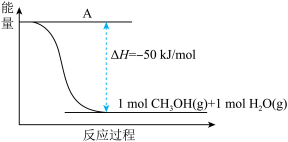
①补全上图:图中A处应填入___________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H___________ (填“变大”“变小”或“不变” )。
)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
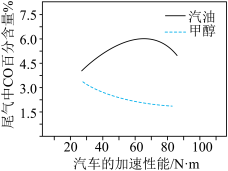
据图信息分析,与汽油相比,甲醇作为燃料的优点是___________ 。
(1)下列反应中,属于吸热反应的是
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 | H-H | Cl-Cl | H-Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+
 O2(g)=Na2O(s) △H=-414 kJ·mol-1
O2(g)=Na2O(s) △H=-414 kJ·mol-1II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H
 )。
)。③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

据图信息分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:________ 。烧杯间填满碎泡沫塑料的作用是________ 。大烧杯上如不盖硬纸板,求得的中和热数值________ ,(填“偏大”“偏小”“无影响”下同),用50mL浓硫酸代替盐酸溶液进行上述实验,测得的中和热的数值会________ 。
(2)向盛装稀盐酸的烧杯中加入NaOH溶液的正确操作是________ 。
A.沿玻璃棒缓慢加入 B.一次性迅速加入 C.分三次加入
(3)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量________ (填“相等”、“不相等”),所求中和热________ 。(填“相等”、“不相等”)
(4)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是________ (填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌 b. 高温煅烧石灰石 c. 铝与盐酸反应

(2)向盛装稀盐酸的烧杯中加入NaOH溶液的正确操作是
A.沿玻璃棒缓慢加入 B.一次性迅速加入 C.分三次加入
(3)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(4)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是
a. Ba(OH)2·8H2O与NH4Cl混合搅拌 b. 高温煅烧石灰石 c. 铝与盐酸反应
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】化学反应与能量变化是化学家研究的永恒话题。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把___ 能转化为___ 能的装置。
II.水煤气变换[CO(g)+H2O(g) CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
(2)在800℃、2L密闭容器中,若充入3molCO和2mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成1.2molCO2,则该反应的速率v(CO)为___ 。
(3)Shibata曾做过下列实验:721℃下,分别用氢气和一氧化碳还原氧化钴(CoO),反应如下。
i.H2(g)+CoO(s) Co(s)+H2O(g) △H1
Co(s)+H2O(g) △H1
ii.CO(g)+CoO(s) Co(s)+CO2(g) △H2
Co(s)+CO2(g) △H2
①反应CO(g)+H2O(g) CO2(g)+H2(g)△H=
CO2(g)+H2(g)△H=___ (用△H1、△H2表示)。
②一氧化碳和水蒸气的反应历程如图,下列说法正确的是___ 。
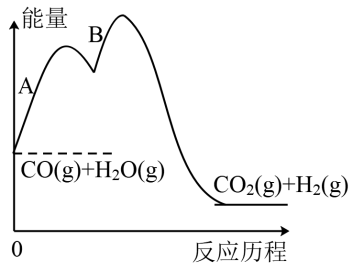
a.该反应放热
b.反应B活化能大于反应A
c.使用催化剂降低反应的△H,反应速率加快
d.该反应经过两步基元反应完成
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把
II.水煤气变换[CO(g)+H2O(g)
 CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。(2)在800℃、2L密闭容器中,若充入3molCO和2mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成1.2molCO2,则该反应的速率v(CO)为
(3)Shibata曾做过下列实验:721℃下,分别用氢气和一氧化碳还原氧化钴(CoO),反应如下。
i.H2(g)+CoO(s)
 Co(s)+H2O(g) △H1
Co(s)+H2O(g) △H1ii.CO(g)+CoO(s)
 Co(s)+CO2(g) △H2
Co(s)+CO2(g) △H2①反应CO(g)+H2O(g)
 CO2(g)+H2(g)△H=
CO2(g)+H2(g)△H=②一氧化碳和水蒸气的反应历程如图,下列说法正确的是

a.该反应放热
b.反应B活化能大于反应A
c.使用催化剂降低反应的△H,反应速率加快
d.该反应经过两步基元反应完成
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加入上述耐压容器中,加热并搅拌,达到60℃恒温时,通入CO至一定压强,开始反应后记录容器内压强随时间的变化,直到压强不再变化后,冷却,泄压,取出反应物,抽滤、烘干并称量。其反应如下:
I:CO(g)+H2O(l)⇌HCOOH(aq) K1 ΔH1
II:HCOOH(aq)+NaOH(aq)⇌HCOONa(s)+H2O(l) K2 ΔH2
III:CO(g)+NaOH(aq)⇌HCOONa(s) K ΔH
回答下列问题:
(1)K=______ (用含K1、K2的代数式表示),ΔH=_____ (用含ΔH1、ΔH2的代数式表示)。
(2)若需加快反应III的速率,下列措施可行的是______ (填字母)。
A.增大CO的初始压强 B.适当升高温度 C.减少乙醇浓度 D.降低搅拌转速
(3)CO的压强转化率可以反映羧基化进程。CO的压强转化率可以表示为X(CO)=(1-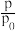 )×100%,p0为CO初始压强,p为CO某时刻分压。HCOONa产率可表示为Y(HCOONa)=
)×100%,p0为CO初始压强,p为CO某时刻分压。HCOONa产率可表示为Y(HCOONa)= ×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成的HCOONa的物质的量。投料比r=
×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成的HCOONa的物质的量。投料比r= ,n0(CO)表示投料CO的物质的量,保持60℃恒温,以投料比r=0.7时,CO初始压强分别为0.5MPa、1.5MPa和2.0MPa,测得X(CO)与时间t的关系如下图所示。
,n0(CO)表示投料CO的物质的量,保持60℃恒温,以投料比r=0.7时,CO初始压强分别为0.5MPa、1.5MPa和2.0MPa,测得X(CO)与时间t的关系如下图所示。

①上图中表示2.0MPa的曲线为_________ (填字母)。
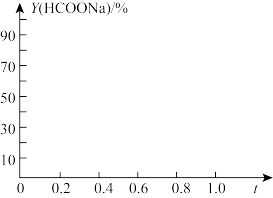
②若1.5MPa时,Y(HCOONa)=87%,则NaOH的转化率为____ 。当CO的初始压强为1.5MPa,保持60℃恒温,不计HCOONa在乙醇中的溶解。在下图中画出Y(HCOONa)与r的关系示意图_____ 。
I:CO(g)+H2O(l)⇌HCOOH(aq) K1 ΔH1
II:HCOOH(aq)+NaOH(aq)⇌HCOONa(s)+H2O(l) K2 ΔH2
III:CO(g)+NaOH(aq)⇌HCOONa(s) K ΔH
回答下列问题:
(1)K=
(2)若需加快反应III的速率,下列措施可行的是
A.增大CO的初始压强 B.适当升高温度 C.减少乙醇浓度 D.降低搅拌转速
(3)CO的压强转化率可以反映羧基化进程。CO的压强转化率可以表示为X(CO)=(1-
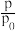 )×100%,p0为CO初始压强,p为CO某时刻分压。HCOONa产率可表示为Y(HCOONa)=
)×100%,p0为CO初始压强,p为CO某时刻分压。HCOONa产率可表示为Y(HCOONa)= ×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成的HCOONa的物质的量。投料比r=
×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成的HCOONa的物质的量。投料比r= ,n0(CO)表示投料CO的物质的量,保持60℃恒温,以投料比r=0.7时,CO初始压强分别为0.5MPa、1.5MPa和2.0MPa,测得X(CO)与时间t的关系如下图所示。
,n0(CO)表示投料CO的物质的量,保持60℃恒温,以投料比r=0.7时,CO初始压强分别为0.5MPa、1.5MPa和2.0MPa,测得X(CO)与时间t的关系如下图所示。
①上图中表示2.0MPa的曲线为
②若1.5MPa时,Y(HCOONa)=87%,则NaOH的转化率为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】将CO2还原成甲烷,是实现CO2资源化利用的有效途径之一。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
ⅰ.CO2(g) + 4H2(g) CH4(g) + 2H2O(g) ΔH1
CH4(g) + 2H2O(g) ΔH1
ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
ⅲ.CO(g) + 3H2(g) CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
……
(1)ΔH1=______ kJ∙mol−1。
(2)不同条件下,按照n(CO2):n(H2)=1:4投料,CO2的平衡转化率如图所示。


①压强p1、p2、p3由大到小的顺序是______ 。
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因______ 。
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如上图所示。
(3)阴极的电极反应式是______ 。
(4)若生成1 mol CH4,理论上阳极室生成CO2的体积是______ L(标准状况,忽略气体的溶解)。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
ⅰ.CO2(g) + 4H2(g)
 CH4(g) + 2H2O(g) ΔH1
CH4(g) + 2H2O(g) ΔH1ⅱ.CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1ⅲ.CO(g) + 3H2(g)
 CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1……
(1)ΔH1=
(2)不同条件下,按照n(CO2):n(H2)=1:4投料,CO2的平衡转化率如图所示。


①压强p1、p2、p3由大到小的顺序是
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如上图所示。
(3)阴极的电极反应式是
(4)若生成1 mol CH4,理论上阳极室生成CO2的体积是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】如图,已知某反应在体积为5L的密闭容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为_______ 。
(2)反应开始至两分钟时,B的平均反应速率为_______ 。
(3)下列能说明反应已达到平衡状态的是_______。
(4)已知: 的键能为
的键能为 ,
, 的键能为
的键能为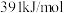 ,生成
,生成
 过程中放出
过程中放出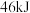 的热量。则
的热量。则 的键能为
的键能为_______  。
。

(1)该反应的化学方程式为
(2)反应开始至两分钟时,B的平均反应速率为
(3)下列能说明反应已达到平衡状态的是_______。
A.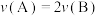 |
| B.容器内气体密度不变 |
| C.各组分的物质的量相等 |
| D.混合气体的平均相对分子质量不再改变 |
 的键能为
的键能为 ,
, 的键能为
的键能为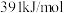 ,生成
,生成
 过程中放出
过程中放出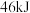 的热量。则
的热量。则 的键能为
的键能为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】工业合成氨反应 是人工固氮研究的重要领域,请回答下列问题:
是人工固氮研究的重要领域,请回答下列问题:
(1)已知相关化学键的键能(常温常压下,断裂或形成 化学键需要吸收或放出的能量)数据如表所示:
化学键需要吸收或放出的能量)数据如表所示:
在工业合成氨反应中,每形成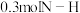 键,反应放出
键,反应放出 能量,则每生成
能量,则每生成
 ,反应放出
,反应放出_______  能量,a=
能量,a=_______ 。
(2)将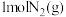 和
和 充入
充入 恒容密闭容器中,发生合成氨反应,在不同温度下,
恒容密闭容器中,发生合成氨反应,在不同温度下, 的体积分数随时间的变化曲线如图1所示。
的体积分数随时间的变化曲线如图1所示。_______ (填标号)。
A.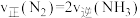
B.容器内压强不再发生变化
C.氮气的体积分数不再发生变化
D.容器内, 与
与 的原子个数之比为1:3
的原子个数之比为1:3
②
_______ (填“>”或“<”) ;
; 点时,
点时, 的转化率
的转化率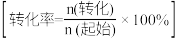 为
为_______ (保留三位有效数字); 点时,
点时,
_______  。
。
(3)将工业合成氨反应设计为原电池,装置如图2所示。 为
为_______ (填化学式),正极发生的电极反应为_______ 。
 是人工固氮研究的重要领域,请回答下列问题:
是人工固氮研究的重要领域,请回答下列问题:(1)已知相关化学键的键能(常温常压下,断裂或形成
 化学键需要吸收或放出的能量)数据如表所示:
化学键需要吸收或放出的能量)数据如表所示:| 化学键 |  | N-H | H-H |
键能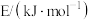 | a | 391 | 436 |
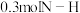 键,反应放出
键,反应放出 能量,则每生成
能量,则每生成
 ,反应放出
,反应放出 能量,a=
能量,a=(2)将
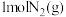 和
和 充入
充入 恒容密闭容器中,发生合成氨反应,在不同温度下,
恒容密闭容器中,发生合成氨反应,在不同温度下, 的体积分数随时间的变化曲线如图1所示。
的体积分数随时间的变化曲线如图1所示。
A.
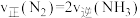
B.容器内压强不再发生变化
C.氮气的体积分数不再发生变化
D.容器内,
 与
与 的原子个数之比为1:3
的原子个数之比为1:3②

 ;
; 点时,
点时, 的转化率
的转化率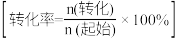 为
为 点时,
点时,
 。
。(3)将工业合成氨反应设计为原电池,装置如图2所示。
 为
为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】Ⅰ.CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是_____ (填字母)。

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,4min内平均反应速率v(H2)=_____ ,则CH3OH的转化率为______ 。
(3)已知断开1molH-H键吸收的能量为436kJ,形成1molH-N键放出的能量为391kJ,根据化学方程式N2+3H2=2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键需吸收的能量是_____ kJ。
Ⅱ.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。
xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。
(4)x=______ 。
(5)A在5min末的浓度是______ 。
(6)此时容器内的压强与开始时之比为______ 。
(1)已知CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,4min内平均反应速率v(H2)=
(3)已知断开1molH-H键吸收的能量为436kJ,形成1molH-N键放出的能量为391kJ,根据化学方程式N2+3H2=2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键需吸收的能量是
Ⅱ.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。
xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。(4)x=
(5)A在5min末的浓度是
(6)此时容器内的压强与开始时之比为
您最近一年使用:0次



