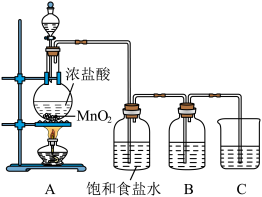
随着新型冠状病毒感染的肺炎确诊病例越来越多,消毒已成了人们关注的话题。前不久李兰娟院士说过新冠病毒的几个弱点,比如含氯的消毒剂就可以有效的灭活病毒。某校化学兴趣小组为制备并收集氯气,设计下图装置,装置中的夹持装置和加热装置均已略去。
回答下列问题:
(1)写出盛放浓盐酸的仪器名称_______ ,回形玻璃管的作用是_______ 。
(2)写出装置A中发生反应的化学方程式_______ 。
(3)装置C的作用是_______ 。
(4)E装置中导管_______ (填“x”或“y”)应伸至靠近集气瓶底部。
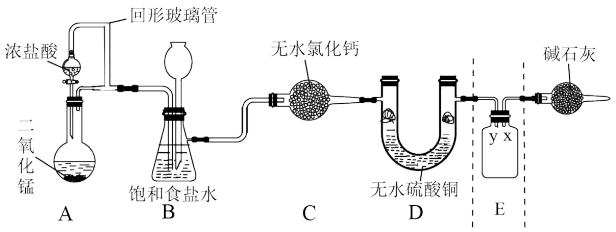
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
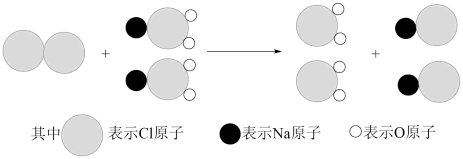
该反应的化学方程式_______ 。
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:_______ 。

回答下列问题:
(1)写出盛放浓盐酸的仪器名称
(2)写出装置A中发生反应的化学方程式
(3)装置C的作用是
(4)E装置中导管
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:
更新时间:2021-12-30 09:22:40
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】硼镁泥是硼镁矿(2MgO·B2O3)生产硼砂(Na2B4O7·10H2O)时的废渣,其主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、B2O3、Al2O3、MnO等)。硼镁泥制取七水硫酸镁的工艺流程如下:
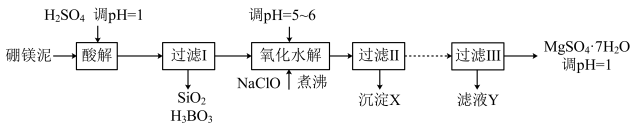
部分阳离子以氢氧化物形式完全沉淀时溶液的pH
(1)将硼镁矿粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。试写出反应方程式_________ 。
(2)已知硼酸(H3BO3)结构和性质与Al(OH)3相似,则硼酸与NaOH溶液反应的化学方程式为________ 。
(3)沉淀X中除了有Al(OH)3、Fe(OH)3外,还含有二氧化锰,用离子方程式解释原因为_________ 。
(4)过滤Ⅱ和过滤Ⅲ之间省略的操作步骤为__________ 。滤液Y中阴离子除了SO 外主要还含有
外主要还含有_______ ,其检验试剂为__________ 。

部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
(2)已知硼酸(H3BO3)结构和性质与Al(OH)3相似,则硼酸与NaOH溶液反应的化学方程式为
(3)沉淀X中除了有Al(OH)3、Fe(OH)3外,还含有二氧化锰,用离子方程式解释原因为
(4)过滤Ⅱ和过滤Ⅲ之间省略的操作步骤为
 外主要还含有
外主要还含有
您最近一年使用:0次
【推荐2】过二硫酸钾( )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
实验(一):探究过二硫酸钾的强氧化性。
探究 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:
(1)同学甲用碰撞理论分析,实验Ⅰ中 和
和 反应很慢的主要原因是
反应很慢的主要原因是___________
(2)同学乙猜想实验Ⅱ中 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:
(ⅰ)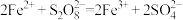 ;(ⅱ)___________。
;(ⅱ)___________。
①补充反应(ⅱ):___________ 。
②请你设计实验证明同学乙的猜想:___________ 。
(3)查阅文献知,氧化性: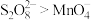 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是___________ ,该反应的离子方程式为___________ 。
实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
取适量的 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
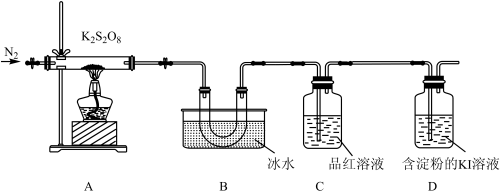
(4)加热之前,先通入一段时间 ,当观察到D中
,当观察到D中___________ (填实验现象)时点燃酒精灯。
(5)B中U形管收集的物质是___________ (填化学式)。
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为___________ 。
 )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。实验(一):探究过二硫酸钾的强氧化性。
探究
 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:| 实验 | 操作 | 现象 |
| Ⅰ | 在10L含淀粉的 的 的 溶液中滴加 溶液中滴加   溶液 溶液 | 一段时间后,溶液缓慢变蓝 |
| Ⅱ | 在 含淀粉的 含淀粉的 的 的 溶液中先滴几滴 溶液中先滴几滴 的 的 溶液,再滴加 溶液,再滴加   溶液 溶液 | 溶液迅速变蓝 |
 和
和 反应很慢的主要原因是
反应很慢的主要原因是(2)同学乙猜想实验Ⅱ中
 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:(ⅰ)
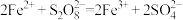 ;(ⅱ)___________。
;(ⅱ)___________。①补充反应(ⅱ):
②请你设计实验证明同学乙的猜想:
(3)查阅文献知,氧化性:
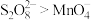 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
| 气体 |  |  |  |
| 熔点/℃ | 16.8 | -72.7 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |
 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间
 ,当观察到D中
,当观察到D中(5)B中U形管收集的物质是
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中
 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】NiSO4是化学镀镍的原料,一种用废雷尼镍催化剂(已预处理,主要含NiO,还含有少量Fe、Cr及不溶物)制备NiSO4·7H2O的工艺流程如下:

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为____ 。
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是________ 。
(3)“氧化”时,Fe2+被氧化的离子方程式为________ 。
(4)“滤渣2”的成分是______ 。
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
(5)“浓缩”时,加入H2SO4调节pH为3.5~4.0的目的是____ ;由浓缩液得到产品的步骤为____ 。
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=____ %。

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是
(3)“氧化”时,Fe2+被氧化的离子方程式为
(4)“滤渣2”的成分是
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
| Ni2+ | Fe2+ | Cr3+ | Fe3+ | |
| 开始沉淀pH | 6.2 | 7.6 | 4.5 | 2.3 |
| 沉淀完全pH | 8.6 | 9.1 | 5.6 | 3.3 |
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】打印机墨粉中 的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉中
的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉中 的含量,同学们在化学实验室中进行了如下实验。(已知:墨粉中除
的含量,同学们在化学实验室中进行了如下实验。(已知:墨粉中除 外,其余成分既不含铁元素,也不溶于水、不与酸反应)
外,其余成分既不含铁元素,也不溶于水、不与酸反应)

(1)检验 :
:
【实验原理】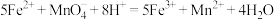
【实验操作】取第一份溶液少许,向其中滴加紫色的酸性 溶液,振荡,观察到溶液紫色
溶液,振荡,观察到溶液紫色_______ 。
【实验结论】溶液中含 ,同时证明
,同时证明 具有
具有_______ 性。
(2)测定 的含量:
的含量:

①加入足量氯水的目的是_______ ,有关反应的离子方程式是_______ 。
②加入足量NaOH溶液后观察到的现象是_______ 。
③加热时发生反应的化学方程式是_______ 。
 的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉中
的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉中 的含量,同学们在化学实验室中进行了如下实验。(已知:墨粉中除
的含量,同学们在化学实验室中进行了如下实验。(已知:墨粉中除 外,其余成分既不含铁元素,也不溶于水、不与酸反应)
外,其余成分既不含铁元素,也不溶于水、不与酸反应)
(1)检验
 :
:【实验原理】
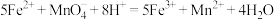
【实验操作】取第一份溶液少许,向其中滴加紫色的酸性
 溶液,振荡,观察到溶液紫色
溶液,振荡,观察到溶液紫色【实验结论】溶液中含
 ,同时证明
,同时证明 具有
具有(2)测定
 的含量:
的含量:
①加入足量氯水的目的是
②加入足量NaOH溶液后观察到的现象是
③加热时发生反应的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知A、B是常见的气体单质且B呈黄绿色,F遇KSCN溶液变血红色,各物质之间的转化关系如右图所示。
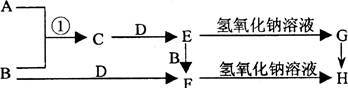
(1)写出下列各物质的化学式:D_______ 、E_________ 、G_________ 。
(2)写出反应①的化学方程式:_____________________________ 。
写出F→H的离子方程式_________________________________ 。
(3)描述G→H反应的现象__________________________________ 。

(1)写出下列各物质的化学式:D
(2)写出反应①的化学方程式:
写出F→H的离子方程式
(3)描述G→H反应的现象
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组利用高锰酸钾与8mol/L盐酸反应制氯气并进行氯气性质的探究,实验装置如图所示:
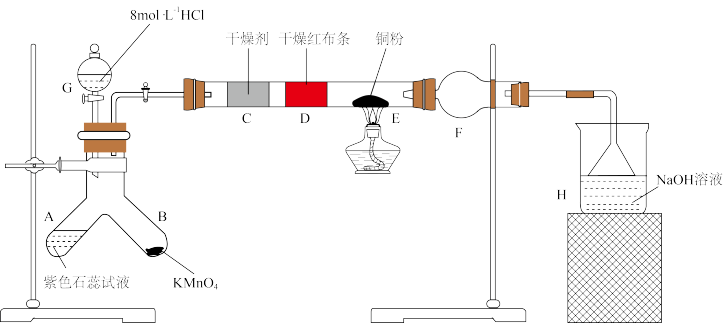
请回答下列问题:
(1)B中制取 的化学反应方程式为
的化学反应方程式为_______ 。
(2)根据相关实验现象就可以证明起漂白作用的不是氯气而是次氯酸,相关现象是_______ 。
(3)H处装置的作用是_______ 。
(4)实验室需要用12mol/L的浓盐酸来配制90mL6mol/L的盐酸,需该浓盐酸的体积为_______ mL。
为探究 对
对 溶解性的影响,进行如下实验。已知
溶解性的影响,进行如下实验。已知 在常温下溶解度为
在常温下溶解度为 。测定不同浓度
。测定不同浓度 溶液中的
溶液中的 溶解度,结果如下:
溶解度,结果如下:
(5)根据实验数据, 溶液浓度大于
溶液浓度大于_______  时,增加
时,增加 溶液浓度对
溶液浓度对 溶解度变化无明显影响。
溶解度变化无明显影响。
(6)为进一步探究食盐水中哪些微粒能降低 溶解度,取三支试管,分别加入一定浓度NaCl溶液、HCl溶液和
溶解度,取三支试管,分别加入一定浓度NaCl溶液、HCl溶液和 溶液,通入足量
溶液,通入足量 后,测定
后,测定 溶解度。
溶解度。
①a=_______ ,c=_______ 。
②对比实验1和实验2可以得到的结论是_______ 。
③设置实验3的目的是_______ 。
④实验结论:食盐水中能够降低 溶解度的微粒有
溶解度的微粒有_______ 。
(7)有同学认为H+会减弱 溶液降低
溶液降低 溶解度的效果。为验证该同学的猜想是否正确,可设计实验方案为
溶解度的效果。为验证该同学的猜想是否正确,可设计实验方案为_______ 。

请回答下列问题:
(1)B中制取
 的化学反应方程式为
的化学反应方程式为(2)根据相关实验现象就可以证明起漂白作用的不是氯气而是次氯酸,相关现象是
(3)H处装置的作用是
(4)实验室需要用12mol/L的浓盐酸来配制90mL6mol/L的盐酸,需该浓盐酸的体积为
为探究
 对
对 溶解性的影响,进行如下实验。已知
溶解性的影响,进行如下实验。已知 在常温下溶解度为
在常温下溶解度为 。测定不同浓度
。测定不同浓度 溶液中的
溶液中的 溶解度,结果如下:
溶解度,结果如下: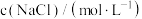 | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
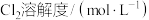 | 0.0658 | 0.0580 | 0.0490 | 0.0416 | 0.0385 | 0.0362 | 0.0362 |
 溶液浓度大于
溶液浓度大于 时,增加
时,增加 溶液浓度对
溶液浓度对 溶解度变化无明显影响。
溶解度变化无明显影响。(6)为进一步探究食盐水中哪些微粒能降低
 溶解度,取三支试管,分别加入一定浓度NaCl溶液、HCl溶液和
溶解度,取三支试管,分别加入一定浓度NaCl溶液、HCl溶液和 溶液,通入足量
溶液,通入足量 后,测定
后,测定 溶解度。
溶解度。| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 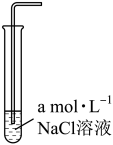 | 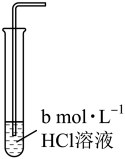 | 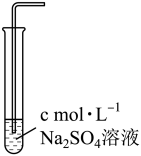 |
 溶解度/( 溶解度/( ) ) | 0.0490 | 0.0665 | 0.0800 |
②对比实验1和实验2可以得到的结论是
③设置实验3的目的是
④实验结论:食盐水中能够降低
 溶解度的微粒有
溶解度的微粒有(7)有同学认为H+会减弱
 溶液降低
溶液降低 溶解度的效果。为验证该同学的猜想是否正确,可设计实验方案为
溶解度的效果。为验证该同学的猜想是否正确,可设计实验方案为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图。
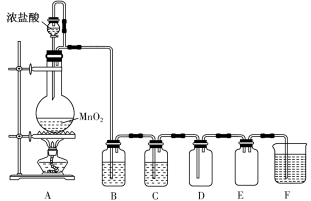
(1)圆底烧瓶中发生反应的化学方程式为___________ 。
(2)若要在 D 中得到干燥纯净的气体,B、F中应分别盛放的试剂为___________ 、___________ 。
(3)E的作用是___________
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入 MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与 NaCl的浓溶液混合加热
e.浓硫酸与 NaCl固体、MnO2固体共热
①实验b的目的是___________ 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是___________ 。

(1)圆底烧瓶中发生反应的化学方程式为
(2)若要在 D 中得到干燥纯净的气体,B、F中应分别盛放的试剂为
(3)E的作用是
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入 MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与 NaCl的浓溶液混合加热
e.浓硫酸与 NaCl固体、MnO2固体共热
①实验b的目的是
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
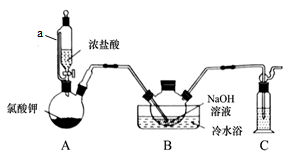
已知:2NaClO + (CNO)3H3 = (CNO)3Cl2Na + NaOH + H2O
待装置B中出现_______ 现象时,可由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入 Cl2的理由是_______ 。

已知:2NaClO + (CNO)3H3 = (CNO)3Cl2Na + NaOH + H2O
待装置B中出现
您最近一年使用:0次