二氧化硫的污染治理是化学家关注的热点问题之一,回答下列问题。
I.二氧化硫的治理。已知25℃时,Kb(NH3·H2O)=1.8×10-5 Ksp(CaSO4)=7.1×10-5 Ka1(H2SO3)=1.5×10-2 Ka2(H2SO3)=1.0×10-7。
(1)亚硫酸盐法。将含二氧化硫的烟气通入1.0mol·L-1的Na2SO3溶液,写出该反应的化学方程式_______ 。若此过程中溶液体积不变,则溶液的pH将_______ (填“减小”“不变”或“增大)。
(2)双碱脱硫法。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH +SO
+SO ⇌CaSO4↓+2NH3·H2O
⇌CaSO4↓+2NH3·H2O
计算第2步反应的K=_______ (填数值,保留2位有效数字)。
(3)电解法。先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如图所示。

①b为电源的_______ (填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是_______ 。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫_______ kg。
II.二氧化硫的转化。
(4)适当调控硫酸工业的反应条件可提高二氧化硫的转化率,减少其排放。已知,对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线a)、平衡转化率与温度(曲线b)的关系曲线示意图(标明曲线 a 、 b )_______ 。

I.二氧化硫的治理。已知25℃时,Kb(NH3·H2O)=1.8×10-5 Ksp(CaSO4)=7.1×10-5 Ka1(H2SO3)=1.5×10-2 Ka2(H2SO3)=1.0×10-7。
(1)亚硫酸盐法。将含二氧化硫的烟气通入1.0mol·L-1的Na2SO3溶液,写出该反应的化学方程式
(2)双碱脱硫法。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH
 +SO
+SO ⇌CaSO4↓+2NH3·H2O
⇌CaSO4↓+2NH3·H2O计算第2步反应的K=
(3)电解法。先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如图所示。

①b为电源的
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫
II.二氧化硫的转化。
(4)适当调控硫酸工业的反应条件可提高二氧化硫的转化率,减少其排放。已知,对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线a)、平衡转化率与温度(曲线b)的关系曲线示意图(

更新时间:2021-12-30 10:23:26
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲烷、甲醇都是清洁能源。
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =____________ 。
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g) CH3OH(g) △H。
CH3OH(g) △H。
一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
①该反应的△H______ 0(填“>”或“<”)。
②达到平衡时,容器I中c(CH3OH)_____ 0.16mol/L(填“>” “<” 或“=”)。
③400 K 时该反应的平衡常数K=________ 。
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:
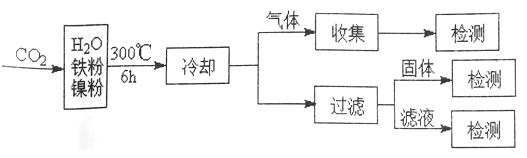
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即: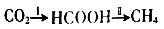
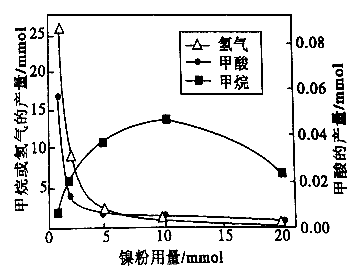
①写出产生H2的反应方程式_________ 。
②由图可知,镍粉是_______ (填字母)。
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是______ (填字母)。
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g)
 CH3OH(g) △H。
CH3OH(g) △H。一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
| 容器 | 温度/K | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol.L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| I | 400 | 0.20 | 0.10 | 0 | 0.080 |
| II | 400 | 0.40 | 0.20 | 0 | |
| III | 500 | 0 | 0 | 0.10 | 0.025 |
①该反应的△H
②达到平衡时,容器I中c(CH3OH)
③400 K 时该反应的平衡常数K=
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即:
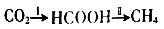

①写出产生H2的反应方程式
②由图可知,镍粉是
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国丙烷储量丰富,将丙烷转化为具有高附加值的产品,具有广阔的实用前景及巨大的经济效益。丙烷无氧脱氢的化学方程式如下:
主反应:

副反应:
已知:高温会引起催化剂积碳,阻碍反应的进行,充入水蒸气可以减少积碳的生成。
请回答下列问题:
(1)已知 时,C—H键能、C—C键能、C=C键能以及H—H键能分别为
时,C—H键能、C—C键能、C=C键能以及H—H键能分别为 、
、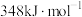 、
、 、
、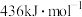 ,估算主反应的
,估算主反应的
________ 。
(2)在常压、460~500℃、 作催化剂条件下,某团队对丙烷脱氢主反应进行了研究,认为在脱氢过程中可能有4个主要步骤(*表示催化剂表面吸附位,
作催化剂条件下,某团队对丙烷脱氢主反应进行了研究,认为在脱氢过程中可能有4个主要步骤(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的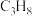 )。
)。
I.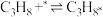
Ⅱ.________________
Ⅲ.
Ⅳ.
①补全步骤Ⅱ的化学方程式:________________ 。
②已知上述反应机理中速率控制步骤(即速率最慢步骤)为Ⅱ,试分析其原因可能为________________ 。
(3)下列措施能提高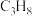 的平衡转化率,又能增大生成丙烯的反应速率的是
的平衡转化率,又能增大生成丙烯的反应速率的是_________ (填标号)。
A.加入催化剂 B.增大压强 C.升高温度
(4)某温度下,假定只发生上述两个反应,初始压强为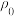 ,向某恒容密闭容器中充入
,向某恒容密闭容器中充入 和
和 ,平衡时测得
,平衡时测得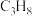 的转化率为60%,
的转化率为60%, 的体积分数为0.25,则平衡时
的体积分数为0.25,则平衡时 的选择性=
的选择性=________ (生成 消耗的
消耗的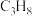 在总消耗
在总消耗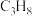 中的占比,保留3位有效数字),主反应的平衡常数
中的占比,保留3位有效数字),主反应的平衡常数
________ (用分式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)已知丙烷有氧脱氢的热化学方程式为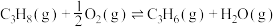
 ,试从热力学角度和物质性质,分析丙烷有氧和无氧脱氢的利弊:
,试从热力学角度和物质性质,分析丙烷有氧和无氧脱氢的利弊:__________ 。
主反应:


副反应:

已知:高温会引起催化剂积碳,阻碍反应的进行,充入水蒸气可以减少积碳的生成。
请回答下列问题:
(1)已知
 时,C—H键能、C—C键能、C=C键能以及H—H键能分别为
时,C—H键能、C—C键能、C=C键能以及H—H键能分别为 、
、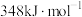 、
、 、
、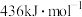 ,估算主反应的
,估算主反应的
(2)在常压、460~500℃、
 作催化剂条件下,某团队对丙烷脱氢主反应进行了研究,认为在脱氢过程中可能有4个主要步骤(*表示催化剂表面吸附位,
作催化剂条件下,某团队对丙烷脱氢主反应进行了研究,认为在脱氢过程中可能有4个主要步骤(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的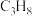 )。
)。I.
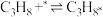
Ⅱ.________________
Ⅲ.

Ⅳ.

①补全步骤Ⅱ的化学方程式:
②已知上述反应机理中速率控制步骤(即速率最慢步骤)为Ⅱ,试分析其原因可能为
(3)下列措施能提高
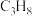 的平衡转化率,又能增大生成丙烯的反应速率的是
的平衡转化率,又能增大生成丙烯的反应速率的是A.加入催化剂 B.增大压强 C.升高温度
(4)某温度下,假定只发生上述两个反应,初始压强为
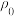 ,向某恒容密闭容器中充入
,向某恒容密闭容器中充入 和
和 ,平衡时测得
,平衡时测得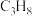 的转化率为60%,
的转化率为60%, 的体积分数为0.25,则平衡时
的体积分数为0.25,则平衡时 的选择性=
的选择性= 消耗的
消耗的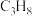 在总消耗
在总消耗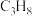 中的占比,保留3位有效数字),主反应的平衡常数
中的占比,保留3位有效数字),主反应的平衡常数
(5)已知丙烷有氧脱氢的热化学方程式为
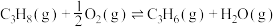
 ,试从热力学角度和物质性质,分析丙烷有氧和无氧脱氢的利弊:
,试从热力学角度和物质性质,分析丙烷有氧和无氧脱氢的利弊:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮及其化合物在生产,生活中有着重要的作用。
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
分析数据可知:大气固氮反应属于_________ (填“吸热”或“放热”)反应,人类不适合大规模模拟大气固氮的原因是______________________________________ 。
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下: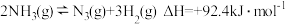 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________ (用a、b、c表示)。b点氮气的百分含量高于c点的原因是______ 。

(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为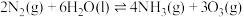 ,该条件下,向一体积为
,该条件下,向一体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和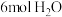 ,
, 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率 ,则平衡时
,则平衡时 的转化率为
的转化率为______________ ,则常温下该反应的化学平衡常数
________________ 。(保留小数点后2位)
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气: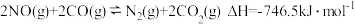 ,将
,将 与
与 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第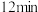 时改变的反应条件可能为
时改变的反应条件可能为____________ (填序号)。

A.保持恒温恒容充入 气
气
B.保持恒容,降低温度
C.移走
D.保持恒温,缩小容器体积,增大压强
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 | 工业固氮 | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K |  | 0.1 | 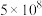 | 0.507 | 0.152 |
分析数据可知:大气固氮反应属于
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下:
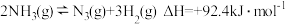 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是
(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为
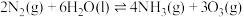 ,该条件下,向一体积为
,该条件下,向一体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和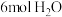 ,
, 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率 ,则平衡时
,则平衡时 的转化率为
的转化率为
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气:
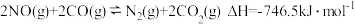 ,将
,将 与
与 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第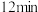 时改变的反应条件可能为
时改变的反应条件可能为
A.保持恒温恒容充入
 气
气 B.保持恒容,降低温度
C.移走

D.保持恒温,缩小容器体积,增大压强
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(1)在25℃、101kPa时

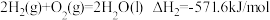
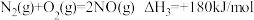
则NO与NH3反应生成惰性氮的热化学方程式为___________ 。
II.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成: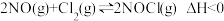 。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[
。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[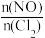 ]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
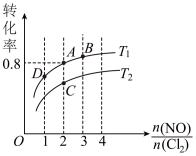
(2)图中T1、T2的关系为:T1___________ T2(填“>”、“<”或“=”)
(3)图中A、B、C、D四点对应的NOCl体积分数最大的是___________ 。
(4)若容器容积为2L,则A点的平衡常数为___________ 。
I.已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(1)在25℃、101kPa时

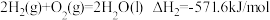
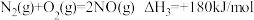
则NO与NH3反应生成惰性氮的热化学方程式为
II.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:
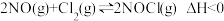 。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[
。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[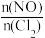 ]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
(2)图中T1、T2的关系为:T1
(3)图中A、B、C、D四点对应的NOCl体积分数最大的是
(4)若容器容积为2L,则A点的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究NOx、COx的消除和再利用对改善生态环境、构建生态文明具有重要的意义。
Ⅰ.反应N2(g)+O2(g)=2NO(g) ΔH1=+180.0kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH2。
(1)已知CO的燃烧热为283.0kJ·mol-1,写出表示CO燃烧热的方程式:_______ ,ΔH2=_______ 。
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用 和
和 分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是
分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是_______ (填字母序号)。

(3)另一研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内脱氮率(即NO的转化率)随温度的变化关系如图1所示。图中低于200℃,脱氮率随温度升高而变化不大的主要原因是_______ 。

Ⅱ.向容积可变的密闭容器中充入1mol CO和2.2mol H2,在恒温恒压条件下发生反应CO(g)+2H2(g) CH3OH(g) ΔH<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
CH3OH(g) ΔH<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。

(4)反应速率:N点v正(CO)(填“大于”、“小于”或“等于”)_______ M点v逆(CO)。
(5)M点时,H2的转化率为_______ (计算结果精确到0.1%)。
(6)不同温度下,该反应的平衡常数的对数值(lgK )如图3所示,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_______ (填字母符号)。
Ⅰ.反应N2(g)+O2(g)=2NO(g) ΔH1=+180.0kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH2。
(1)已知CO的燃烧热为283.0kJ·mol-1,写出表示CO燃烧热的方程式:
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
 和
和 分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是
分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是
(3)另一研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内脱氮率(即NO的转化率)随温度的变化关系如图1所示。图中低于200℃,脱氮率随温度升高而变化不大的主要原因是

Ⅱ.向容积可变的密闭容器中充入1mol CO和2.2mol H2,在恒温恒压条件下发生反应CO(g)+2H2(g)
 CH3OH(g) ΔH<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
CH3OH(g) ΔH<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
(4)反应速率:N点v正(CO)(填“大于”、“小于”或“等于”)
(5)M点时,H2的转化率为
(6)不同温度下,该反应的平衡常数的对数值(lgK )如图3所示,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法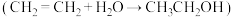 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合 的反应机理大致如下:
i.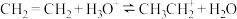
ii.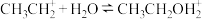
iii.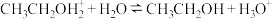
随着反应进程,该过程能量变化如图所示。
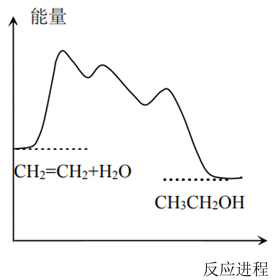
下列有关说法正确的是_______ (填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.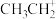 和
和 是反应的中间产物
是反应的中间产物
(2)已知: 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正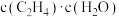 ,v逆=k逆
,v逆=k逆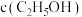 ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______ 。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇: 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量 和
和 发生上述反应,
发生上述反应, 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比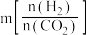 的关系如图所示。
的关系如图所示。
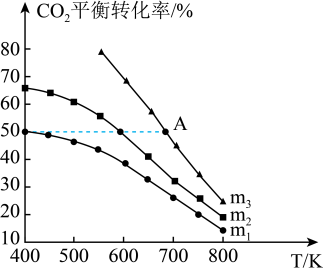
(1)投料比由大到小的顺序为___________ 。
(2)若投料比 ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______ (填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. 的体积分数不再变化
的体积分数不再变化
d.容器内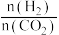 不再变化
不再变化
e.断裂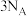 个H—H键的同时生成
个H—H键的同时生成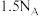 个水分子
个水分子
(3)若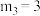 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数 的数值为
的数值为_______ ( 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时 的转化率
的转化率___________ 50%(填“>”、“=”或“<”)。
I.工业上主要采用乙烯直接水合法
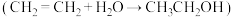 制乙醇。
制乙醇。(1)在磷酸/硅藻土催化剂作用下,乙烯进行
i.
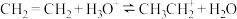
ii.
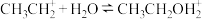
iii.
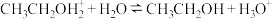
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.
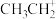 和
和 是反应的中间产物
是反应的中间产物(2)已知:
 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正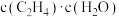 ,v逆=k逆
,v逆=k逆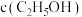 ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:
 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量 和
和 发生上述反应,
发生上述反应, 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比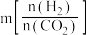 的关系如图所示。
的关系如图所示。
(1)投料比由大到小的顺序为
(2)若投料比
 ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c.
 的体积分数不再变化
的体积分数不再变化d.容器内
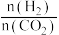 不再变化
不再变化e.断裂
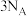 个H—H键的同时生成
个H—H键的同时生成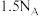 个水分子
个水分子(3)若
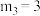 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数 的数值为
的数值为 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时 的转化率
的转化率
您最近一年使用:0次
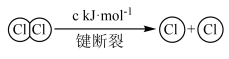
【推荐1】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: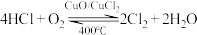
(1)已知400℃时:
ⅰ.断开1mol H—O键所需的能量比断开1molH—Cl键所需能量多akJ。
ⅱ.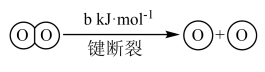
①写出此条件下,上述反应的热化学方程式________________ 。
②该反应能自发进行的主要原因是________________ 。
③下列有关地康法制取氯气说法正确的是( )
A.使用催化剂或开高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl)/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示:

①图中T1、T2的关系为:T1________ T2(填“>”、“<”或“=”)。
②图中纵坐标为物质________ 的转化率;
③若容器容积为2L,则B点的平衡常数的值为________ 。
④试画出温度T1时另一种反应物的转化率随氯氧比变化的图象________
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
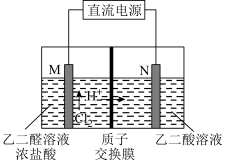
①写出乙二醛与M电极的产物反应生成乙醛酸的离子方程式________________ 。
②若有2mol H+通过质子交换膜,并完全参与反应,则该装置中生成的乙醛酸为________ mol。
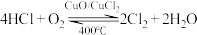
(1)已知400℃时:
ⅰ.断开1mol H—O键所需的能量比断开1molH—Cl键所需能量多akJ。
ⅱ.


①写出此条件下,上述反应的热化学方程式
②该反应能自发进行的主要原因是
③下列有关地康法制取氯气说法正确的是
A.使用催化剂或开高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl)/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示:

①图中T1、T2的关系为:T1
②图中纵坐标为物质
③若容器容积为2L,则B点的平衡常数的值为
④试画出温度T1时另一种反应物的转化率随氯氧比变化的图象
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。

①写出乙二醛与M电极的产物反应生成乙醛酸的离子方程式
②若有2mol H+通过质子交换膜,并完全参与反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
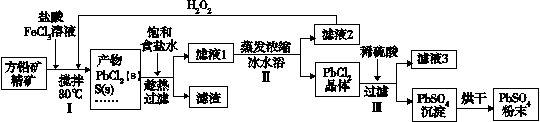
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
(1)步骤Ⅰ中生成PbCl2的离子方程式_______ ,加入盐酸控制pH值小于2,原因是_______ 。
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因______ 。若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______ 。
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式______ 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因______ 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为_______ 。
(6)双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是____ 。
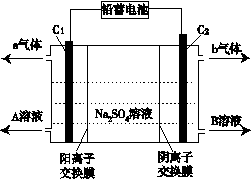
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑

已知:(ⅰ)PbCl2(s)+2Cl-(aq)
 PbCl42-(aq) △H>0
PbCl42-(aq) △H>0(ⅱ)有关物质的Ksp和沉淀时的pH如下:
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为
(6)双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是

A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O
 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】某科研团队拟采用合成气(主要成分为CO、 和
和 )制备甲醇,涉及的反应如下。
)制备甲醇,涉及的反应如下。
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

已知反应Ⅰ、Ⅱ的焓变分别为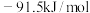 、
、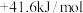 。
。
(1)反应Ⅲ的焓变为_______ ,该反应在_______ (填“较低”或“较高”)温度下才能自发进行。
(2)反应Ⅱ的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
①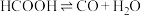 (快)
(快)
② (慢)
(慢)
其中反应①速率远大于反应②,反应①可快速达到平衡状态。常温下,在密封石英管内完全充满 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
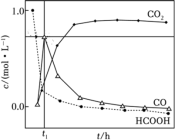
请解释CO浓度先增大后减小的原因________ 。研究发现,在反应①、②中, 仅对反应①有促进作用,则相同条件下,若反应起始时溶液中同时还含有
仅对反应①有促进作用,则相同条件下,若反应起始时溶液中同时还含有 盐酸,CO的浓度达到峰值时,
盐酸,CO的浓度达到峰值时, 的浓度与不添加盐酸相比会
的浓度与不添加盐酸相比会_______ (填“较低”或“较高”)。
(3)制备甲醇时,若只发生反应Ⅰ和Ⅱ。保持温度T不变,向一恒容密闭容器中充入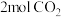 和
和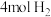 ,在该催化剂作用下发生反应,经
,在该催化剂作用下发生反应,经 达到平衡,起始及达平衡时容器的总压强分别为
达到平衡,起始及达平衡时容器的总压强分别为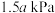 、
、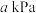 ,测得平衡时
,测得平衡时 的分压为
的分压为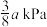 ,则反应Ⅱ的压强平衡常数
,则反应Ⅱ的压强平衡常数
_______ ( 为用分压代替浓度计算的平衡常数)。
为用分压代替浓度计算的平衡常数)。
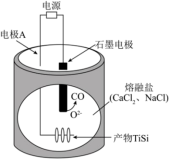
(4)科学家拟采用下列装置,在熔融盐体系中,通过电解 和
和 获得电池材料
获得电池材料 ,并获取CO,电解装置如图,阳极的电极方程式为
,并获取CO,电解装置如图,阳极的电极方程式为_________ ,每转移 ,石墨电极生成标准状况下的CO的体积为
,石墨电极生成标准状况下的CO的体积为_______ 。
 和
和 )制备甲醇,涉及的反应如下。
)制备甲醇,涉及的反应如下。反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


已知反应Ⅰ、Ⅱ的焓变分别为
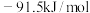 、
、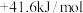 。
。(1)反应Ⅲ的焓变为
(2)反应Ⅱ的中间产物是
 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:①
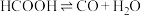 (快)
(快)②
 (慢)
(慢)其中反应①速率远大于反应②,反应①可快速达到平衡状态。常温下,在密封石英管内完全充满
 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
请解释CO浓度先增大后减小的原因
 仅对反应①有促进作用,则相同条件下,若反应起始时溶液中同时还含有
仅对反应①有促进作用,则相同条件下,若反应起始时溶液中同时还含有 盐酸,CO的浓度达到峰值时,
盐酸,CO的浓度达到峰值时, 的浓度与不添加盐酸相比会
的浓度与不添加盐酸相比会(3)制备甲醇时,若只发生反应Ⅰ和Ⅱ。保持温度T不变,向一恒容密闭容器中充入
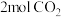 和
和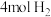 ,在该催化剂作用下发生反应,经
,在该催化剂作用下发生反应,经 达到平衡,起始及达平衡时容器的总压强分别为
达到平衡,起始及达平衡时容器的总压强分别为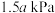 、
、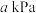 ,测得平衡时
,测得平衡时 的分压为
的分压为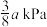 ,则反应Ⅱ的压强平衡常数
,则反应Ⅱ的压强平衡常数
 为用分压代替浓度计算的平衡常数)。
为用分压代替浓度计算的平衡常数)。(4)科学家拟采用下列装置,在熔融盐体系中,通过电解
 和
和 获得电池材料
获得电池材料 ,并获取CO,电解装置如图,阳极的电极方程式为
,并获取CO,电解装置如图,阳极的电极方程式为 ,石墨电极生成标准状况下的CO的体积为
,石墨电极生成标准状况下的CO的体积为
您最近一年使用:0次



