在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与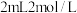 的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是
的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是
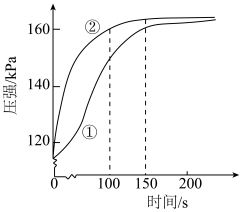
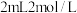 的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是
的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是
| A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线 |
B.在100~150s时间段内,盐酸与 反应的速率快于醋酸与 反应的速率快于醋酸与 反应的速率 反应的速率 |
| C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等 |
D.用 溶液完全中和上述两种酸溶液,盐酸消耗 溶液完全中和上述两种酸溶液,盐酸消耗 溶液的体积更多 溶液的体积更多 |
更新时间:2022-01-23 20:54:26
|
【知识点】 弱电解质的电离平衡
相似题推荐
单选题
|
适中
(0.65)
【推荐1】HA是一元弱酸,BOH是一元弱碱,室温下,不同浓度的NaA或BCl溶液的pH与-lg 或-lg
或-lg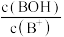 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是

 或-lg
或-lg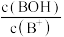 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
| A.直线ab对应物质为NaA | B.BOH的电离常数Kb=10-5 |
| C.水的电离程度: a>b | D.室温下BA溶液的pH=7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
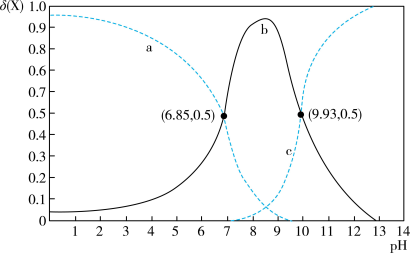
【推荐2】室温下,乙二胺(H2NCH2CH2NH2,用符号B表示)溶于水存在如下平衡:B + H2O⇌HB+ + OH-Kb1;HB+ + H2O⇌H2B2+ + OH-Kb2。其水溶液中的相关组分B、HB+、H2B2+的物质的量分数δ(X)随溶液pH的变化曲线如图所示[δ(X)= ]。下列说法正确的是
]。下列说法正确的是
 ]。下列说法正确的是
]。下列说法正确的是
| A.曲线b表示δ(H2B2+)随溶液pH的变化情况 |
| B.等浓度的乙二胺的水溶液与盐酸等体积混合后,溶液呈酸性 |
| C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,c(H2B2+)<c(HB+) |
| D.Kb1的数量级为10-4 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】反﹣丁烯二酸(记作 H2F)溶液中 H2F、HF﹣和 F2﹣的分布系数σ随pH变化如图所示[如 σ(F2﹣)= ],下列说法错误的是
],下列说法错误的是

 ],下列说法错误的是
],下列说法错误的是
| A.lgKa1=﹣3.02 |
| B.向 H2F溶液中滴加NaOH溶液至pH=4.48时:c(Na+)<3c(HF﹣) |
C.反应 H2F+F2﹣ 2HF﹣的平衡常数的对数值lgK=1.46 2HF﹣的平衡常数的对数值lgK=1.46 |
| D.0.1mol⋅L﹣1的NaHF溶液中:c(HF﹣)>c(H2F)>c(F2﹣) |
您最近一年使用:0次



