化学小组同学学习了Fe3+与Fe反应后,猜想Cu2+也能与Cu发生反应。为了验证猜想,进行实验。
(1)Fe2(SO4)3溶液与Fe反应的离子方程式为___________ 。
(2)[实验探究]
[实验假设]
甲同学分析了实验Ⅰ无明显现象的原因,做出如下假设:
假设a:由于反应温度较低,导致Cu2+氧化性较弱。
假设b:由于___________ ,导致Cu2+氧化性较弱。(补全假设b)
针对上述假设,甲同学继续进行如下实验:
[实验探究]
实验结果:实验Ⅱ和实验Ⅲ中均未检测出Cu+。
(3)[实验探究]
乙同学用CuCl2溶液代替CuSO4溶液进行实验:
实验Ⅳ中发生的离子反应方程式为___________ 。
(4)[实验改进]
乙同学针对实验Ⅰ进行改进,设计并完成实验Ⅴ:向试管a中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
乙同学因此得出结论:Cl−对Cu2+与Cu发生反应有促进作用。
①丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是___________ 。
②丙同学继续设计实验:___________ (填操作和现象),证实了乙同学结论合理。
(5)[结论分析]
综合上述实验可知,Cu2+能否氧化Cu与___________ 有关
(1)Fe2(SO4)3溶液与Fe反应的离子方程式为
(2)[实验探究]
| 实验Ⅰ | 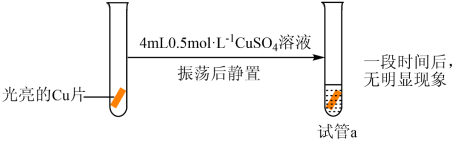 |
甲同学分析了实验Ⅰ无明显现象的原因,做出如下假设:
假设a:由于反应温度较低,导致Cu2+氧化性较弱。
假设b:由于
针对上述假设,甲同学继续进行如下实验:
[实验探究]
| 序号 | 实验 | 加入试剂或操作 |
| 实验Ⅱ |  | 加热试管 |
| 实验Ⅲ | 加入CuSO4固体,振荡 |
(3)[实验探究]
乙同学用CuCl2溶液代替CuSO4溶液进行实验:
| 实验Ⅳ |  |
(4)[实验改进]
乙同学针对实验Ⅰ进行改进,设计并完成实验Ⅴ:向试管a中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
乙同学因此得出结论:Cl−对Cu2+与Cu发生反应有促进作用。
①丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是
②丙同学继续设计实验:
(5)[结论分析]
综合上述实验可知,Cu2+能否氧化Cu与
更新时间:2022-02-15 08:48:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】化学与生产、生活密切相关,请根据下列要求作答。
I.桂皮中含有的肉桂醛(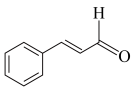 )是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
)是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
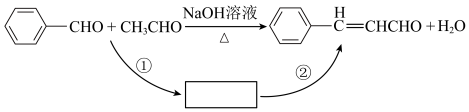
(1)已知反应①为加成反应,则反应②的反应类型为___________ 。
Ⅱ.蔗糖是重要的二糖,在一定条件下会发生水解反应。
(2)①为检验蔗糖的水解产物,需要配制银氨溶液,过程为:向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水到沉淀恰好完全溶解,写出配制银氨溶液总反应的离子方程式___________ 。
②补充完整验证蔗糖水解产物中含有葡萄糖的实验方案:取少量的10%的蔗糖溶液于试管中,___________ 。(实验中须使用的试剂有:10%的H2SO4溶液、10%的NaOH溶液、银氨溶液、pH试纸)
Ⅲ.硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)一炭粉还原法制备,原理为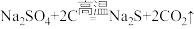 。其主要流程如下:
。其主要流程如下:
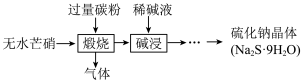
(3)上述流程中采用稀碱液比用热水更好,理由是___________ 。
(4)已知: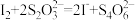 。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:
。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:
a.取试样10.00g配成500.00ml溶液。
b.取所配溶液25.00mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.05000mo1·L-1I2溶液滴定至终点,用去5.00mLI2溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为___________ 。
②判断步骤b中滴定终点的现象为___________ 。
③计算试样中Na2S2O3·5H2O的质量分数(写出计算过程)。___________ 。
I.桂皮中含有的肉桂醛(
 )是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
)是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
(1)已知反应①为加成反应,则反应②的反应类型为
Ⅱ.蔗糖是重要的二糖,在一定条件下会发生水解反应。
(2)①为检验蔗糖的水解产物,需要配制银氨溶液,过程为:向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水到沉淀恰好完全溶解,写出配制银氨溶液总反应的离子方程式
②补充完整验证蔗糖水解产物中含有葡萄糖的实验方案:取少量的10%的蔗糖溶液于试管中,
Ⅲ.硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)一炭粉还原法制备,原理为
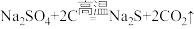 。其主要流程如下:
。其主要流程如下:
(3)上述流程中采用稀碱液比用热水更好,理由是
(4)已知:
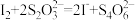 。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:
。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:a.取试样10.00g配成500.00ml溶液。
b.取所配溶液25.00mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.05000mo1·L-1I2溶液滴定至终点,用去5.00mLI2溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为
②判断步骤b中滴定终点的现象为
③计算试样中Na2S2O3·5H2O的质量分数(写出计算过程)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】空气吹出法工艺,是目前“海水提溴”的最主要方法之一、其工艺流程如下:___________ 。
(2)步骤④利用了SO2的还原性,反应的离子方程式:___________ 。
(3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2=NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为___________ mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。

(2)步骤④利用了SO2的还原性,反应的离子方程式:
(3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2=NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铁及其合金在工农业生产和日常生活中有广泛的应用。
(1)高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,写出Al和Fe2O3混合粉末发生铝热反应的化学方程式______ 。该反应的反应原理是______ 。
(2)琥珀酸亚铁,化学式为FeC4H4O4是一种常见高效补血药,易溶于水,在水溶液中发生电离:FeC4H4O4=Fe2++ ,有较强还原性。
,有较强还原性。
①取少量琥珀酸亚铁溶液,滴加NaOH溶液,写出反应的离子方程式______ 。
②取少量琥珀酸亚铁溶液,滴加KSCN溶液,溶液呈很浅的红色,滴加少量氯水溶液颜色变深。
溶液呈很浅的红色是因为Fe2+与氧气反应生成了Fe3+和水,写出酸性条件下发生该反应的离子方程式:______ 。用离子方程式表示滴加少量氯水溶液颜色变深的原因:______ 和Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
③服用琥珀酸亚铁时医生经常建议同时服用维生素C(又叫抗坏血酸),说明维生素C具有______ 。
A.强氧化性 B.强还原性 C.强酸性 D.很强的甜味
(3)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4),LiFePO4的一种制备方法如下。
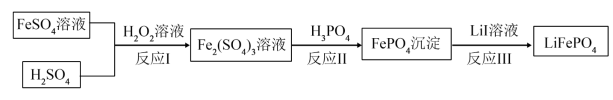
①写出反应Ⅰ的离子方程式______ 。
②反应Ⅲ中氧化剂是______ (填化学式)。
(1)高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,写出Al和Fe2O3混合粉末发生铝热反应的化学方程式
(2)琥珀酸亚铁,化学式为FeC4H4O4是一种常见高效补血药,易溶于水,在水溶液中发生电离:FeC4H4O4=Fe2++
 ,有较强还原性。
,有较强还原性。①取少量琥珀酸亚铁溶液,滴加NaOH溶液,写出反应的离子方程式
②取少量琥珀酸亚铁溶液,滴加KSCN溶液,溶液呈很浅的红色,滴加少量氯水溶液颜色变深。
溶液呈很浅的红色是因为Fe2+与氧气反应生成了Fe3+和水,写出酸性条件下发生该反应的离子方程式:
 Fe(SCN)3。
Fe(SCN)3。③服用琥珀酸亚铁时医生经常建议同时服用维生素C(又叫抗坏血酸),说明维生素C具有
A.强氧化性 B.强还原性 C.强酸性 D.很强的甜味
(3)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4),LiFePO4的一种制备方法如下。

①写出反应Ⅰ的离子方程式
②反应Ⅲ中氧化剂是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】铁、铜等金属及其化合物在日常生产生活中有非常广泛的用途。
I.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子: 、
、 ,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。

(1)操作①的名称是___________ 。加入铁屑先发生的离子反应为:___________ 。
(2)沉淀A中含有的金属单质有___________ 。
(3)操作②中观察到的实验现象是___________ 。
(4)操作③中发生反应的离子方程式为___________ 。
II.某化学实验小组通过实验来探究一包黑色粉是否含有 、CuO,探究过程如下:
、CuO,探究过程如下:
提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是 ;
;
假设3.黑色粉末是CuO和 的混合物。
的混合物。
设计探究实验:取少量粉末放入足量稀硫酸中,得溶液X,取一定量X于试管中,向其中滴加KSCN溶液。
(5)若假设1成立,则实验现象是___________ 。
(6)若假设2成立,则实验现象是___________ 。如何检验溶液X中含 离子?
离子?___________ 。
(7)若假设3成立,需继续向X溶液加入足量铁粉,则实验现象是___________ 。
I.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:
 、
、 ,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
(1)操作①的名称是
(2)沉淀A中含有的金属单质有
(3)操作②中观察到的实验现象是
(4)操作③中发生反应的离子方程式为
II.某化学实验小组通过实验来探究一包黑色粉是否含有
 、CuO,探究过程如下:
、CuO,探究过程如下:提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是
 ;
;假设3.黑色粉末是CuO和
 的混合物。
的混合物。设计探究实验:取少量粉末放入足量稀硫酸中,得溶液X,取一定量X于试管中,向其中滴加KSCN溶液。
(5)若假设1成立,则实验现象是
(6)若假设2成立,则实验现象是
 离子?
离子?(7)若假设3成立,需继续向X溶液加入足量铁粉,则实验现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
Ⅰ.中学化学中几种常见物质的转化关系如图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:_______ 。
(2)写出反应E+H2O2→的化学方程式:_______ 。
(3)若反应 转移的电子数为
转移的电子数为 ,则消耗D的质量为
,则消耗D的质量为_______ g。
Ⅱ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。写出该过程发生的离子方程式:_______ 。
(5)把a g的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。所产生的气体与b L(标准状况)的O2一起通入水中得到只含硝酸的水溶液。往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为_______ g。(用a、b的代数式表示)
Ⅰ.中学化学中几种常见物质的转化关系如图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:
(2)写出反应E+H2O2→的化学方程式:
(3)若反应
 转移的电子数为
转移的电子数为 ,则消耗D的质量为
,则消耗D的质量为Ⅱ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。写出该过程发生的离子方程式:
(5)把a g的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。所产生的气体与b L(标准状况)的O2一起通入水中得到只含硝酸的水溶液。往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】图中各物质均为中学化学中的常见物质,其中只有A、G为单质;D的摩尔质量比E小16,E为红棕色气体:可用 溶液检验Ⅰ中的阳离子。它们之间的相互转化关系如图所示(图中部分产物、反应条件未列出).
溶液检验Ⅰ中的阳离子。它们之间的相互转化关系如图所示(图中部分产物、反应条件未列出).
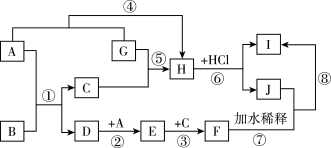
(1)B的用途为_______ (任写一种)
(2)反应③中氧化产物与还原产物的物质的量之比为_______
(3)反应⑤的化学方程式为_______
(4)实验在配制J溶液时,要加入一定量的G,其原因是_______ (用离子方程式表示)
(5)反应⑧的离子方程式为_______
 溶液检验Ⅰ中的阳离子。它们之间的相互转化关系如图所示(图中部分产物、反应条件未列出).
溶液检验Ⅰ中的阳离子。它们之间的相互转化关系如图所示(图中部分产物、反应条件未列出).
(1)B的用途为
(2)反应③中氧化产物与还原产物的物质的量之比为
(3)反应⑤的化学方程式为
(4)实验在配制J溶液时,要加入一定量的G,其原因是
(5)反应⑧的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】填空
(1)以某锑矿(主要成分为Sb2O3,含有少量CaO、PbO、As2O3等杂质)为原料制备SbF5的工艺流程如图1所示。

已知:As2O3微溶于水,Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
①“浸出”时少量Sb2O3转化为SbOCl,为“滤渣I”的成分,向“滤渣I”中加入氨水,SbOCl可再转化为Sb2O3,该反应的离子方程式为_______ 。
②“除砷“时, 转化为H3PO4,该反应的离子方程式为
转化为H3PO4,该反应的离子方程式为_______ 。
(2)工业上利用电解精炼锡后的阳极泥(含Cu、Ag、PbSO4及少量的Sn等)回收金属Cu和Ag的流程如图2所示。

①“浸取1”中金属Ag发生反应的离子方程式为_______ 。
②“浸液2”中溶质的主要成分是 ,则“浸取2”中生成
,则“浸取2”中生成 的离子方程式为
的离子方程式为_______ 。
(1)以某锑矿(主要成分为Sb2O3,含有少量CaO、PbO、As2O3等杂质)为原料制备SbF5的工艺流程如图1所示。

已知:As2O3微溶于水,Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
①“浸出”时少量Sb2O3转化为SbOCl,为“滤渣I”的成分,向“滤渣I”中加入氨水,SbOCl可再转化为Sb2O3,该反应的离子方程式为
②“除砷“时,
 转化为H3PO4,该反应的离子方程式为
转化为H3PO4,该反应的离子方程式为(2)工业上利用电解精炼锡后的阳极泥(含Cu、Ag、PbSO4及少量的Sn等)回收金属Cu和Ag的流程如图2所示。

①“浸取1”中金属Ag发生反应的离子方程式为
②“浸液2”中溶质的主要成分是
 ,则“浸取2”中生成
,则“浸取2”中生成 的离子方程式为
的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:

I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV. ,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是_____________ .
(2)试剂A是____________ .
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
(4)完成步骤IV需要用到的实验装置是_________ (填字母).

I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV. ,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是
(2)试剂A是
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入 | 滤液中有Fe3+ | |
| 步骤2:在滤液中加入 | 滤液中有Fe2+ |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铁是人类较早使用的金属之一,运用铁及其化合物的知识,回答下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是______ (用字母代号填空)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______ nm。
(3)检验溶液中是否存在Fe3+的试剂是______ (填物质名称),若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①请写出FeCl3溶液与铜反应的离子方程式:______ 。
②欲从制造印刷电路板的废液中回收铜,并重新获得FeCl3溶液的工艺流程如下:
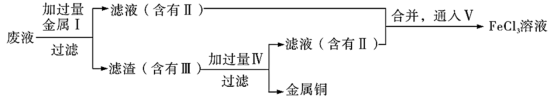
请写出上述流程中加入I和IV的有关物质的化学式:I______ ,IV______ 。请写出通入V反应的离子方程式______ 。
(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(3)检验溶液中是否存在Fe3+的试剂是
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①请写出FeCl3溶液与铜反应的离子方程式:
②欲从制造印刷电路板的废液中回收铜,并重新获得FeCl3溶液的工艺流程如下:

请写出上述流程中加入I和IV的有关物质的化学式:I
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】乐山某高中化学兴趣小组同学用西红柿(或洋葱)作为供水剂,设计了如图装置验证铁与水蒸气的反应,并对产物进行检验。回答下列问题:
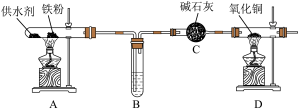
(1)A中铁与水蒸气反应的化学方程式是__ 。
(2)C中碱石灰的作用是__ 。
(3)D处实验现象为__ 。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:

(Ⅰ)固体A中Fe3O4与稀硫酸反应的离子方程式为__ 。
(Ⅱ)试剂A是__ (选填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.酚酞 d.新制氯水
(Ⅲ)有同学认为;即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是__ 。

(1)A中铁与水蒸气反应的化学方程式是
(2)C中碱石灰的作用是
(3)D处实验现象为
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:

(Ⅰ)固体A中Fe3O4与稀硫酸反应的离子方程式为
(Ⅱ)试剂A是
a.NaOH溶液 b.酸性KMnO4溶液 c.酚酞 d.新制氯水
(Ⅲ)有同学认为;即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
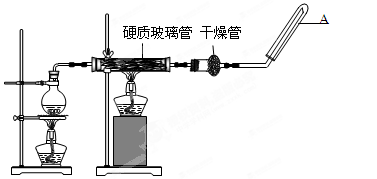
(1)写出该反应的反应方程式_____________________ ;并指明该氧化还原反应的还原剂是_________ ,氧化剂是_________ 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是________________________ ;烧瓶底部放置了几片碎瓷片,其作用是__________________________ 。
(3)试管中收集气体是_____________ ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行__________________ 。

(1)写出该反应的反应方程式
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是
(3)试管中收集气体是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
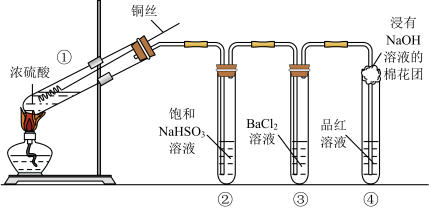
(1)①中反应的化学方程式是______ 。其中铜发生了______ (填“氧化”或“还原”)反应,判断依据为_____ 。
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是______ 。
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
完成上述反应的离子方程式。
(4)④中棉花团的作用是_______ 。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是______ 。

(1)①中反应的化学方程式是
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | |
| 第二份 | 加入氯水 | 有白色沉淀生成 |
(4)④中棉花团的作用是
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是
您最近一年使用:0次



