空气吹出法工艺,是目前“海水提溴”的最主要方法之一、其工艺流程如下:___________ 。
(2)步骤④利用了SO2的还原性,反应的离子方程式:___________ 。
(3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2=NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为___________ mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。

(2)步骤④利用了SO2的还原性,反应的离子方程式:
(3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2=NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为
更新时间:2024-05-08 20:33:50
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】下表为元素周期表的一部分,请参照元素①~⑥在表中的位置,用化学用语 回答下列问题。

(1)元素①的原子结构示意图为_______ 。
(2)元素③和⑥可形成化合物,用电子式表示形成其过程_______ 。
(3)元素②、③形成简单离子的半径(填离子符号)_______ >_______ 。
(4)元素②、⑥形成的气态氢化物稳定性(填化学式,下同)_______ >_______ ;元素③、④形成的最高价氧化物水化物的碱性_______ >_______ 。
(5)元素④的最高价氧化物与元素⑤最高价氧化物的水化物稀溶液反应的离子方程式_______ 。
(6)元素①的最高价氧化物的水化物与元素③最高价氧化物的水化物稀溶液反应的离子方程式_______

(1)元素①的原子结构示意图为
(2)元素③和⑥可形成化合物,用电子式表示形成其过程
(3)元素②、③形成简单离子的半径(填离子符号)
(4)元素②、⑥形成的气态氢化物稳定性(填化学式,下同)
(5)元素④的最高价氧化物与元素⑤最高价氧化物的水化物稀溶液反应的离子方程式
(6)元素①的最高价氧化物的水化物与元素③最高价氧化物的水化物稀溶液反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铍是航天、航空、电子和核工业等领域不可替代的材料,有“超级金属”之称。以绿柱石[ ]为原料制备金属铍的工艺如下,回答下列问题:
]为原料制备金属铍的工艺如下,回答下列问题:

已知:“滤渣1”中含有铁、铝硅的氧化物,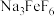 难溶于水,
难溶于水, 可与过量
可与过量 结合成
结合成 ,
, 。
。
(1)“操作1”的名称是_______ 。(填选项)
A.过滤 B.粉碎 C.萃取
(2)750℃烧结时,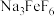 与绿柱石作用生成易溶于水的
与绿柱石作用生成易溶于水的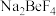 ,该反应的化学方程式为:
,该反应的化学方程式为:_______ 。
(3)“过滤1”的滤液中需加入适量NaOH生成 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是_______ (用离子方程式表示)。
(4)已知:室温时 ,则0.1
,则0.1
 溶液中
溶液中 开始沉淀时的
开始沉淀时的
_______ 。
(5)“沉氟”反应的离子方程式为_______ 。
(6)已知镍在稀酸中缓慢溶解。工业上电解 熔融混合物(所含阴离子结构类似于
熔融混合物(所含阴离子结构类似于 )制备金属铍,可选用镍坩埚作电解槽的
)制备金属铍,可选用镍坩埚作电解槽的_______ (填“阳极”或“阴极”)材料。电解时,阴极的电极反应式为_______ 。
 ]为原料制备金属铍的工艺如下,回答下列问题:
]为原料制备金属铍的工艺如下,回答下列问题:
已知:“滤渣1”中含有铁、铝硅的氧化物,
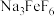 难溶于水,
难溶于水, 可与过量
可与过量 结合成
结合成 ,
, 。
。(1)“操作1”的名称是
A.过滤 B.粉碎 C.萃取
(2)750℃烧结时,
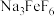 与绿柱石作用生成易溶于水的
与绿柱石作用生成易溶于水的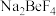 ,该反应的化学方程式为:
,该反应的化学方程式为:(3)“过滤1”的滤液中需加入适量NaOH生成
 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是(4)已知:室温时
 ,则0.1
,则0.1
 溶液中
溶液中 开始沉淀时的
开始沉淀时的
(5)“沉氟”反应的离子方程式为
(6)已知镍在稀酸中缓慢溶解。工业上电解
 熔融混合物(所含阴离子结构类似于
熔融混合物(所含阴离子结构类似于 )制备金属铍,可选用镍坩埚作电解槽的
)制备金属铍,可选用镍坩埚作电解槽的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
Ⅱ.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
Ⅲ.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
Ⅳ.向Ⅲ所得溶液(pH约为6)中缓慢滴加0.50mol•L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
Ⅴ.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι 中Ag与足量稀HNO3反应生成NO的化学方程式为___________ 。
(2)H2O2的电子式为___________ 。
(3)Ⅲ中MnO2溶解的离子方程式为___________ ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:___________ 。
(4)Ⅳ中,若改为“向0.50mol•L-1Na2CO3溶液中缓慢滴加Ⅲ所得溶液”,滤渣b中会混有较多___________ 杂质。
(5)V中MnCO3在空气中灼烧的化学方程式为___________ 。
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
Ⅱ.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
Ⅲ.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
Ⅳ.向Ⅲ所得溶液(pH约为6)中缓慢滴加0.50mol•L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
Ⅴ.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι 中Ag与足量稀HNO3反应生成NO的化学方程式为
(2)H2O2的电子式为
(3)Ⅲ中MnO2溶解的离子方程式为
(4)Ⅳ中,若改为“向0.50mol•L-1Na2CO3溶液中缓慢滴加Ⅲ所得溶液”,滤渣b中会混有较多
(5)V中MnCO3在空气中灼烧的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】1 L某混合溶液,可能含有的离子如下表:
(1)向该溶液中逐滴加入cmol/L NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定含有的离子是______________ 。

(2)根据图象数据计算a=_______________ mL
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①当通入Cl2的体积为5.6L时,溶液中发生反应的离子方程式为______________ 。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________ 。
③x=_________________ mol
| 阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 阴离子 | Cl-、Br-、I-、CO32-、AlO2- |

(2)根据图象数据计算a=
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | x mol(x≠0) | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为
③x=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】为验证卤素单质氧化性的相对强弱,某科学研究小组用如图所示装置进行实验(夹持仪器已略去,气密性以检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞 ,滴加浓盐酸。 Ⅱ.当 B和
,滴加浓盐酸。 Ⅱ.当 B和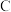 中的溶液都变为黄色时,夹紧弹簧夹。
中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当 B中溶液由黄色变为橙黄色时,关闭活塞a。IV…
(1) 中产生黄绿色气体,其分子式是
中产生黄绿色气体,其分子式是_________ ,反应产生该气体的离子方程式为_________________ 。
(2)验证氯气的氧化性强于碘的实验现象是_____________ 。
(3)B中溶液发生反应的离子方程式是_____________ 。
(4)为验证溴的氧化性强于碘,过程IV的操作是_____________ 。

实验过程:
Ⅰ.打开弹簧夹,打开活塞
 ,滴加浓盐酸。 Ⅱ.当 B和
,滴加浓盐酸。 Ⅱ.当 B和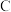 中的溶液都变为黄色时,夹紧弹簧夹。
中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当 B中溶液由黄色变为橙黄色时,关闭活塞a。IV…
(1)
 中产生黄绿色气体,其分子式是
中产生黄绿色气体,其分子式是(2)验证氯气的氧化性强于碘的实验现象是
(3)B中溶液发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程IV的操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某兴趣小组利用如下实验装置制备氯气并检验氯气的性质。
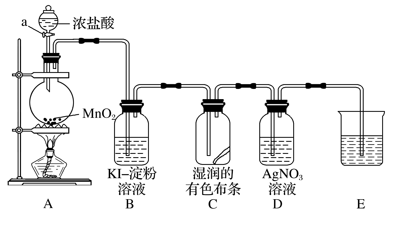
(1)仪器a 的名称是____________ 。
(2)装置A中发生反应的离子方程式为___________________________________ 。
(3)下列说法不正确的是________ (填字母)。
A.装置B中溶液变蓝,说明氯的非金属性强于碘
B.装置C中布条褪色,说明氯气有强氧化性
C.装置D中产生白色沉淀,说明有HCl挥发出来
D.装置E中试剂可以是NaOH溶液,作用是吸收尾气

(1)仪器a 的名称是
(2)装置A中发生反应的离子方程式为
(3)下列说法不正确的是
A.装置B中溶液变蓝,说明氯的非金属性强于碘
B.装置C中布条褪色,说明氯气有强氧化性
C.装置D中产生白色沉淀,说明有HCl挥发出来
D.装置E中试剂可以是NaOH溶液,作用是吸收尾气
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】阅读下列科普短文并填空:
海洋约占地球表面积的 ,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和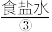 用以生产
用以生产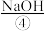 、
、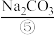 、
、 、
、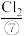 、
、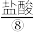 等,苦卤经过氯气氧化,热空气吹出、
等,苦卤经过氯气氧化,热空气吹出、 吸收等一系列操作可获得
吸收等一系列操作可获得 。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
(1)实验室可用_______ 、_______ (填化学式)溶液检验①中的阴离子。
(2)实验室可用MnO2与⑧的浓溶液在加热条件下制取⑦,请写出其离子方程式_______ ,100mL 12 mol·L-1的盐酸溶液与足量的MnO2反应实际生成的气体体积(标准状况下)_______ 6.72L(填“>”、“<”或“=”)。
(3)实验室需要220 mL 0.1 mol·L-1 ⑤的溶液,应该用托盘天平称取Na2CO3·10H2O晶体质量为_______ g;配制溶液所需仪器除烧杯、量筒、玻璃棒、胶头滴管外,还必须用到的一种玻璃仪器为_______ 。
(4)下列操作使配制的溶液物质的量浓度的偏低的是_______。
(5)海水提溴的过程中涉及的反应有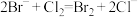 ,
, ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为_______ 。潮湿的Cl2和SO2都具有漂白性,将其混合后其漂白性_______ (填“增强”、“减弱”或“无影响”)
海洋约占地球表面积的
 ,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和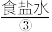 用以生产
用以生产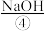 、
、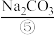 、
、 、
、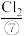 、
、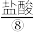 等,苦卤经过氯气氧化,热空气吹出、
等,苦卤经过氯气氧化,热空气吹出、 吸收等一系列操作可获得
吸收等一系列操作可获得 。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。(1)实验室可用
(2)实验室可用MnO2与⑧的浓溶液在加热条件下制取⑦,请写出其离子方程式
(3)实验室需要220 mL 0.1 mol·L-1 ⑤的溶液,应该用托盘天平称取Na2CO3·10H2O晶体质量为
(4)下列操作使配制的溶液物质的量浓度的偏低的是_______。
| A.定容时俯视刻度线 |
| B.转移前,容量瓶内有蒸馏水 |
| C.定容时水加多了用胶头滴管吸出 |
| D.称量是将砝码放在托盘天平的左盘(托盘天平1g以下用游码) |
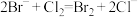 ,
, ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。
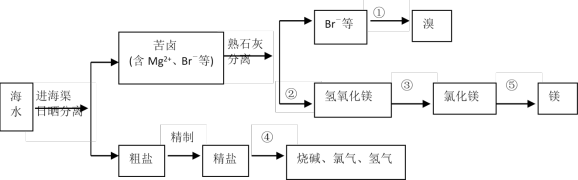
请回答下列问题:
(1)写出①步加入的试剂和有关的离子方程式:_______ ,_______ ;
(2)写出②反应的离子方程式:_______ ;
(3)粗盐精制中,若杂质为CaCl2和Na2SO4,请按合适的除杂步骤顺序,选择相应的试剂,并写出有关反应的化学方程式或离子方程式:试剂:_______ ;反应的离子方程式:_______

请回答下列问题:
(1)写出①步加入的试剂和有关的离子方程式:
(2)写出②反应的离子方程式:
(3)粗盐精制中,若杂质为CaCl2和Na2SO4,请按合适的除杂步骤顺序,选择相应的试剂,并写出有关反应的化学方程式或离子方程式:试剂:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海洋水资源的利用和海水化学资源的利用具有非常广阔的前景:

(1)海水得淡水的主要方法有:_______ 、电渗析法、离子交换法。
(2)粗盐中常常含有 、
、 及一些硫酸盐,提纯过程中,加入试剂的顺序及操作正确的是
及一些硫酸盐,提纯过程中,加入试剂的顺序及操作正确的是_______
A. —NaOH—
—NaOH— —盐酸—过滤—蒸发
—盐酸—过滤—蒸发
B.NaOH— —
— —盐酸—过滤—蒸发
—盐酸—过滤—蒸发
C. —NaOH—
—NaOH— —过滤—盐酸—蒸发
—过滤—盐酸—蒸发
(3)请写出反应④的化学方程式:_______ 。
(4)由 混合物Ⅰ→
混合物Ⅰ→ 混合物Ⅱ的过程是为了
混合物Ⅱ的过程是为了_______ 。
(5)写出 、
、 与含
与含 的混合气体反应的离子方程式:
的混合气体反应的离子方程式:_______ 。
其实,工业上还可以用纯碱溶液吸收过程②吹出来的溴蒸汽:

已知:过程⑤的反应方程式为: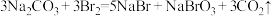
过程⑥的反应方程式为:
(6)从 混合物Ⅰ→
混合物Ⅰ→ 混合物Ⅱ,每生成0.6mol
混合物Ⅱ,每生成0.6mol 时,整个过程转移电子数目为
时,整个过程转移电子数目为_______ 。

(1)海水得淡水的主要方法有:
(2)粗盐中常常含有
 、
、 及一些硫酸盐,提纯过程中,加入试剂的顺序及操作正确的是
及一些硫酸盐,提纯过程中,加入试剂的顺序及操作正确的是A.
 —NaOH—
—NaOH— —盐酸—过滤—蒸发
—盐酸—过滤—蒸发B.NaOH—
 —
— —盐酸—过滤—蒸发
—盐酸—过滤—蒸发C.
 —NaOH—
—NaOH— —过滤—盐酸—蒸发
—过滤—盐酸—蒸发(3)请写出反应④的化学方程式:
(4)由
 混合物Ⅰ→
混合物Ⅰ→ 混合物Ⅱ的过程是为了
混合物Ⅱ的过程是为了(5)写出
 、
、 与含
与含 的混合气体反应的离子方程式:
的混合气体反应的离子方程式:其实,工业上还可以用纯碱溶液吸收过程②吹出来的溴蒸汽:

已知:过程⑤的反应方程式为:
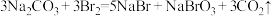
过程⑥的反应方程式为:

(6)从
 混合物Ⅰ→
混合物Ⅰ→ 混合物Ⅱ,每生成0.6mol
混合物Ⅱ,每生成0.6mol 时,整个过程转移电子数目为
时,整个过程转移电子数目为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】几种短周期主族元素的原子半径和元素主要化合价如图所示。
(1)A的简单离子的结构示意图为___________ ;EB是___________ (填“离子”或“共价”)化合物。
(2)AB2分子可与A的简单氢化物反应生成A2和B的氢化物,其反应方程式为___________ 。在标准状况下,生成11.2LA2气体时转移电子数为___________ mol。
(3)D的单质在A2中燃烧的产物和CO2反应的化学方程式为___________ 。
(4)A、B、E的简单离子半径由大到小的顺序为___________ (填离子符号)。
(5)B的单质与A的简单氢化物能发生置换反应,写出化学方程式___________ 。

(1)A的简单离子的结构示意图为
(2)AB2分子可与A的简单氢化物反应生成A2和B的氢化物,其反应方程式为
(3)D的单质在A2中燃烧的产物和CO2反应的化学方程式为
(4)A、B、E的简单离子半径由大到小的顺序为
(5)B的单质与A的简单氢化物能发生置换反应,写出化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:

已知:①亚氯酸钠(NaClO2)受热易分解;
②高浓度的 易爆炸;
易爆炸;
③“反应1”涉及的反应符号表达为 (未配平)。
(未配平)。
回答下列问题:
(1)写出“反应1”涉及的反应离子方程式:_______ ;该反应每生成67.5gClO2需要消耗_______ 克SO2气体,“反应1”需要鼓入空气,空气的作用是_______ 。
(2)“反应2”生成O2、NaClO2和H2O的化学方程式为_______ ,每生成1molO2分子,转移电子的数目为_______ ;“反应2”需要控制反应温度不能过高,温度过高可能导致_______ 。
(3)NaClO2可以通过“冷却结晶”的方式提纯的原因是_______ (从溶解度角度分析)。

已知:①亚氯酸钠(NaClO2)受热易分解;
②高浓度的
 易爆炸;
易爆炸;③“反应1”涉及的反应符号表达为
 (未配平)。
(未配平)。回答下列问题:
(1)写出“反应1”涉及的反应离子方程式:
(2)“反应2”生成O2、NaClO2和H2O的化学方程式为
(3)NaClO2可以通过“冷却结晶”的方式提纯的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,也常用来漂白织物,可通过下列流程得到NaClO2•3H2O:

已知:NaClO2饱和溶液在低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2。
(1)“合成”中发生:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2↑,在该反应中氧化剂是____ 。若生成2 mol ClO2时,电子转移的数目是____ 。
(2)“转化”过程中,H2O2的作用是____ (填“氧化剂”或“还原剂”)。将得到的NaClO2溶液进行蒸发浓缩,____ ,过滤洗涤,得到NaClO2•3H2O。
(3)为确定样品的纯度,某课外兴趣活动小组进行如下实验:
步骤一:取10.00 g NaClO2样品,用适量蒸馏水溶解后,加入略过量的KI溶液,充分反应。
步骤二:将反应液定容至200 mL,取出20.00 mL于锥形瓶。向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1 Na2S2O3溶液与之反应。
步骤三:重复以上操作2~3次,测得平均消耗Na2S2O3溶液22.00 mL。(所需的关系式:NaClO2 ~ 4I- ~ 2I2 ~ 4Na2S2O3)该NaClO2样品的纯度是____ (写出计算过程)。

已知:NaClO2饱和溶液在低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2。
(1)“合成”中发生:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2↑,在该反应中氧化剂是
(2)“转化”过程中,H2O2的作用是
(3)为确定样品的纯度,某课外兴趣活动小组进行如下实验:
步骤一:取10.00 g NaClO2样品,用适量蒸馏水溶解后,加入略过量的KI溶液,充分反应。
步骤二:将反应液定容至200 mL,取出20.00 mL于锥形瓶。向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1 Na2S2O3溶液与之反应。
步骤三:重复以上操作2~3次,测得平均消耗Na2S2O3溶液22.00 mL。(所需的关系式:NaClO2 ~ 4I- ~ 2I2 ~ 4Na2S2O3)该NaClO2样品的纯度是
您最近一年使用:0次



