阅读下列科普短文并填空:
海洋约占地球表面积的 ,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和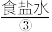 用以生产
用以生产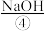 、
、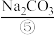 、
、 、
、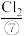 、
、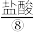 等,苦卤经过氯气氧化,热空气吹出、
等,苦卤经过氯气氧化,热空气吹出、 吸收等一系列操作可获得
吸收等一系列操作可获得 。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
(1)实验室可用_______ 、_______ (填化学式)溶液检验①中的阴离子。
(2)实验室可用MnO2与⑧的浓溶液在加热条件下制取⑦,请写出其离子方程式_______ ,100mL 12 mol·L-1的盐酸溶液与足量的MnO2反应实际生成的气体体积(标准状况下)_______ 6.72L(填“>”、“<”或“=”)。
(3)实验室需要220 mL 0.1 mol·L-1 ⑤的溶液,应该用托盘天平称取Na2CO3·10H2O晶体质量为_______ g;配制溶液所需仪器除烧杯、量筒、玻璃棒、胶头滴管外,还必须用到的一种玻璃仪器为_______ 。
(4)下列操作使配制的溶液物质的量浓度的偏低的是_______。
(5)海水提溴的过程中涉及的反应有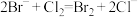 ,
, ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为_______ 。潮湿的Cl2和SO2都具有漂白性,将其混合后其漂白性_______ (填“增强”、“减弱”或“无影响”)
海洋约占地球表面积的
 ,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和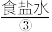 用以生产
用以生产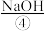 、
、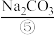 、
、 、
、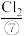 、
、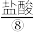 等,苦卤经过氯气氧化,热空气吹出、
等,苦卤经过氯气氧化,热空气吹出、 吸收等一系列操作可获得
吸收等一系列操作可获得 。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。(1)实验室可用
(2)实验室可用MnO2与⑧的浓溶液在加热条件下制取⑦,请写出其离子方程式
(3)实验室需要220 mL 0.1 mol·L-1 ⑤的溶液,应该用托盘天平称取Na2CO3·10H2O晶体质量为
(4)下列操作使配制的溶液物质的量浓度的偏低的是_______。
| A.定容时俯视刻度线 |
| B.转移前,容量瓶内有蒸馏水 |
| C.定容时水加多了用胶头滴管吸出 |
| D.称量是将砝码放在托盘天平的左盘(托盘天平1g以下用游码) |
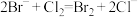 ,
, ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为
更新时间:2022-01-19 10:55:20
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】I.海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程r如下:
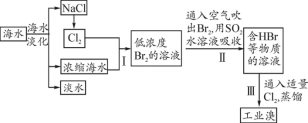
(1)步骤Ⅰ获得Br2的化学反应的离子方程式为___________ 。
(2)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为___________ 。在该反应中,氧化剂是___________ (填化学式);若反应中生成2 mol HBr,则消耗___________ mol SO2。
(3)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是___________ 。
II.A是一种重要的化工原料,部分性质及转化关系如下图:

请回答。
(4)D中官能团的名称是___________ 。
(5)A→B的反应类型是___________。
(6)写出A→C反应的化学方程式:___________ 。

(1)步骤Ⅰ获得Br2的化学反应的离子方程式为
(2)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为
(3)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
II.A是一种重要的化工原料,部分性质及转化关系如下图:

请回答。
(4)D中官能团的名称是
(5)A→B的反应类型是___________。
| A.取代反应 | B.加成反应 | C.氧化反应 | D.还原反应 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氧化还原反应与离子反应在生产生活与科学实验中有重要作用,回答下列问题。
I.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.
B.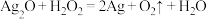
C.
D.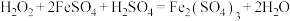
(1)上述反应中,H2O2仅体现氧化性的反应是_______ (填字母序号,下同),H2O2既体现氧化性又体现还原性的反应是_______ ,H2O2、Ag2O、Fe2(SO4)3的氧化性由强到弱的顺序是_______ 。
(2)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒: 、
、 、
、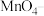 、
、 、
、 、
、 ,则反应的离子方程式为
,则反应的离子方程式为_______
Ⅱ.有一包固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③另取①中过滤后的滤液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(3)原固体粉末中一定含有的物质是_______ ,一定不含有的物质是_______ ,可能含有的物质是_______ 。(写化学式)
(4)写出对应各步反应的离子方程式:①_______ ;②_______ 。
I.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.

B.
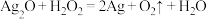
C.

D.
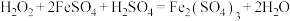
(1)上述反应中,H2O2仅体现氧化性的反应是
(2)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
 、
、 、
、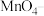 、
、 、
、 、
、 ,则反应的离子方程式为
,则反应的离子方程式为Ⅱ.有一包固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③另取①中过滤后的滤液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(3)原固体粉末中一定含有的物质是
(4)写出对应各步反应的离子方程式:①
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验小组探究 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。
已知:ⅰ. 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ⅱ.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;
ⅲ. 与
与 发生反应:
发生反应: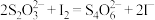
(1)实验1-1的目的是___________ ;
(2)实验1-2中 与KI反应的离子方程式为
与KI反应的离子方程式为___________ ;
为了探究 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
(3)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1: 先与
先与 反应,使
反应,使 降低;
降低;
猜想2: 先与KI反应,___________。
先与KI反应,___________。
①甲同学提出猜想1的依据:由信息ⅲ推测, 的还原性
的还原性___________ (填“强于”或“弱于”)KI的;
②乙同学根据现有数据证明猜想1不成立,理由是实验2-2与 完全反应后的溶液中
完全反应后的溶液中
___________ 2-1中起始 ,溶液应立即变蓝(填“高于”或“低于”);
,溶液应立即变蓝(填“高于”或“低于”);
③补全猜想2:___________ ;
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率
___________  (列出计算式);
(列出计算式);
(5)实验2-2中,30s内未检测到 与
与 反应,可能的原因是
反应,可能的原因是___________ (写出两条)。
 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。已知:ⅰ.
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ⅱ.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;ⅲ.
 与
与 发生反应:
发生反应: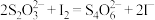
| 编号 | 1-1 | 1-2 |
| 实验操作 | 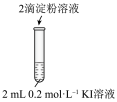 | 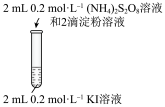 |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(1)实验1-1的目的是
(2)实验1-2中
 与KI反应的离子方程式为
与KI反应的离子方程式为为了探究
 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表| 编号 |  KI溶液/mL KI溶液/mL |   溶液/mL 溶液/mL | 蒸馏水/mL | 0.4%淀粉溶液/滴 |   溶液/mL 溶液/mL | 变色时间/s |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 2 | 30 |
(3)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:
 先与
先与 反应,使
反应,使 降低;
降低;猜想2:
 先与KI反应,___________。
先与KI反应,___________。①甲同学提出猜想1的依据:由信息ⅲ推测,
 的还原性
的还原性②乙同学根据现有数据证明猜想1不成立,理由是实验2-2与
 完全反应后的溶液中
完全反应后的溶液中
 ,溶液应立即变蓝(填“高于”或“低于”);
,溶液应立即变蓝(填“高于”或“低于”);③补全猜想2:
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率

 (列出计算式);
(列出计算式);(5)实验2-2中,30s内未检测到
 与
与 反应,可能的原因是
反应,可能的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,某学习小组在实验室中利用如图所示装置制备Hg(NH2)Cl,回答下列问题:

(1)A装置中装浓盐酸的仪器名称为____________ 。
(2)C装置中的试剂是____________ (填名称)。
(3)实验结束后,D装置中生成了固体氯化氨基汞,请写出D装置中生成氯化氨基汞反应的化学方程式:______ 。D装置采用长短不同的导管的原因是_________ 。
(4)E装置中装入的固体可以是______ (填标号)。
a.CaO b.碱石灰 c.P2O5 d.CaCl2
(5)该实验的不足之处是________ 。
(6)样品中氯化氨基汞的含量测定:称取0.55g样品,加入水及稀硫酸溶解,向溶解后的溶液中加入0.1 mol·L-1的KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知:Hg2++2I-=HgI2↓(橙红色),HgI2+2I-=HgI (无色)],共消耗80.00 mL KI溶液。则样品中氯化氨基汞的质量分数为
(无色)],共消耗80.00 mL KI溶液。则样品中氯化氨基汞的质量分数为____________ (保留三位有效数字)。

(1)A装置中装浓盐酸的仪器名称为
(2)C装置中的试剂是
(3)实验结束后,D装置中生成了固体氯化氨基汞,请写出D装置中生成氯化氨基汞反应的化学方程式:
(4)E装置中装入的固体可以是
a.CaO b.碱石灰 c.P2O5 d.CaCl2
(5)该实验的不足之处是
(6)样品中氯化氨基汞的含量测定:称取0.55g样品,加入水及稀硫酸溶解,向溶解后的溶液中加入0.1 mol·L-1的KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知:Hg2++2I-=HgI2↓(橙红色),HgI2+2I-=HgI
 (无色)],共消耗80.00 mL KI溶液。则样品中氯化氨基汞的质量分数为
(无色)],共消耗80.00 mL KI溶液。则样品中氯化氨基汞的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) SO2Cl2(l)△H=-97.3 kJ· mol-1
SO2Cl2(l)△H=-97.3 kJ· mol-1
反应装置如图所示(夹持仪器已省略),请回答有关问题:
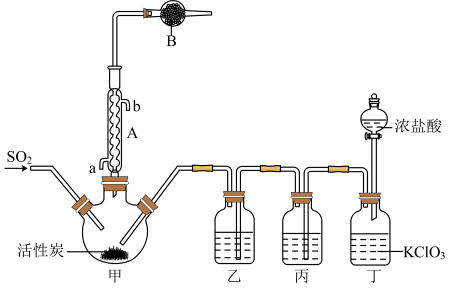
(1)仪器B的名称为________ ;
(2)仪器A的作用是_______ ;
(3)装置乙中盛放的试剂为______ ,在实验室用氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为______ ;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______ (填序号);
①先通冷凝水,再通气体②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为____ 。
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由____ 。
| 物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②100℃以上易分解SO2和Cl2 |
| H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
 SO2Cl2(l)△H=-97.3 kJ· mol-1
SO2Cl2(l)△H=-97.3 kJ· mol-1反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的名称为
(2)仪器A的作用是
(3)装置乙中盛放的试剂为
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有
①先通冷凝水,再通气体②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用下图所示装置在实验室制取纯净、干燥的Cl2并探究其性质,回答下列问题:
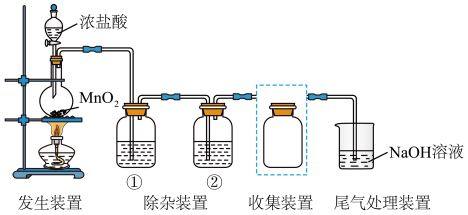
(1)发生装置中制取Cl2,的化学方程式是_______ 。
(2)除杂装置①中的试剂是_______ ;装置②中的试剂是_______ 。
(3)将虚线框中的收集装置补充完整_______ 。
(4)尾气处理装置中发生反应的离子方程式是_______ 。
(5)将充分吸收了尾气之后的吸收液拿来做实验,向吸收液中滴加盐酸,产生了有刺激性气味的气体,写出该反应的离子方程式_______ 。
(6)将制得的Cl2溶于水得到氯水。在探究新制氯水成分及性质的实验中,依据下列操作和现象不能 得出相应结论的是_______ 。(填字母)。
(7)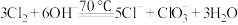 中,还原剂和氧化剂的物质的量之比为
中,还原剂和氧化剂的物质的量之比为_______ 。

(1)发生装置中制取Cl2,的化学方程式是
(2)除杂装置①中的试剂是
(3)将虚线框中的收集装置补充完整
(4)尾气处理装置中发生反应的离子方程式是
(5)将充分吸收了尾气之后的吸收液拿来做实验,向吸收液中滴加盐酸,产生了有刺激性气味的气体,写出该反应的离子方程式
(6)将制得的Cl2溶于水得到氯水。在探究新制氯水成分及性质的实验中,依据下列操作和现象
| 操作 | 现象 | 结论 | |
| a | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
| b | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
| c | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
| d | 向淀粉碘化钾试纸上滴加少量氯水 | 试纸变蓝 | 氯水具有氧化性 |
(7)
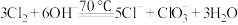 中,还原剂和氧化剂的物质的量之比为
中,还原剂和氧化剂的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2mol/L的NaClO溶液,欲用NaClO固体配制该溶液。
(1)计算所需NaClO固体的质量为________ g。
(2)配制溶液时,下图不需要的仪器是________ (写仪器名称)。
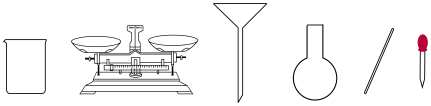
(3)写出配制溶液时的正确操作顺序(用字母表示,每个字母只能用一次)________ 。
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是________(填序号)。
Ⅱ.某班同学通过实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(5)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生反应的离子方程式是________ 。
(6)甲组同学取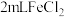 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为________ 。
(7)乙组同学认为甲组的实验不够严谨,该组同学在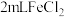 溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:
溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:________ 。
(8)向 溶液中滴加NaOH溶液,现象是
溶液中滴加NaOH溶液,现象是________ ;沉淀变色的原因是________ (用化学方程式解释)。
(1)计算所需NaClO固体的质量为
(2)配制溶液时,下图不需要的仪器是

(3)写出配制溶液时的正确操作顺序(用字母表示,每个字母只能用一次)
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是________(填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.某班同学通过实验探究
 、
、 的性质。回答下列问题:
的性质。回答下列问题:(5)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生反应的离子方程式是
(6)甲组同学取
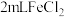 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(7)乙组同学认为甲组的实验不够严谨,该组同学在
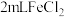 溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:
溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:(8)向
 溶液中滴加NaOH溶液,现象是
溶液中滴加NaOH溶液,现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室用固体烧碱配制0.5mol/L的NaOH溶液490mL,用质量分数为98%,密度为1.84 g/cm3的浓硫酸配制0.6mol/L的硫酸溶液500mL。请回答下列问题:
(1)计算需要NaOH固体质量_________ g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器_________ (填序号),还缺少的仪器是___________ 。
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______ mL,如果实验室有15mL、20mL、50mL量筒,应选用__________ mL量筒最好。
(4)配制过程中,下列操作会引起结果偏高的是__________ (填序号)
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
(1)计算需要NaOH固体质量
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
(4)配制过程中,下列操作会引起结果偏高的是
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室现需配制物质的量浓度为 1 mol/L 的 NaOH 溶液 480 mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用________ 滴加蒸馏水至凹液面与刻度线相切。上述步骤的正确操作顺序是________ 。
(2)使用________ mL的容量瓶配制此溶液,需要称量NaOH固体的质量为________ g。
(3)下列操作会使所配制溶液浓度偏小的有________ 。
A 容量瓶中原有少量蒸馏水
B 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C 定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D 定容时,俯视观察液面
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用
(2)使用
(3)下列操作会使所配制溶液浓度偏小的有
A 容量瓶中原有少量蒸馏水

B 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C 定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线

D 定容时,俯视观察液面
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
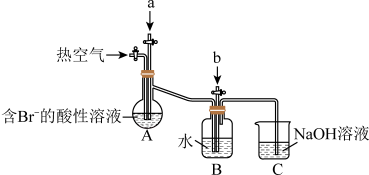
【推荐1】工业以浓缩海水为原料提取溴的部分过程如图:
(1)反应过程中,B装置中Br2与SO2反应的化学方程式:___________ 。
(2)C装置的作用是___________ 。
(3)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用___________ 方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是___________ 。
(4)Cl2分子中含有的化学键有___________ (填“离子键”、“极性键”或“非极性键”);实验室制取Cl2的离子方程式:___________ 。
(1)反应过程中,B装置中Br2与SO2反应的化学方程式:
(2)C装置的作用是
(3)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是
(4)Cl2分子中含有的化学键有
您最近一年使用:0次
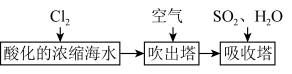
【推荐2】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称。空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图:

(1)步骤①中获得 的离子方程式为
的离子方程式为_______ 。
(2)根据上述反应可判断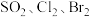 氧化性由强到弱的顺序
氧化性由强到弱的顺序_______ 。
(3)步骤③中完全吸收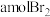 共有
共有_______ 个电子转移(用a和 的代数式表示)。
的代数式表示)。

(1)步骤①中获得
 的离子方程式为
的离子方程式为(2)根据上述反应可判断
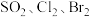 氧化性由强到弱的顺序
氧化性由强到弱的顺序(3)步骤③中完全吸收
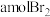 共有
共有 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】浙江海洋经济发展示范区建设已上升为国家战略,海洋经济将成为浙江经济转型升级发展的重点。请回答下列问题:
(1)被称作海洋元素的是_________ (写元素符号)。
(2)工业上常以食盐为原料制备氯气,请写出化学方程式_______________________ 。
(3)从海水中提取食盐和溴的过程如下:
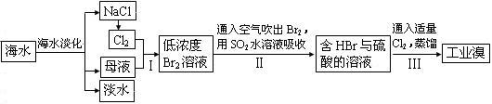
①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅰ的离子方程式:_____________________ ,
步骤Ⅱ的化学方程式:________________________ 。
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图中_____________ 。
(1)被称作海洋元素的是
(2)工业上常以食盐为原料制备氯气,请写出化学方程式
(3)从海水中提取食盐和溴的过程如下:

①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅰ的离子方程式:
步骤Ⅱ的化学方程式:
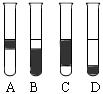
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图中

您最近一年使用:0次



