I.氢气是一种清洁能源,水煤气变换反应的制氢原理为: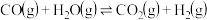
 ,回答下列问题:
,回答下列问题:
(1)水煤气变换部分基元反应如下:
第②步基元反应逆反应的活化能为___________ eV。
(2)某研究所探究CuO/ 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:___________ 。
②C/Z-120曲线先上升后下降的原因___________ 。
II.长征运载火箭推进剂为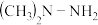 和
和 。
。
(3)在t℃、pMPa下,将 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①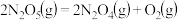 ,②
,②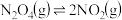 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
___________ MPa。
(4)T℃时,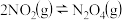 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: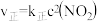 ,
,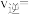
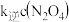 (
( 、
、 这是速率常数)。
这是速率常数)。
①图中表示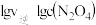 的线是
的线是___________ (填“m”或“n”) 气体,平衡后测得
气体,平衡后测得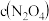 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=________ (用含a的表达式表示)。
③T℃时,向2L的容器中充入5mol 气体和1mol
气体和1mol 气体,此时
气体,此时
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
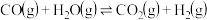
 ,回答下列问题:
,回答下列问题:(1)水煤气变换部分基元反应如下:
| 基元反应 | 活化能Ea(eV) | 反应热△H(eV) |
①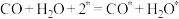 | 0 | -1.73 |
② | 0.81 | -0.41 |
(2)某研究所探究CuO/
 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图: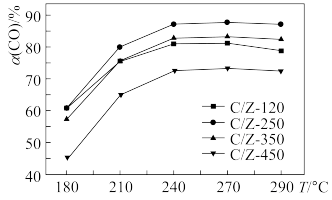
②C/Z-120曲线先上升后下降的原因
II.长征运载火箭推进剂为
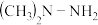 和
和 。
。(3)在t℃、pMPa下,将
 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①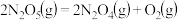 ,②
,②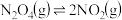 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
(4)T℃时,
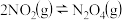 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: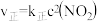 ,
,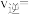
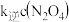 (
( 、
、 这是速率常数)。
这是速率常数)。①图中表示
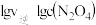 的线是
的线是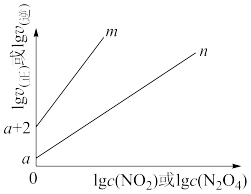
 气体,平衡后测得
气体,平衡后测得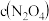 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=③T℃时,向2L的容器中充入5mol
 气体和1mol
气体和1mol 气体,此时
气体,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
2022·山东日照·一模 查看更多[4]
山东省日照市 2022届高三第一次模拟考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(山东专用)福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
更新时间:2022-03-06 09:28:25
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】研发CO2、NO利用技术,降低空气中CO2、NO含量成为研究热点。
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)ΔH1=-156.9 kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1 kJ·mol-1
已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-395.6 kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=___________ 。
(2)利用电化学方法通过微生物电催化可将CO2有效地转化为H2C2O4,装置如图所示,阴极的电极反应式为___________ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因___________ 。___________ 。___________ 。
② 其他条件相同,等离子体的电功率与NO转化率的关系如图所示,当电功率大于30 W时,NO转化率下降的原因可能是___________ 。
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)ΔH1=-156.9 kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1 kJ·mol-1
已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-395.6 kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=
(2)利用电化学方法通过微生物电催化可将CO2有效地转化为H2C2O4,装置如图所示,阴极的电极反应式为

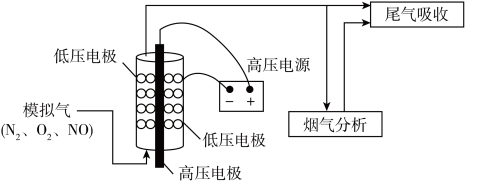
② 其他条件相同,等离子体的电功率与NO转化率的关系如图所示,当电功率大于30 W时,NO转化率下降的原因可能是

您最近一年使用:0次
【推荐2】我国力争于2030年前做到碳达峰,2060年前实现碳中和。 与
与 重整是
重整是 利用的研究热点之一、该重整反应体系主要涉及以下反应:
利用的研究热点之一、该重整反应体系主要涉及以下反应:
(a)

(b)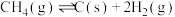

(c)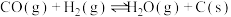

(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
(2)一定条件下, 分解形成碳的反应历程如图所示。该历程分
分解形成碳的反应历程如图所示。该历程分_______ 步进行,其中,第_______ 步的正反应活化能最大。

(3)设 为压力平衡常数,反应a、b、c的
为压力平衡常数,反应a、b、c的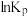 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
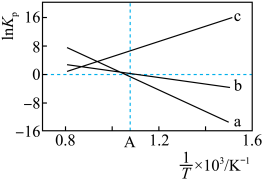
①反应a、b、c中,属于吸热反应的有_______ (填字母)。
②反应b的相对压力平衡常数表达式为
_______ 。
③在图中A点对应温度下、原料组成为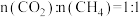 、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时
、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时 的分压为4kPa。计算
的分压为4kPa。计算 的平衡转化率
的平衡转化率_______ 。
(4) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:_______ 。
 与
与 重整是
重整是 利用的研究热点之一、该重整反应体系主要涉及以下反应:
利用的研究热点之一、该重整反应体系主要涉及以下反应:(a)


(b)
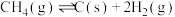

(c)
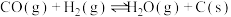

(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
A.增大 与 与 的浓度,反应a、b、c的正反应速率都增加 的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应a、b、c的平衡均向右移动 |
C.加入反应a的催化剂,可提高 的平衡转化率 的平衡转化率 |
| D.降低反应温度,反应a~c的正、逆反应速率都减小 |
 分解形成碳的反应历程如图所示。该历程分
分解形成碳的反应历程如图所示。该历程分
(3)设
 为压力平衡常数,反应a、b、c的
为压力平衡常数,反应a、b、c的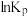 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应a、b、c中,属于吸热反应的有
②反应b的相对压力平衡常数表达式为

③在图中A点对应温度下、原料组成为
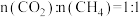 、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时
、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时 的分压为4kPa。计算
的分压为4kPa。计算 的平衡转化率
的平衡转化率(4)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】根据已知,回答下列问题。
(1)在25℃、101kPa下,1g甲烷燃烧生成 和液态水时放热55.6kJ,则表示甲烷燃烧热的热化学方程式为
和液态水时放热55.6kJ,则表示甲烷燃烧热的热化学方程式为_______ 。
(2)金刚石和石墨燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨中_______ (填“金刚石”或“石墨”)更稳定。
②已知: 、
、 分子中化学键的键能分别是946
分子中化学键的键能分别是946 、497
、497 ,
,
 ,NO分子中化学键的键能为
,NO分子中化学键的键能为_______  。
。
(3)
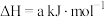 ,反应过程的能量变化如图所示,已知1mol
,反应过程的能量变化如图所示,已知1mol  (g)完全转化为lmol
(g)完全转化为lmol  (g)放热99kJ。请回答:
(g)放热99kJ。请回答:

①a=_______  。
。
② 的大小对该反应的△H
的大小对该反应的△H_______ (填“有”或“无”)影响。该反应常用 作催化剂,加入
作催化剂,加入 会使图中B点
会使图中B点_______ (填“升高”、“降低”或“不变”)
(4)由盖斯定律结合下述反应方程式,回答问题:
已知:①
 ;
;
②
 ;
;
③
 ;
;
则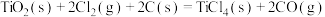 的ΔH=
的ΔH=_______ 。(列出关于 、
、 、
、 的表达式)
的表达式)
(1)在25℃、101kPa下,1g甲烷燃烧生成
 和液态水时放热55.6kJ,则表示甲烷燃烧热的热化学方程式为
和液态水时放热55.6kJ,则表示甲烷燃烧热的热化学方程式为(2)金刚石和石墨燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨中
②已知:
 、
、 分子中化学键的键能分别是946
分子中化学键的键能分别是946 、497
、497 ,
,
 ,NO分子中化学键的键能为
,NO分子中化学键的键能为 。
。(3)

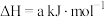 ,反应过程的能量变化如图所示,已知1mol
,反应过程的能量变化如图所示,已知1mol  (g)完全转化为lmol
(g)完全转化为lmol  (g)放热99kJ。请回答:
(g)放热99kJ。请回答:
①a=
 。
。②
 的大小对该反应的△H
的大小对该反应的△H 作催化剂,加入
作催化剂,加入 会使图中B点
会使图中B点(4)由盖斯定律结合下述反应方程式,回答问题:
已知:①

 ;
;②

 ;
;③

 ;
;则
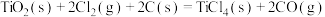 的ΔH=
的ΔH= 、
、 、
、 的表达式)
的表达式)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】重要的化工原料丁烯(C4H8)可由丁烷(C4H10)催化脱氢制备,反应如下:
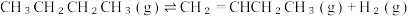 △H
△H
已知:i.该工艺过程的副产物有炭(C),生成的积炭会附着在催化剂表面,影响催化效果。
ii.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii.CH2=CHCH2CH3(g)+6O2 (g)=4CO2 (g)+4H2O(l) △H1
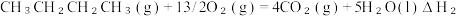
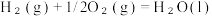 △H3
△H3
(1)用△H1、△H2、△H3表示丁烷催化脱氢反应的反应热△H=_______ 。
(2)寻找高效的催化剂是脱氢反应重要的研究课题之一、
①催化剂使用 段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是_______ 。
②其他条件相同时,以SiO₂为载体与不同质量百分比的CrOx组合,催化效果相关数据如表。
下列说法正确的是_______ (填序号)。[收率=(生成某产物的原料量/投入的原料量)×100%]
a.脱氢反应中SiO2不起催化作用 b. CrOx的含量越高,反应的催化效果越好
c. CrOx的含量对丁烷脱氢反应的焓变有影响 d. 正丁烯收率越高,则原料的利用率越高
(3)其他条件相同,30min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。
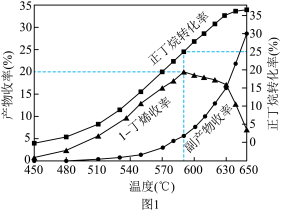
① 实际生产温度选择590℃, 由图1说明其理由是_______ 。
②590℃时,向体积为 1L 的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为_______ mol/(L·min)。
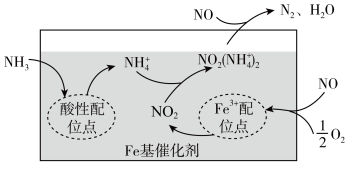
(4)利用电解装置可以将尾气中的 NO 转化为尿素[CO(NH2) 2,其中碳的化合价为+4 价,属于非电解质],工作原理如图2所示。
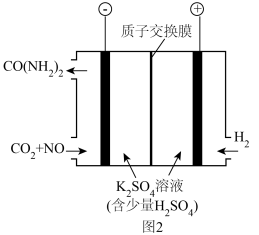
①阴极的电极反应式为_______ 。
②反应 段时间后,阳极区的pH基本不变,结合化学用语解释原因为_______ 。
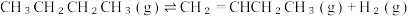 △H
△H已知:i.该工艺过程的副产物有炭(C),生成的积炭会附着在催化剂表面,影响催化效果。
ii.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii.CH2=CHCH2CH3(g)+6O2 (g)=4CO2 (g)+4H2O(l) △H1
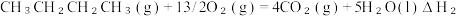
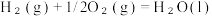 △H3
△H3(1)用△H1、△H2、△H3表示丁烷催化脱氢反应的反应热△H=
(2)寻找高效的催化剂是脱氢反应重要的研究课题之一、
①催化剂使用 段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是
②其他条件相同时,以SiO₂为载体与不同质量百分比的CrOx组合,催化效果相关数据如表。
| 实验组 | 催化剂组成 | 正丁烷转化率 /% | 正丁烯收率 /% |
| 1 | 无催化剂 | 5 | 0.35 |
| 2 | SiO2 | 5 | 0.35 |
| 3 | SiO2+9%CrOx | 25.5 | 18.3 |
| 4 | SiO2+15% CrOx | 27.5 | 20.65 |
| 5 | SiO2+21%CrOx | 24 | 17.87 |
a.脱氢反应中SiO2不起催化作用 b. CrOx的含量越高,反应的催化效果越好
c. CrOx的含量对丁烷脱氢反应的焓变有影响 d. 正丁烯收率越高,则原料的利用率越高
(3)其他条件相同,30min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。

① 实际生产温度选择590℃, 由图1说明其理由是
②590℃时,向体积为 1L 的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为
(4)利用电解装置可以将尾气中的 NO 转化为尿素[CO(NH2) 2,其中碳的化合价为+4 价,属于非电解质],工作原理如图2所示。

①阴极的电极反应式为
②反应 段时间后,阳极区的pH基本不变,结合化学用语解释原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】炼油、石化等工业会产生含硫( 价)废水,处理的方法有沉淀法、氧化法。
价)废水,处理的方法有沉淀法、氧化法。
(1)沉淀法。用如图1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如图2所示。
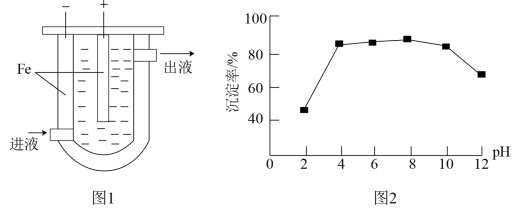
①该装置沉淀废水中的硫的原理可描述为_______ 。
②pH<4时,pH越小,硫转化为FeS的沉淀率越低,原因是_______ 。
(2)氧化法。 氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。
氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。
① 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:
溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:_______ 。
②H2O2氧化法:向含 的废水中,加入H2O2溶液,其他条件一定,测得硫(
的废水中,加入H2O2溶液,其他条件一定,测得硫( 价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是
价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是_______ 。

③催化氧化法:MnO2-苯胺(MnO2为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫( 价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。
价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。

a.转化Ⅰ中化合价发生变化的元素有_______ 。
b.催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(CHCl3)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是_______ 。
 价)废水,处理的方法有沉淀法、氧化法。
价)废水,处理的方法有沉淀法、氧化法。(1)沉淀法。用如图1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如图2所示。

①该装置沉淀废水中的硫的原理可描述为
②pH<4时,pH越小,硫转化为FeS的沉淀率越低,原因是
(2)氧化法。
 氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。
氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。①
 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:
溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:②H2O2氧化法:向含
 的废水中,加入H2O2溶液,其他条件一定,测得硫(
的废水中,加入H2O2溶液,其他条件一定,测得硫( 价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是
价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是
③催化氧化法:MnO2-苯胺(MnO2为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(
 价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。
价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。
a.转化Ⅰ中化合价发生变化的元素有
b.催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(CHCl3)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】(1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是:_______________ 、 _________________
(1)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:____________
 MnO4- +
MnO4- + H+ +
H+ + C2O42-=
C2O42-=  Mn2+ +
Mn2+ + CO2 ↑+
CO2 ↑+ H2O
H2O
该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:_______________________________________________________________
(3)反应3Fe(s)+4H2O(g)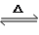 Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
①此反应的平衡常数表达式为___________________ 。若使平衡常数增大,可采取的措施是____________________ 。
②保持压强不变,充入N2,其正反应速率_________ ,(填“增大”、“不变”、“减小”)逆反应速率___________ 。(填“增大”、“不变”、“减小”)
(1)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:
 MnO4- +
MnO4- + H+ +
H+ + C2O42-=
C2O42-=  Mn2+ +
Mn2+ + CO2 ↑+
CO2 ↑+ H2O
H2O 该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:
(3)反应3Fe(s)+4H2O(g)
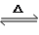 Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:①此反应的平衡常数表达式为
②保持压强不变,充入N2,其正反应速率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)已知反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2。
FeO(s)+H2(g) ΔH2,平衡常数为K2。
在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=____ (用ΔH1和ΔH2表示),K=______ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是____ (填“吸热”或“放热”)反应。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:

①该条件下反应的平衡常数为____ ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO的浓度为____ mol·L-1。
②下列措施中能使平衡时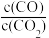 增大的是
增大的是___ (填字母)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
 FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
 FeO(s)+H2(g) ΔH2,平衡常数为K2。
FeO(s)+H2(g) ΔH2,平衡常数为K2。在不同温度时K1、K2的值如下表:
| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH= CO(g)+H2O(g)是
CO(g)+H2O(g)是(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为
②下列措施中能使平衡时
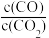 增大的是
增大的是A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】铬(Ⅵ)化合物主要有氧化物( )、含氧酸盐(
)、含氧酸盐( 和
和 )、氯化铬酰(
)、氯化铬酰( ),其中又以重铬酸钾(俗称红矾钾)和重铬酸钠(俗称红矾钠)最为重要。回答下列问题:
),其中又以重铬酸钾(俗称红矾钾)和重铬酸钠(俗称红矾钠)最为重要。回答下列问题:
(1) 中阳离子的结构示意图为
中阳离子的结构示意图为___________ 。
(2)在碱性条件下,亚铬酸盐( )可被
)可被 氧化为
氧化为___________ (填“ ”或“
”或“ ”),生成该离子的原因是
”),生成该离子的原因是___________ (用离子方程式表示)。
(3)298K时,将50mLx
 ,、50mL3x
,、50mL3x
 和50mL
和50mL 溶液混合,发生反应:
溶液混合,发生反应: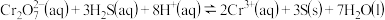 。溶液中
。溶液中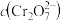 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
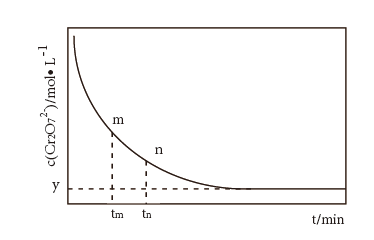
下列可判断反应达到平衡的是___________ (填序号)。
a.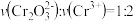 b.溶液的颜色不再变化
b.溶液的颜色不再变化
c. d.生成的S的质量不再变化
d.生成的S的质量不再变化
②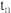 时,
时,
___________ 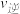 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
③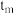 时,
时,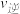
___________ 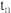 时
时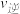 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
④若平衡时溶液的 ,则该反应的平衡常数K为
,则该反应的平衡常数K为___________ 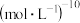 (列出计算式即可)。
(列出计算式即可)。
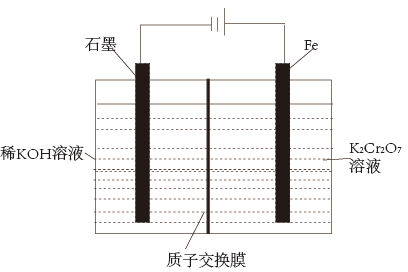
(4)Cr(Ⅵ)的化合物都有较大毒性,是Cr(Ⅲ)毒性的100倍。某实验室模拟处理含Cr(Ⅵ)废水的电解装置如图所示。一段时间后,阳极产生的沉淀有 和
和___________ 。
 )、含氧酸盐(
)、含氧酸盐( 和
和 )、氯化铬酰(
)、氯化铬酰( ),其中又以重铬酸钾(俗称红矾钾)和重铬酸钠(俗称红矾钠)最为重要。回答下列问题:
),其中又以重铬酸钾(俗称红矾钾)和重铬酸钠(俗称红矾钠)最为重要。回答下列问题:(1)
 中阳离子的结构示意图为
中阳离子的结构示意图为(2)在碱性条件下,亚铬酸盐(
 )可被
)可被 氧化为
氧化为 ”或“
”或“ ”),生成该离子的原因是
”),生成该离子的原因是(3)298K时,将50mLx

 ,、50mL3x
,、50mL3x
 和50mL
和50mL 溶液混合,发生反应:
溶液混合,发生反应: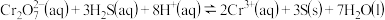 。溶液中
。溶液中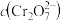 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
下列可判断反应达到平衡的是
a.
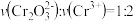 b.溶液的颜色不再变化
b.溶液的颜色不再变化c.
 d.生成的S的质量不再变化
d.生成的S的质量不再变化②
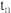 时,
时,
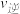 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。③
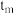 时,
时,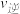
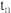 时
时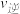 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。④若平衡时溶液的
 ,则该反应的平衡常数K为
,则该反应的平衡常数K为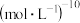 (列出计算式即可)。
(列出计算式即可)。(4)Cr(Ⅵ)的化合物都有较大毒性,是Cr(Ⅲ)毒性的100倍。某实验室模拟处理含Cr(Ⅵ)废水的电解装置如图所示。一段时间后,阳极产生的沉淀有
 和
和
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】合成氨工艺是利用氢气的一种重要的途径。
N2和H2生成NH3的反应为: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)△H(298K)=-46.2kJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g)△H(298K)=-46.2kJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H* NH*;NH*+H*
NH*;NH*+H* NH2*;NH2*+H*
NH2*;NH2*+H* NH3*
NH3*
脱附:NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有____ 。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数Kθ=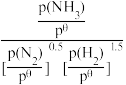 其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1∶3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则Kθ=____ (用含w的最简式表示)
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是___ 。

(3)实际生产中,常用工艺条件为Fe作催化剂、控制温度773K、压强3.0 105Pa,原料中N2和H2物质的量之比为1∶2.8。
105Pa,原料中N2和H2物质的量之比为1∶2.8。
①分析说明原料气中N2过量的理由___ 。
②关于合成氨工艺的下列理解,正确的是___ 。
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和较快的化学反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
N2和H2生成NH3的反应为:
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)△H(298K)=-46.2kJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g)△H(298K)=-46.2kJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H*
 NH*;NH*+H*
NH*;NH*+H* NH2*;NH2*+H*
NH2*;NH2*+H* NH3*
NH3*脱附:NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数Kθ=
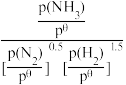 其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。①N2和H2起始物质的量之比为1∶3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则Kθ=
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是

(3)实际生产中,常用工艺条件为Fe作催化剂、控制温度773K、压强3.0
 105Pa,原料中N2和H2物质的量之比为1∶2.8。
105Pa,原料中N2和H2物质的量之比为1∶2.8。①分析说明原料气中N2过量的理由
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和较快的化学反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
您最近一年使用:0次



