降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的 作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
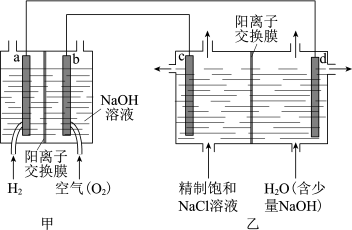

①乙装置中电解饱和 溶液的化学方程式为
溶液的化学方程式为_______ ;反应一段时间后,d极产生 气体时,乙装置中转移电子
气体时,乙装置中转移电子_______  。
。
②下列说法正确的是_______ (填字母序号)。
A.甲装置可实现化学能向电能的转化
B.甲装置中 透过阳离子交换膜向a极移动
透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是浓盐水
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀.炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈.请写出铁锅生锈过程的正极反应式:_______ 。
②图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的_______ 极。
(3)蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是: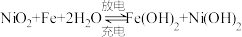 。
。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是_______ (填序号)。
A.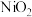 B.
B. C.
C. D.
D.
②该电池放电时,正极附近溶液的pH_______ (填增大、减小、不变)。
③充电时该电池阴极的电极反应式_______ 。
(1)我国利用氯碱厂生产的
 作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。

①乙装置中电解饱和
 溶液的化学方程式为
溶液的化学方程式为 气体时,乙装置中转移电子
气体时,乙装置中转移电子 。
。②下列说法正确的是
A.甲装置可实现化学能向电能的转化
B.甲装置中
 透过阳离子交换膜向a极移动
透过阳离子交换膜向a极移动C.乙装置中c极一侧流出的是浓盐水
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀.炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈.请写出铁锅生锈过程的正极反应式:
②图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的
(3)蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:
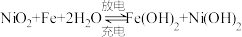 。
。①若此蓄电池放电时,该电池某一电极发生还原反应的物质是
A.
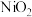 B.
B. C.
C. D.
D.
②该电池放电时,正极附近溶液的pH
③充电时该电池阴极的电极反应式
更新时间:2022-02-20 11:24:46
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)将锌片和银片浸入稀H2SO4中组成原电池,两极间连接一个电流计,锌片上发生的电极反应为________ ,银片上发生的电极反应为_____________ ;
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称量,总质量为47g,则产生标况下的氢气_____ 升,导线上转移的电子
_____ NA;
(3)若将12.8g铜与一定量的浓HNO3混合反应,铜耗尽时共产生5.6L(标准状况)气体,则所消耗的HNO3的物质的量为_______ ,所得到的气体是(填化学式)__________ ,平均相对分子质量为_______ 。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称量,总质量为47g,则产生标况下的氢气
(3)若将12.8g铜与一定量的浓HNO3混合反应,铜耗尽时共产生5.6L(标准状况)气体,则所消耗的HNO3的物质的量为
您最近一年使用:0次
【推荐2】铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是_____ 。
(2)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)═ Na3AlH6(s)+
Na3AlH6(s)+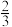 Al(s)+H2(g) △H=+37kJ•mol-1;K1
Al(s)+H2(g) △H=+37kJ•mol-1;K1
Na3AlH6(s)═3NaH(s)+Al(s)+ H2(g) △H=+70.5kJ•mol-1;K2
H2(g) △H=+70.5kJ•mol-1;K2
则NaAlH4(s)═NaH(s)+Al(s)+ H2(g) △H=
H2(g) △H=__ 。
K=_____ (用K1和K2表示)
(3)已知H2O2是一种弱酸,在强碱性溶液中主要以HO 形式存在。目前研究比较热门的Al—H2O2燃料电池,电池总反应如下:2Al+3HO
形式存在。目前研究比较热门的Al—H2O2燃料电池,电池总反应如下:2Al+3HO =2AlO
=2AlO +OH-+H2O。
+OH-+H2O。
①正极反应式为_____ 。
②与普通锌锰干电池(Zn—MnO2)相比,当消耗相同质量的负极活性物质时,Al—H2O2燃料电池的理论放电量约为普通锌锰干电池的____ 倍。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是
(2)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)═
 Na3AlH6(s)+
Na3AlH6(s)+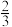 Al(s)+H2(g) △H=+37kJ•mol-1;K1
Al(s)+H2(g) △H=+37kJ•mol-1;K1Na3AlH6(s)═3NaH(s)+Al(s)+
 H2(g) △H=+70.5kJ•mol-1;K2
H2(g) △H=+70.5kJ•mol-1;K2则NaAlH4(s)═NaH(s)+Al(s)+
 H2(g) △H=
H2(g) △H=K=
(3)已知H2O2是一种弱酸,在强碱性溶液中主要以HO
 形式存在。目前研究比较热门的Al—H2O2燃料电池,电池总反应如下:2Al+3HO
形式存在。目前研究比较热门的Al—H2O2燃料电池,电池总反应如下:2Al+3HO =2AlO
=2AlO +OH-+H2O。
+OH-+H2O。①正极反应式为
②与普通锌锰干电池(Zn—MnO2)相比,当消耗相同质量的负极活性物质时,Al—H2O2燃料电池的理论放电量约为普通锌锰干电池的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】按要求完成下列填空。
(1)下列变化过程,属于化学反应且放热的是_______ 。
①浓 稀释②酸碱中和反应③Mg条与盐酸反应④
稀释②酸碱中和反应③Mg条与盐酸反应④ 与
与 ⑤铝热反应⑥碳高温条件下还原
⑤铝热反应⑥碳高温条件下还原 生成CO
生成CO
(2)以 为催化剂的光、热化学循环分解
为催化剂的光、热化学循环分解 反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:

①上述过程①中,能量的变化形式是由_______ 转化为_______ 。
②写出 分解生成CO和
分解生成CO和 的热化学方程式
的热化学方程式_______ 。
③CO和 作反应物的一种燃料电池,其构造如下图所示,Y为电池的
作反应物的一种燃料电池,其构造如下图所示,Y为电池的_______ (填“正”或“负”)极, 向
向_______ 极移动(填“X”或“Y”),负极电极反应式为_______ 。

(3)已知反应:
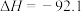 kJ/mol,在一定温度下,取1mol
kJ/mol,在一定温度下,取1mol 和3mol
和3mol 放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为
放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为_______ 。
(1)下列变化过程,属于化学反应且放热的是
①浓
 稀释②酸碱中和反应③Mg条与盐酸反应④
稀释②酸碱中和反应③Mg条与盐酸反应④ 与
与 ⑤铝热反应⑥碳高温条件下还原
⑤铝热反应⑥碳高温条件下还原 生成CO
生成CO(2)以
 为催化剂的光、热化学循环分解
为催化剂的光、热化学循环分解 反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
①上述过程①中,能量的变化形式是由
②写出
 分解生成CO和
分解生成CO和 的热化学方程式
的热化学方程式③CO和
 作反应物的一种燃料电池,其构造如下图所示,Y为电池的
作反应物的一种燃料电池,其构造如下图所示,Y为电池的 向
向
(3)已知反应:

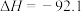 kJ/mol,在一定温度下,取1mol
kJ/mol,在一定温度下,取1mol 和3mol
和3mol 放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为
放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
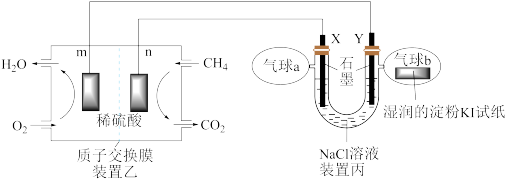
(1)m极为_______ 极,该电极发生的电极反应式为_______
(2)装置丙Y极电极反应式为_______ ;装置乙中n电极发生反应的电极反应式为:_______
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:_______ 。
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为_______  。(保留小数点后两位)
。(保留小数点后两位)
③某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是_______ 。
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
(1)m极为
(2)装置丙Y极电极反应式为
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)写出负极的电极反应式_____________________________ 。
(2)铁电极为________ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________ 。
(3)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为______ g。假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将____________ (填“增大”、“减小”或“不变”),且变化了_______ g。
(4)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为_________________________________________________

根据要求回答相关问题:
(1)写出负极的电极反应式
(2)铁电极为
(3)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为
(4)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________ 。
②电解NaCl溶液的离子方程式是____________________________________________ 。
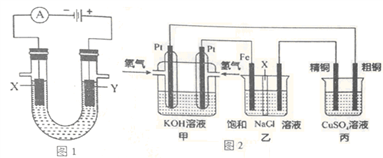
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________ 。
②石墨电极(乙装置中右侧电极)为__________ 极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________ 极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________ (填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________ L;丙装置中阴极析出铜的质量为__________ g。
①X极上的电极反应式是
②电解NaCl溶液的离子方程式是

(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为
②石墨电极(乙装置中右侧电极)为
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为
您最近一年使用:0次
【推荐1】目前的锂离子电池的正极材料多是LiCoO2、LiMn2O4、LiFePO4和双离子传递型聚合物等。改良正极材料的性能是锂离子电池领域的重点方向,如用碳包覆LiFePO4和向其中掺杂金属银等。下列过程是制备该正极材料的流程图:

回答下列问题:
(1)LiFePO4中铁元素的化合价为_____ 价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,C6H12O6的用量占原料总质量的5%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量为_______ (保留两位小数)。
(2)将原料先行研磨4 h目的是_________ 。为了更快得到前驱体粉末,除了保持温度在50℃外,还应进行的常见操作方法是_________ 。
(3)两次焙烧均需要在高纯氮气环境下进行,原因是________ 。葡萄糖分解产生的碳除了提供还原性环境,提高产物纯度,而且可以阻止晶粒的聚集长大,控制颗粒形状,提高LiFePO4的电导率。则葡萄糖分解的化学反应方程式(分解过程中只有C一种单质生成)为________ 。600℃加热时硝酸银发生分解生成红棕色气体和3种常见单质(其中两种气体单质物质的量比为2:7),则分解时的化学反应方程式为_______ 。
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是______ 、______ (锂离子电池是靠xLi+在两极的嵌入和嵌出进行工作)。
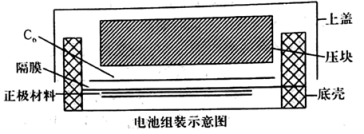

回答下列问题:
(1)LiFePO4中铁元素的化合价为
(2)将原料先行研磨4 h目的是
(3)两次焙烧均需要在高纯氮气环境下进行,原因是
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上主要采用软锰矿和闪锌矿联合生产MnO2和锌。软锰矿主要成分为MnO2;还含少量Al2O3和SiO2杂质。闪锌矿主要成分为ZnS,还含少量FeS、CuS杂质。现用稍过量的软锰矿和闪锌矿为原料,经过一系列处理后分别在两个电极生成产品“MnO2和锌”。工艺流程如下:
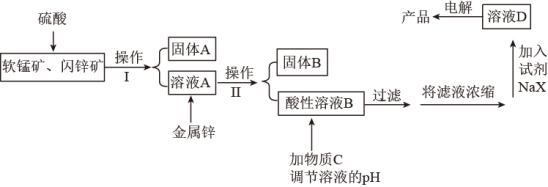
已知:Ⅰ:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如:MnO2+ZnS+2H2SO4 MnSO4+ZnSO4+S+2H2O.
MnSO4+ZnSO4+S+2H2O.
Ⅱ:4X-+Mn2+ MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。
Ⅲ:各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)操作I的名称是_____________________ 。
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是________ (用化学式表示)。
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。

①硫酸钠的作用是________________________ 。
②b电极的电极反应式是______________________ 。a电极的电极反应式是_______________________ 。
(4)若一定质量的闪锌矿中含1.76kgFeS,则在上述流程中1.76kgFeS消耗MnO2的质量为_______ kg。
(5)现有0.4mol/L Mn(NO3)2、 0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则此时c(Zn2+)=________ [已知Ksp(ZnS)=1.3×10-24,Ksp(MnS)=2.6×10-13]

已知:Ⅰ:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如:MnO2+ZnS+2H2SO4
 MnSO4+ZnSO4+S+2H2O.
MnSO4+ZnSO4+S+2H2O.Ⅱ:4X-+Mn2+
 MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。Ⅲ:各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | A13+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)操作I的名称是
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。

①硫酸钠的作用是
②b电极的电极反应式是
(4)若一定质量的闪锌矿中含1.76kgFeS,则在上述流程中1.76kgFeS消耗MnO2的质量为
(5)现有0.4mol/L Mn(NO3)2、 0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则此时c(Zn2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上以软锰矿(主要成分 ,还含有少量的
,还含有少量的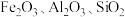 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:

(1)软锰矿“粉磨”的目的是_______ 。
(2)写出“浸出”过程中 参与反应的离子方程式
参与反应的离子方程式_______ 。
(3)“浸渣”的主要成分是_______ (用化学式表示)。
(4)“除杂”反应中X可以是_______ (填标号)。
a. b.
b. c.
c. d.
d.
(5)写出“沉锰”操作中发生反应的离子方程式_______ 。
(6)“电解”操作中电极均为惰性电极,写出阴极的电极反应式_______ 。
(7)在废水处理中常用 将
将 转化
转化 除去,向含有
除去,向含有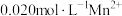 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当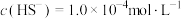 时,
时, 开始沉淀,则
开始沉淀,则
_______ 。(已知: 时,
时, 的电离常数
的电离常数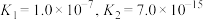 ;
; )
)
 ,还含有少量的
,还含有少量的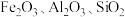 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:
(1)软锰矿“粉磨”的目的是
(2)写出“浸出”过程中
 参与反应的离子方程式
参与反应的离子方程式(3)“浸渣”的主要成分是
(4)“除杂”反应中X可以是
a.
 b.
b. c.
c. d.
d.
(5)写出“沉锰”操作中发生反应的离子方程式
(6)“电解”操作中电极均为惰性电极,写出阴极的电极反应式
(7)在废水处理中常用
 将
将 转化
转化 除去,向含有
除去,向含有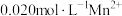 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当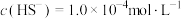 时,
时, 开始沉淀,则
开始沉淀,则
 时,
时, 的电离常数
的电离常数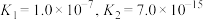 ;
; )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】家用炒菜铁锅用水清洗放置后会出现红棕色的锈斑,某同学欲对其原理及条件进行分析。该同学准备了下列实验用品:20%的NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请设计一个实验方案验证铁被腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式:________
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氯化亚铜是非常重要的化工原料,广泛用于化学反应的催化剂。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:
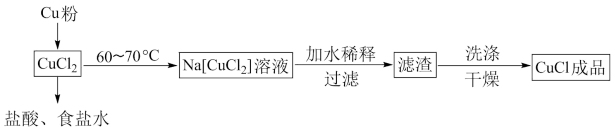
(1)“加水稀释”步骤中,配合物 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式_____ 。
(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是______ 。若在空气中用水洗涤,可转变为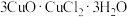 ,写出该过程的化学方程式
,写出该过程的化学方程式___________ 。
(3)已知溶液中可以发生反应: ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是___________ 。
II.利用氧化还原滴定可测定产品中 的含量,实验分两步进行:
的含量,实验分两步进行:
步骤I:将上述流程得到的 产品取
产品取 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。
步骤II:将溶解液稀释至 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。
已知: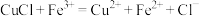 、
、
(4)计算产品中 的质量分数为
的质量分数为___________ 。滴定过程中,下列操作会使滴定结果偏小的是___________ (填字母序号)。
a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现, 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(5)腐蚀过程中,正极的电极反应式为___________ 。
(6)环境中的 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈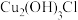 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
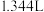 时,生成
时,生成___________ g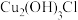 。
。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:

(1)“加水稀释”步骤中,配合物
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是
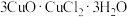 ,写出该过程的化学方程式
,写出该过程的化学方程式(3)已知溶液中可以发生反应:
 ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是II.利用氧化还原滴定可测定产品中
 的含量,实验分两步进行:
的含量,实验分两步进行:步骤I:将上述流程得到的
 产品取
产品取 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。步骤II:将溶解液稀释至
 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。已知:
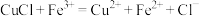 、
、
(4)计算产品中
 的质量分数为
的质量分数为a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现,
 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
(5)腐蚀过程中,正极的电极反应式为
(6)环境中的
 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈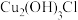 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
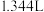 时,生成
时,生成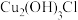 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】用方程式回答下列问题。
(1)高温下铁和 的反应:
的反应:_______ 。
(2)用离子方程式表示将铁粉逐渐加入稀 中的反应过程:
中的反应过程:_______ ;_______ 。
(3)用离子方程式表示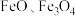 与稀
与稀 的反应:
的反应:_______ ;_______ 。
(4)用离子方程式表示下列反应。
① 与稀
与稀 反应:
反应:_______ ;
② 与氢碘酸反应:
与氢碘酸反应:_______ 。
(5)用方程式表示铁发生吸氧腐蚀生成铁锈的过程:负极:_______ ,正极:_______ ,_______ ,_______ , 脱去一部分水生成
脱去一部分水生成 。
。
(6)怎样除去 中的
中的 (用适当的文字和离子方程式说明)
(用适当的文字和离子方程式说明) _______ 。
(7)怎样检验 中的
中的 (用适当的文字和离子方程式说明)
(用适当的文字和离子方程式说明)_______ 。
(1)高温下铁和
 的反应:
的反应:(2)用离子方程式表示将铁粉逐渐加入稀
 中的反应过程:
中的反应过程:(3)用离子方程式表示
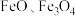 与稀
与稀 的反应:
的反应:(4)用离子方程式表示下列反应。
①
 与稀
与稀 反应:
反应:②
 与氢碘酸反应:
与氢碘酸反应:(5)用方程式表示铁发生吸氧腐蚀生成铁锈的过程:负极:
 脱去一部分水生成
脱去一部分水生成 。
。(6)怎样除去
 中的
中的 (用适当的文字和离子方程式说明)
(用适当的文字和离子方程式说明) (7)怎样检验
 中的
中的 (用适当的文字和离子方程式说明)
(用适当的文字和离子方程式说明)
您最近一年使用:0次



