电解精炼铜,可以降低铜中杂质含量,提高铜的性能,同时也可以回收其中的贵金属。
(1)电解时,阴极反应方程式为____ 。
(2)工业上从电解铜的阳极泥中提取贵金属的流程的工艺流程如图:

已知:温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
①步骤I的主要目的为浸出铜,分析表格数据,可知步骤I最适合的条件为____ 。
②步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____ 。
③步骤III的操作方法为_____ 、过滤。
④步骤IV中,反应温度为75℃,此过程中H2O2溶液的添加量高于理论值,原因为___ 。
⑤步骤VII中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为____ 。
⑥步骤VIII中得到的Au和Ag混合物最好用____ 进行分离(填选项字母)。
A.稀硝酸 B.浓盐酸 C.稀盐酸 D.浓氢氧化钠溶液 E.王水
(1)电解时,阴极反应方程式为
(2)工业上从电解铜的阳极泥中提取贵金属的流程的工艺流程如图:

已知:温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
| 固定浸出温度 | 固定H2SO4浓度 | |||||||||||
| H2SO4浓度/mol·L-1 | 浸出率1% | 浸出温度/℃ | 浸出率/% | |||||||||
| Cu | Ag | Au | Se | Te | Cu | Ag | Au | Se | Te | |||
| 4 | 95.1 | 4.67 | <0.2 | 0.83 | 8.93 | 30 | 87.1 | 4.58 | <0.2 | 0.18 | 6.83 | |
| 3 | 94.5 | 4.65 | <0.2 | 0.28 | 3.90 | 40 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | |
| 2 | 78.1 | 2.65 | <0.2 | 0.05 | 2.85 | 50 | 96.1 | 4.90 | <0.2 | 0.64 | 8.73 | |
②步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为
③步骤III的操作方法为
④步骤IV中,反应温度为75℃,此过程中H2O2溶液的添加量高于理论值,原因为
⑤步骤VII中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为
⑥步骤VIII中得到的Au和Ag混合物最好用
A.稀硝酸 B.浓盐酸 C.稀盐酸 D.浓氢氧化钠溶液 E.王水
更新时间:2022-03-23 15:34:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。制备甲醇过程中主要存在以下反应:
主反应ⅰ:
(1)请结合反应: ,写出一个生成
,写出一个生成 的副反应ⅱ的热化学方程式:
的副反应ⅱ的热化学方程式:_______ 。
(2)将 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放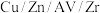 催化剂的反应器,在相同时间内,其中
催化剂的反应器,在相同时间内,其中 的平衡转化率
的平衡转化率 的选择性
的选择性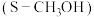 随温度、压强变化如图所示:
随温度、压强变化如图所示:

已知: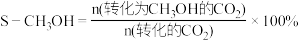
①请判断 的大小关系:
的大小关系:
_______  (填“>”或“<”)。
(填“>”或“<”)。
② 左右,体系发生的反应主要是
左右,体系发生的反应主要是_______ (填“i”或“ii”)。
③若只发生主反应ⅰ和副反应ⅱ,平衡时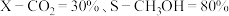 ,则
,则 的转化率为
的转化率为_______  。
。
(3)使用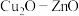 薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和硫酸铜溶液中,制得 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为_______ 。
②用 薄膜电极作阴极,
薄膜电极作阴极,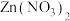 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备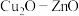 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备
。制备 薄膜的电极反应式为
薄膜的电极反应式为_______ 。
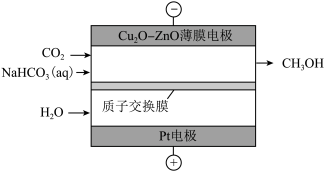
③电催化法制备甲醇如图所示。若忽略电解液体积变化,电解过程中阴极室溶液的 基本不变,结合电极反应解释原因:
基本不变,结合电极反应解释原因:_______ 。
主反应ⅰ:

(1)请结合反应:
 ,写出一个生成
,写出一个生成 的副反应ⅱ的热化学方程式:
的副反应ⅱ的热化学方程式:(2)将
 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放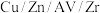 催化剂的反应器,在相同时间内,其中
催化剂的反应器,在相同时间内,其中 的平衡转化率
的平衡转化率 的选择性
的选择性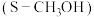 随温度、压强变化如图所示:
随温度、压强变化如图所示:
已知:
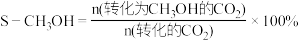
①请判断
 的大小关系:
的大小关系:
 (填“>”或“<”)。
(填“>”或“<”)。②
 左右,体系发生的反应主要是
左右,体系发生的反应主要是③若只发生主反应ⅰ和副反应ⅱ,平衡时
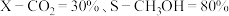 ,则
,则 的转化率为
的转化率为 。
。(3)使用
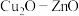 薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。①将铜箔放入煮沸的饱和硫酸铜溶液中,制得
 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为②用
 薄膜电极作阴极,
薄膜电极作阴极,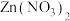 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备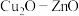 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备
。制备 薄膜的电极反应式为
薄膜的电极反应式为③电催化法制备甲醇如图所示。若忽略电解液体积变化,电解过程中阴极室溶液的
 基本不变,结合电极反应解释原因:
基本不变,结合电极反应解释原因:
您最近一年使用:0次
【推荐2】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:

(1)写出反应1的离子方程式_________________________________ 。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH- NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度 的关系如下图所示。

①比较a、b点的反应速率:va逆_______ vb正(填 “>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______ (填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____ (保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______ 。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2
ΔH=________________ 。(含ΔH1、ΔH2的代数式)
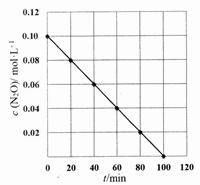
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。已知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________ ,n=_____ 。
 。
。
Ⅰ.已知:

(1)写出反应1的离子方程式
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-
 NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)
①比较a、b点的反应速率:va逆
②随着温度的升高,该反应的化学平衡常数K
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2
ΔH=
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。已知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
(1)已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH=b kJ·mol-1
C(石墨,s)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=___________ kJ·mol-1。
(2)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___________ 。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极:___________ ,正极:___________ 。
(3)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl溶液、盐酸、NaClO2溶液为原料制备ClO2的流程如下:

已知:电解过程中发生的反应为NH4Cl+2HCl NCl3+3H2↑,NCl3中氮元素为+3价。
NCl3+3H2↑,NCl3中氮元素为+3价。
①写出电解时阴极的电极反应:_____________________ 。
②在阳极上放电的离子是___________ 。
(1)已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH=b kJ·mol-1
C(石墨,s)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=
(2)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极:
(3)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl溶液、盐酸、NaClO2溶液为原料制备ClO2的流程如下:

已知:电解过程中发生的反应为NH4Cl+2HCl
 NCl3+3H2↑,NCl3中氮元素为+3价。
NCl3+3H2↑,NCl3中氮元素为+3价。①写出电解时阴极的电极反应:
②在阳极上放电的离子是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)铜是生命必需的元素,也是人类广泛使用的金属。现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 Cu2S+3SO2+2FeO,反应中被还原的元素有
Cu2S+3SO2+2FeO,反应中被还原的元素有_________ ,每转移0.6mol电子,有_________ mol硫被氧化。
(2)产物中的SO2是一种大气污染物,可选用下列试剂中的_________ 吸收(选填编号)。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.CaCl2
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:____________________________________ 。
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在_________ 极获得(填写电极名称)。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________ 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释______ 。
(6)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物_________ (填写化学式)。
 Cu2S+3SO2+2FeO,反应中被还原的元素有
Cu2S+3SO2+2FeO,反应中被还原的元素有(2)产物中的SO2是一种大气污染物,可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.CaCl2
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式
(6)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的________ 吸收。
a.浓H2SO4 b.稀HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(填离子符号)____ ,检验溶液中还存在Fe2+的方法是_________ (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为________________________ 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是__________ 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.阴极增重的质量等于阳极减少的质量
f.溶液中铜离子浓度不变
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________________ 。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(填离子符号)
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.阴极增重的质量等于阳极减少的质量
f.溶液中铜离子浓度不变
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业。废钯催化剂的杂质主要含炭、有机物及少量Fe、Cu、Al等元素。从废钯催化剂中回收钯(Pd),并制备二氯二氨合钯[Pd(NH3)2Cl2]的一种工艺流程如下:
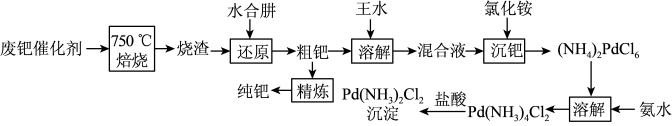
回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)“烧渣”的主要成分是PdO,利用水合肼(N2H4·H2O)在弱碱性环境下还原PdO,产生的气体可以参与大气循环。该还原反应的化学方程式为_________ 。
(3)“粗钯”中含Fe、Cu等杂质,可采用电解精炼的方法得到纯钯。粗钯应与电源的__________ 极相连,Pd与Fe均为第Ⅷ族元素,性质相似,则阴极的电极反应式为_______ 。
(4)粗钯“王水溶解”时,生成氯钯酸(H2PdCl6),其中Pd元素化合价为___________ 。
(5)“沉钯”中氯化铵与“混合液”中的氯钯酸反应生成氯钯酸铵[(NH4)2PdCl6]沉淀,其沉淀率随温度的变化曲线如图所示。下列有关推断错误的是_____________ (填序号)。
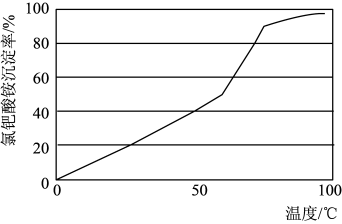
A 升高温度有利于氯化氢挥发,促使平衡正向移动
B 沉钯的最佳温度为100 ℃
C 该反应ΔS>0
(6)“氨水溶解”氯钯酸铵时,先加热将(NH4)2PdCl6转化为(NH4)2PdCl4,再与氨水反应。写出足量氨水与(NH4)2PdCl4反应的化学方程式_________ 。
(7)用平衡移动原理解释盐酸能将Pd(NH3)4Cl2转化为Pd(NH3)2Cl2沉淀的原因_______ 。

回答下列问题:
(1)“焙烧”的目的是
(2)“烧渣”的主要成分是PdO,利用水合肼(N2H4·H2O)在弱碱性环境下还原PdO,产生的气体可以参与大气循环。该还原反应的化学方程式为
(3)“粗钯”中含Fe、Cu等杂质,可采用电解精炼的方法得到纯钯。粗钯应与电源的
(4)粗钯“王水溶解”时,生成氯钯酸(H2PdCl6),其中Pd元素化合价为
(5)“沉钯”中氯化铵与“混合液”中的氯钯酸反应生成氯钯酸铵[(NH4)2PdCl6]沉淀,其沉淀率随温度的变化曲线如图所示。下列有关推断错误的是

A 升高温度有利于氯化氢挥发,促使平衡正向移动
B 沉钯的最佳温度为100 ℃
C 该反应ΔS>0
(6)“氨水溶解”氯钯酸铵时,先加热将(NH4)2PdCl6转化为(NH4)2PdCl4,再与氨水反应。写出足量氨水与(NH4)2PdCl4反应的化学方程式
(7)用平衡移动原理解释盐酸能将Pd(NH3)4Cl2转化为Pd(NH3)2Cl2沉淀的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘。

请回答下列问题:
(1)仪器A的名称为___________ ,操作A为___________ 。
(2)煮沸的作用是___________ 。
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是___________ ;萃取后,分液漏斗内观察到的现象是___________ 。
(4)向海带浸取原液中通入适量 ,并控制溶液pH为4.5,此时发生反应的离子方程为
,并控制溶液pH为4.5,此时发生反应的离子方程为___________ 。
(5)步骤Y中发生反应的离子方程式为___________ 。
(6)该实验流程中,能循环使用的物质是___________ 。

请回答下列问题:
(1)仪器A的名称为
(2)煮沸的作用是
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是
(4)向海带浸取原液中通入适量
 ,并控制溶液pH为4.5,此时发生反应的离子方程为
,并控制溶液pH为4.5,此时发生反应的离子方程为(5)步骤Y中发生反应的离子方程式为
(6)该实验流程中,能循环使用的物质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】精对苯二甲酸(PTA)是生产聚酯纤维的重要化工原料。生产过程产生的氧化残渣主要含有苯甲酸、对苯二甲酸、钴锰催化剂等。采用以下工艺流程可实现PTA残渣中有效成分苯甲酸和Co2+、Mn2+的回收与纯化,达到废物再利用的目的。
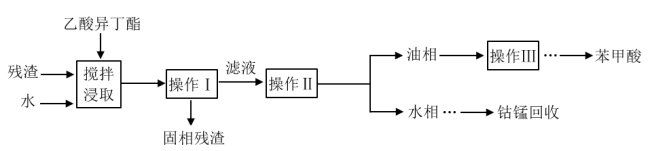
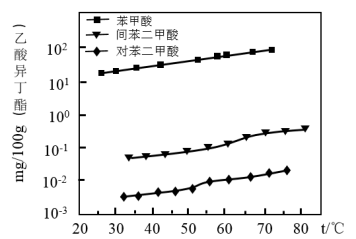
(1)操作I的方法是______ ;实验室进行操作Ⅱ主要用的玻璃仪器有_________ 。
(2)判定乙酸异丁酯可用于浸取并有效回收苯甲酸的理由是_________ 。
(3)从上表所列实验数据可知苯甲酸在乙酸异丁酯中的溶解过程是_________ (填“放热”或“吸热”)过程。
(4)操作Ⅲ为蒸馏,蒸出的溶剂可返回_________ 工序循环使用。
(5)钴锰回收时常采用Na,S沉淀法将钴沉淀为CoS,若油水分离后的溶液经蒸发浓缩后,Co2+和Mn2+的浓度均为0.1mol∙L-1,计算说明当Co2+完全沉淀时产生的固体中不含MnS,支持这个结论的数学关系式是_________ 。[已知:Ksp(CoS)=2×10-25,Ksp(MnS)=2×10-13,完全沉淀指溶液中离子浓度小于10-5mol∙L-1]
(6)得到的CoS通过硫酸化焙烧转变为水溶性的CoSO4,其化学方程式为_________ 。


| 序号 | 浸取温度/℃ | 进料质量比溶剂:水:干残渣 | 苯甲酸浸取率/% |
| 1 | 30 | 4∶1∶1 | 87.48 |
| 2 | 40 | 4∶1∶1 | 90.33 |
| 3 | 50 | 4∶1∶1 | 90.81 |
(1)操作I的方法是
(2)判定乙酸异丁酯可用于浸取并有效回收苯甲酸的理由是
(3)从上表所列实验数据可知苯甲酸在乙酸异丁酯中的溶解过程是
(4)操作Ⅲ为蒸馏,蒸出的溶剂可返回
(5)钴锰回收时常采用Na,S沉淀法将钴沉淀为CoS,若油水分离后的溶液经蒸发浓缩后,Co2+和Mn2+的浓度均为0.1mol∙L-1,计算说明当Co2+完全沉淀时产生的固体中不含MnS,支持这个结论的数学关系式是
(6)得到的CoS通过硫酸化焙烧转变为水溶性的CoSO4,其化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高砷烟尘(主要成分有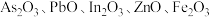 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为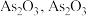 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为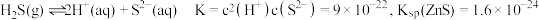 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用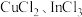 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
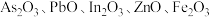 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: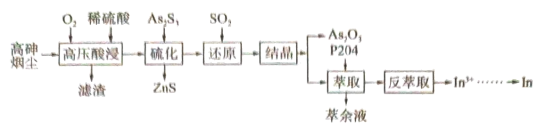
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为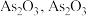 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为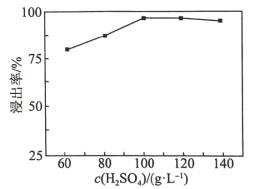
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为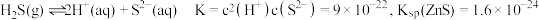 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用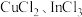 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次



