按要求填空。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
(2)基态Fe原子中,电子占据的最高能层的符号为_______ ,该能层具有的原子轨道数为_______ 。
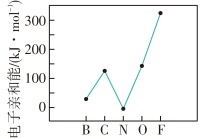
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大。而氮元素的
自左而右依次增大。而氮元素的 呈现异常的原因是
呈现异常的原因是_______ 。
(4) 是离子化合物,下图是Born−Haber循环。
是离子化合物,下图是Born−Haber循环。
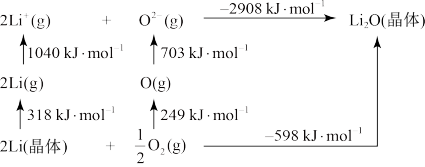
可知,Li原子的第一电离能为_______  ,O=O键键能为
,O=O键键能为_______  。
。
(5)下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据:
下列说法正确的是_______(填字母)。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
A. | B. | C.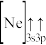 | D. |
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大。而氮元素的
自左而右依次增大。而氮元素的 呈现异常的原因是
呈现异常的原因是
(4)
 是离子化合物,下图是Born−Haber循环。
是离子化合物,下图是Born−Haber循环。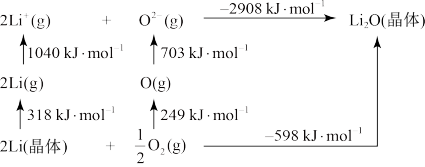
可知,Li原子的第一电离能为
 ,O=O键键能为
,O=O键键能为 。
。(5)下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据:
| 元素 | 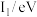 | 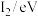 | 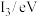 |
| 甲 | 5.7 | 47.1 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A.甲的金属性比乙强 | B.乙的化合价为 价 价 |
| C.丙不可能为非金属元素 | D.丁一定为金属元素 |
更新时间:2022-04-09 18:07:28
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
请填写下列空格:
(1)A原子的电子式:_____ 。
(2)B离子的结构示意图:_______ 。
(3)C元素的名称:___ ,C原子中能量最高的电子位于第______ 层,与C离子质子数与电子数均相同的微粒可能是______ (用微粒符号表示)。
(4)D的二价阴离子的电子式:___ ,D元素的某种同位素原子质量数为34,该原子核内的中子数为_____ 。
(5)A、B、E三种元素形成的化合物常用于吸收F单质,反应的化学方程式:_____________ 。
| 元素代号 | 相关信息 |
| A | 最外层的电子数是次外层电子数的3倍 |
| B | 海水中含量第一位的金属元素 |
| C | L层得1个电子后成为稳定结构 |
| D | 二价阴离子核外有18个电子 |
| E | 失去一个电子后就成为一个质子 |
| F | 单质为黄绿色气体,具有刺激性气味 |
请填写下列空格:
(1)A原子的电子式:
(2)B离子的结构示意图:
(3)C元素的名称:
(4)D的二价阴离子的电子式:
(5)A、B、E三种元素形成的化合物常用于吸收F单质,反应的化学方程式:
您最近一年使用:0次
【推荐2】回答下列问题
(1)C、N、O、Al、Si、Cu是常见的六种元素。
①C的基态原子核外电子排布式为___________ ;
②Cu的基态原子最外层有___________ 个电子。
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是___________ (填写元素符号)。
②基态锗(Ge)原子的电子排布式是___________ 。Ge的最高价氯化物的分子式是___________ 。
③Ge元素可能的性质或应用有___________ 。
A.其是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(1)C、N、O、Al、Si、Cu是常见的六种元素。
①C的基态原子核外电子排布式为
②Cu的基态原子最外层有
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/(kJ·mol-1) | 578 | 1817 | 2745 | 11578 | …… |
②基态锗(Ge)原子的电子排布式是
③Ge元素可能的性质或应用有
A.其是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】(1)下列关于CH4和CO2的说法正确的是________ (填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(2)Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有________ mol σ键。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
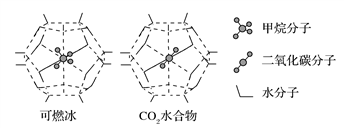
①“可燃冰”中分子间存在的2种作用力是______________________ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是______________________________ 。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(2)Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
| 分子 参数 | 分子直径/nm | 分子与H2O的结合能 E/kJ·mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |

①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】基态钠原子中,其占据的最高能层的符号是_____ ,该能层对应的能级有______ 。
您最近一年使用:0次
【推荐2】 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
(1)基态Co原子的价层电子排布图为_______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_______ ;C、N、O、F的第一电离能由大到小的顺序为_______ 。
(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
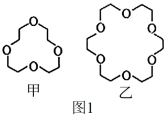
冠醚中O原子的杂化形式为_______ ;H、C、O的电负性由小到大的顺序为_______ 。
(4) 的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。

①每个晶胞中由K和F共同形成的正四面体空隙有_______ 个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于_______ 位置。
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:(1)基态Co原子的价层电子排布图为
(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

冠醚中O原子的杂化形式为
(4)
 的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
①每个晶胞中由K和F共同形成的正四面体空隙有
②晶胞的另一种表示中,Co处于各顶角位置,则K处于
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】下列叙述中,正确的是___________
A.各电子层含有的原子轨道数为2n2
B.各电子层的能级都是从s能级开始,到f能级结束
C.s、p、d能级所含有的原子轨道数分别为1、3、5
D.钠的焰色试验呈现黄色,是电子由激发态转化成基态时吸收能量产生的
E.卢瑟福的“有核模型”可以准确地描述电子运动状态
F.在同一原子中,2p、3p、4p能级的轨道数相等
A.各电子层含有的原子轨道数为2n2
B.各电子层的能级都是从s能级开始,到f能级结束
C.s、p、d能级所含有的原子轨道数分别为1、3、5
D.钠的焰色试验呈现黄色,是电子由激发态转化成基态时吸收能量产生的
E.卢瑟福的“有核模型”可以准确地描述电子运动状态
F.在同一原子中,2p、3p、4p能级的轨道数相等
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】氟原子激发态的电子排布式有_______ ,其中能量较高的是_______ 。(填标号)
a.1s22s22p43s1 b.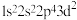 c.1s22s12p5 d.
c.1s22s12p5 d.
a.1s22s22p43s1 b.
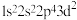 c.1s22s12p5 d.
c.1s22s12p5 d.
您最近一年使用:0次
【推荐1】根据有关知识,回答下列问题。
(1)符号 所代表的含义是__________(填字母)。
所代表的含义是__________(填字母)。
(2)铝原子核外电子云有__________ 种不同的伸展方向,有__________ 种不同运动状态的电子。
(3)短周期的化学元素(0族和放射性元素除外)中,第一电离能最小的元素是__________ (填元素符号,下同),电负性最大的元素是__________ 。
(4)Be的第一电离能大于B的第一电离能,这是因为__________ 。
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:__________ 。
(6)锰元素位于第四周期第ⅦB族,请写出基础 的价层电子排布式
的价层电子排布式__________ 。
(1)符号
 所代表的含义是__________(填字母)。
所代表的含义是__________(填字母)。A. 轨道上有3个电子 轨道上有3个电子 |
B.第3个电子层 轨道有三个伸展方向 轨道有三个伸展方向 |
C. 电子云有3个伸展方向 电子云有3个伸展方向 |
| D.第3个电子层沿x轴方向伸展的p轨道 |
(3)短周期的化学元素(0族和放射性元素除外)中,第一电离能最小的元素是
(4)Be的第一电离能大于B的第一电离能,这是因为
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出
 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:(6)锰元素位于第四周期第ⅦB族,请写出基础
 的价层电子排布式
的价层电子排布式
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】用“>”或“<”填空:
(1)第一电离能C_____ N
(2)电负性Cl________ Br
(3)晶格能 KCl____ CsCl
(4)硬度 MgO_______ CaO
(5)酸性 HClO3____ HClO
(1)第一电离能C
(2)电负性Cl
(3)晶格能 KCl
(4)硬度 MgO
(5)酸性 HClO3
您最近一年使用:0次

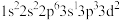 ,则该元素基态原子的电子排布式为
,则该元素基态原子的电子排布式为