海带中含有较多的碘元素,某化学兴趣小组通过以下步骤提取海带中的碘:
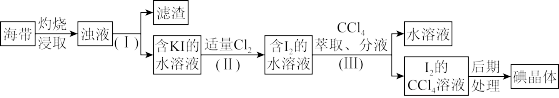
(1)步骤(Ⅰ)中分离操作的名称是_______ ,该操作中用到的玻璃仪器有漏斗、烧杯和_______ 。
(2)写出步骤(Ⅱ)中KI和Cl2反应的离子方程式_______ ,取少量反应后的溶液滴入淀粉试液,溶液呈_______ 色;
(3)步骤(Ⅲ)中萃取后分层, 的
的 溶液在
溶液在_______ (填“上层”或“下层”)。
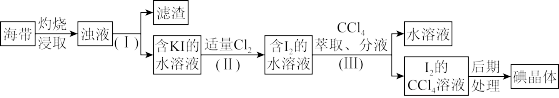
(1)步骤(Ⅰ)中分离操作的名称是
(2)写出步骤(Ⅱ)中KI和Cl2反应的离子方程式
(3)步骤(Ⅲ)中萃取后分层,
 的
的 溶液在
溶液在
更新时间:2022-04-20 11:14:45
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
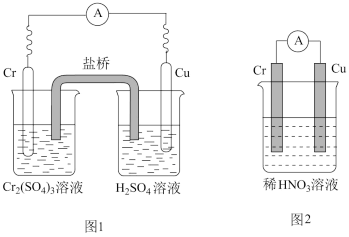
【推荐1】金属铬是一种银白色并带有金属光泽的金属,由于它的表面易形成一层钝态的薄膜,所以它有很强的抗腐蚀性。铬常见的价态是+3和+6价,能形成多种化合物。
(1)为了研究金属铬的化学性质,某实验小组按照图1和图2装置进行了实验,观察到如下现象:图1装置铜电极上产生大量的无色气泡,图2装置铜极上无气体产生,铬电极上却产生大量的有色气体。根据上述现象试推测金属铬的两种重要化学性质:_______ 、_______ 。
(2)Cr(OH)2与Al(OH)3性质相似,也具有两性,请写出Cr(OH)2的电离方程式:_______ 。
(3)铬酸(H2CrO4)为中强酸,25℃时,铬酸在水溶液中的电离方程式如下:
H2CrO4⇌H++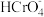 K1=4.1
K1=4.1
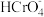 ⇌H++
⇌H++ K2=10-6
K2=10-6
则该温度下,0.1mol/L的NaHCrO4水溶液中所有离子的浓度由大到小的顺序为_______ 。
(4)铬试剂厂排放的废水中主要含有Cr2+、Fe2+、Fe3+、Al3+等,某研究小组拟采用下面流程处理含铬的废水。
【已知:铬(+6价)的两种盐存在如下平衡:2H++ 2 ⇌
⇌ +H2O,K=1014】
+H2O,K=1014】

其中试剂A的作用为_______ ;反应③中发生反应的离子方程式为;_______ 。
(5)Cr(+3价)的毒性远远小于Cr(+6价),上述流程中生成的含 的有毒废水可以采用复合铁氧体处理。其过程为:加入稀硫酸使溶液呈强酸性,然后再加入FeSO4溶液将Cr(+6价)还原Cr3+,最后调节pH生成符合铁氧体组成
的有毒废水可以采用复合铁氧体处理。其过程为:加入稀硫酸使溶液呈强酸性,然后再加入FeSO4溶液将Cr(+6价)还原Cr3+,最后调节pH生成符合铁氧体组成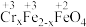 沉淀和水,请写出FeSO4将Cr(+6价)还原为C r3+的离子方程式
沉淀和水,请写出FeSO4将Cr(+6价)还原为C r3+的离子方程式_______ 。复合铁氧体沉淀的生成一般在pH=8~10的碱性条件下进行,原因是_______ ;根据以上信息和铁氧体的组成求得x=_______ 。
已知:
(1)为了研究金属铬的化学性质,某实验小组按照图1和图2装置进行了实验,观察到如下现象:图1装置铜电极上产生大量的无色气泡,图2装置铜极上无气体产生,铬电极上却产生大量的有色气体。根据上述现象试推测金属铬的两种重要化学性质:

(2)Cr(OH)2与Al(OH)3性质相似,也具有两性,请写出Cr(OH)2的电离方程式:
(3)铬酸(H2CrO4)为中强酸,25℃时,铬酸在水溶液中的电离方程式如下:
H2CrO4⇌H++
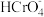 K1=4.1
K1=4.1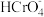 ⇌H++
⇌H++ K2=10-6
K2=10-6则该温度下,0.1mol/L的NaHCrO4水溶液中所有离子的浓度由大到小的顺序为
(4)铬试剂厂排放的废水中主要含有Cr2+、Fe2+、Fe3+、Al3+等,某研究小组拟采用下面流程处理含铬的废水。
【已知:铬(+6价)的两种盐存在如下平衡:2H++ 2
 ⇌
⇌ +H2O,K=1014】
+H2O,K=1014】
其中试剂A的作用为
(5)Cr(+3价)的毒性远远小于Cr(+6价),上述流程中生成的含
 的有毒废水可以采用复合铁氧体处理。其过程为:加入稀硫酸使溶液呈强酸性,然后再加入FeSO4溶液将Cr(+6价)还原Cr3+,最后调节pH生成符合铁氧体组成
的有毒废水可以采用复合铁氧体处理。其过程为:加入稀硫酸使溶液呈强酸性,然后再加入FeSO4溶液将Cr(+6价)还原Cr3+,最后调节pH生成符合铁氧体组成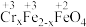 沉淀和水,请写出FeSO4将Cr(+6价)还原为C r3+的离子方程式
沉淀和水,请写出FeSO4将Cr(+6价)还原为C r3+的离子方程式已知:
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.5 | 9.6 |
| Cr(OH)3 | 4.3 | 5.6 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
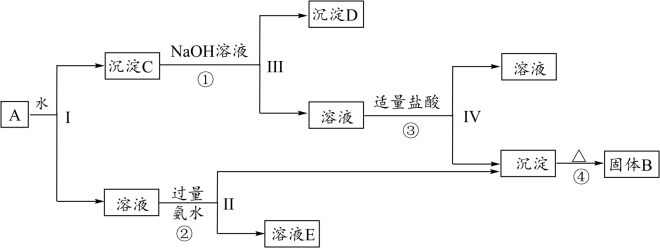
据此回答下列问题:
(1)I、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_______ 。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B_______ ;沉淀D_______ 。
(3)写出①、②反应的离子方程式:
①_______ ;②_______ ;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。_______

据此回答下列问题:
(1)I、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B
(3)写出①、②反应的离子方程式:
①
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
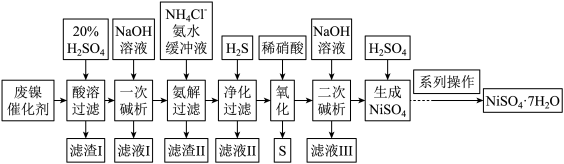
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为____ (写1种)。
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为_______ 。
(3)“氨解”的目的为__ “氨解”时需要控制低温原因是______ 。
(4)“氧化”时发生反应的化学方程式为_____ 。
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于_____ 。(已知:Ni(OH)2的Ksp=2×10-15, ≈1.4)。
≈1.4)。
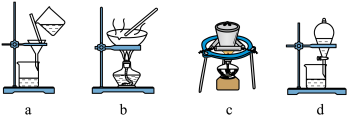
(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是____ (填下列各项中序号)。

已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为
(3)“氨解”的目的为
(4)“氧化”时发生反应的化学方程式为
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于
 ≈1.4)。
≈1.4)。(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是

您最近一年使用:0次
【推荐1】絮凝剂聚合氯化铝{ ,
, }广泛用于废水处理。由偏铝酸钙
}广泛用于废水处理。由偏铝酸钙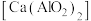 制备聚合氯化铝的一种工艺流程如下:
制备聚合氯化铝的一种工艺流程如下:

已知: 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。
(1)“碱溶”时,化学反应方程式为___________ 。
(2)“沉降”时,温度需控制在40℃左右,主要原因是___________ ;若滤液浓度较大,则通入过量 不利于减少
不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是___________ 。
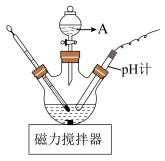
(3)“酸化”时的装置如图所示,仪器A的名称为___________ ,若要使产品盐基度为 ,则
,则
___________ 。先将 滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是___________ 。
(4)已知溶液pH不同时,钒元素与铝元素存在形式如下表所示,补充完整利用含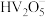 、
、 的碱性废水制取聚合氯化铝的实验方案:取适量废水,
的碱性废水制取聚合氯化铝的实验方案:取适量废水,___________ ,向其中滴加一定量的盐酸,得到聚合氯化铝。(实验中须使用的试剂有: 、5%的双氧水、蒸馏水、
、5%的双氧水、蒸馏水、 溶液)
溶液)
 ,
, }广泛用于废水处理。由偏铝酸钙
}广泛用于废水处理。由偏铝酸钙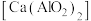 制备聚合氯化铝的一种工艺流程如下:
制备聚合氯化铝的一种工艺流程如下:
已知:
 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。(1)“碱溶”时,化学反应方程式为
(2)“沉降”时,温度需控制在40℃左右,主要原因是
 不利于减少
不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是(3)“酸化”时的装置如图所示,仪器A的名称为
 ,则
,则
 滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
(4)已知溶液pH不同时,钒元素与铝元素存在形式如下表所示,补充完整利用含
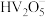 、
、 的碱性废水制取聚合氯化铝的实验方案:取适量废水,
的碱性废水制取聚合氯化铝的实验方案:取适量废水, 、5%的双氧水、蒸馏水、
、5%的双氧水、蒸馏水、 溶液)
溶液)| 化合价 |  |  |
| +4价V | 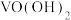 沉淀 沉淀 | 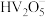 |
| +5价V |  |  |
| +3价Al |  沉淀 沉淀 |  |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
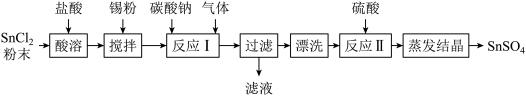
【推荐2】锡及其化合物在生产,生活中有着重要的用途。工业上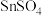 是一种重要的可溶性硫酸盐,广泛应用于镀锡工业,其制备路线如下:
是一种重要的可溶性硫酸盐,广泛应用于镀锡工业,其制备路线如下:
已知:①酸性条件下,锡在水溶液中有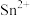 、
、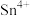 两种主要存在形式,
两种主要存在形式,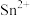 易被氧化,
易被氧化, 易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡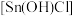 。
。 是极易水解的共价化合物,熔点为
是极易水解的共价化合物,熔点为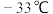 ,沸点为
,沸点为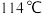 。
。
②
请按要求回答下列相关问题:
(1)写出 的电子式
的电子式_______ 。
(2)加入 粉的作用有两个:
粉的作用有两个:
a调节溶液 。
。
b._______ ;
(3)反应Ⅰ生成的沉淀为 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ ;
(4)反应Ⅱ硫酸的作用之一是控制溶液的 ,若溶液中
,若溶液中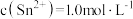 ,则应控制溶液
,则应控制溶液
_______ ;
(5)酸性条件下,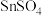 还可以用作双氧水去除剂,请写出发生反应的离子方程式
还可以用作双氧水去除剂,请写出发生反应的离子方程式_______ 。
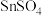 是一种重要的可溶性硫酸盐,广泛应用于镀锡工业,其制备路线如下:
是一种重要的可溶性硫酸盐,广泛应用于镀锡工业,其制备路线如下:
已知:①酸性条件下,锡在水溶液中有
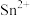 、
、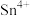 两种主要存在形式,
两种主要存在形式,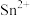 易被氧化,
易被氧化, 易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡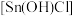 。
。 是极易水解的共价化合物,熔点为
是极易水解的共价化合物,熔点为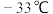 ,沸点为
,沸点为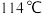 。
。②

请按要求回答下列相关问题:
(1)写出
 的电子式
的电子式(2)加入
 粉的作用有两个:
粉的作用有两个:a调节溶液
 。
。b.
(3)反应Ⅰ生成的沉淀为
 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)反应Ⅱ硫酸的作用之一是控制溶液的
 ,若溶液中
,若溶液中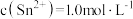 ,则应控制溶液
,则应控制溶液
(5)酸性条件下,
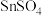 还可以用作双氧水去除剂,请写出发生反应的离子方程式
还可以用作双氧水去除剂,请写出发生反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】含钛高炉渣的主要化学成分为 、
、 、
、 、
、 、
、 、
、 、
、 和金属
和金属 等,对其综合利用具有重要的经济价值和社会效益。
等,对其综合利用具有重要的经济价值和社会效益。
Ⅰ、一种含钛高炉渣提钛工艺流程如下图所示。

已知:① 不溶于水、稀酸和碱溶液;②
不溶于水、稀酸和碱溶液;② 能与强酸、强碱反应。
能与强酸、强碱反应。
(1)盐酸酸浸过程中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“磁选”的目的是___________ 。
(3)下列说法正确的是___________ (填字母序号)。
a、滤渣1的主要成分为 、
、
b、若将流程A部分与流程B部分互换顺序,最终得到的滤渣成分相同
c、若将流程A部分与流程B部分互换顺序,理论上氢氧化钠用量不变
Ⅱ、含钛高炉渣中金属 含量的测定:
含量的测定:
ⅰ、配制金属 浸取液:取一定量的亚硫酸钠和邻菲岁啉(抑制
浸取液:取一定量的亚硫酸钠和邻菲岁啉(抑制 水解)溶于水,加入乙酸和乙酸铵混合溶液调
水解)溶于水,加入乙酸和乙酸铵混合溶液调 ,此时铁的化合物不溶解。
,此时铁的化合物不溶解。
ⅱ、取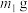 粉碎后的含钛高炉渣,加入足量金属
粉碎后的含钛高炉渣,加入足量金属 浸取液,室温下浸取
浸取液,室温下浸取 。
。
ⅲ、过滤,将滤液及洗涤液全部转移至盛有过量 溶液的烧杯中,加入稀硫酸充分反应。
溶液的烧杯中,加入稀硫酸充分反应。
ⅳ、将反应后的溶液煮沸至冒大气泡并继续微沸 。
。
ⅴ、冷却,用浓度为 的抗坏血酸
的抗坏血酸 标准液滴定,消耗抗坏血酸标准液
标准液滴定,消耗抗坏血酸标准液 。
。
已知:①酸性条件下,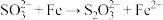 (未配平)
(未配平)
② (抗坏血酸)
(抗坏血酸) (脱氢抗坏血酸)
(脱氢抗坏血酸)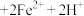
(4)步骤ⅱ中浸取铁时发生反应的离子方程式为___________ 。
(5)步骤ⅲ中加入过量 溶液的主要作用是
溶液的主要作用是___________ (用离子方程式表示)。
(6)该含钛高炉渣中金属 的质量分数=
的质量分数=___________ (用代数式表示)。
(7)下列两种情况均会对“金属 的质量分数”测定结果造成偏差,任选其中一种情况分析并说明判断理由。
的质量分数”测定结果造成偏差,任选其中一种情况分析并说明判断理由。
情况一:配制金属 浸取液时,溶液
浸取液时,溶液 等于2
等于2
情况二:未进行步骤ⅳ,直接用抗坏血酸标准液滴定
①情况___________ 的测定结果___________ (填“偏高”或“偏低”)。
②理由是___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 和金属
和金属 等,对其综合利用具有重要的经济价值和社会效益。
等,对其综合利用具有重要的经济价值和社会效益。Ⅰ、一种含钛高炉渣提钛工艺流程如下图所示。

已知:①
 不溶于水、稀酸和碱溶液;②
不溶于水、稀酸和碱溶液;② 能与强酸、强碱反应。
能与强酸、强碱反应。(1)盐酸酸浸过程中
 发生反应的离子方程式为
发生反应的离子方程式为(2)“磁选”的目的是
(3)下列说法正确的是
a、滤渣1的主要成分为
 、
、
b、若将流程A部分与流程B部分互换顺序,最终得到的滤渣成分相同
c、若将流程A部分与流程B部分互换顺序,理论上氢氧化钠用量不变
Ⅱ、含钛高炉渣中金属
 含量的测定:
含量的测定:ⅰ、配制金属
 浸取液:取一定量的亚硫酸钠和邻菲岁啉(抑制
浸取液:取一定量的亚硫酸钠和邻菲岁啉(抑制 水解)溶于水,加入乙酸和乙酸铵混合溶液调
水解)溶于水,加入乙酸和乙酸铵混合溶液调 ,此时铁的化合物不溶解。
,此时铁的化合物不溶解。ⅱ、取
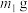 粉碎后的含钛高炉渣,加入足量金属
粉碎后的含钛高炉渣,加入足量金属 浸取液,室温下浸取
浸取液,室温下浸取 。
。ⅲ、过滤,将滤液及洗涤液全部转移至盛有过量
 溶液的烧杯中,加入稀硫酸充分反应。
溶液的烧杯中,加入稀硫酸充分反应。ⅳ、将反应后的溶液煮沸至冒大气泡并继续微沸
 。
。ⅴ、冷却,用浓度为
 的抗坏血酸
的抗坏血酸 标准液滴定,消耗抗坏血酸标准液
标准液滴定,消耗抗坏血酸标准液 。
。已知:①酸性条件下,
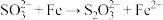 (未配平)
(未配平)②
 (抗坏血酸)
(抗坏血酸) (脱氢抗坏血酸)
(脱氢抗坏血酸)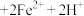
(4)步骤ⅱ中浸取铁时发生反应的离子方程式为
(5)步骤ⅲ中加入过量
 溶液的主要作用是
溶液的主要作用是(6)该含钛高炉渣中金属
 的质量分数=
的质量分数=(7)下列两种情况均会对“金属
 的质量分数”测定结果造成偏差,任选其中一种情况分析并说明判断理由。
的质量分数”测定结果造成偏差,任选其中一种情况分析并说明判断理由。情况一:配制金属
 浸取液时,溶液
浸取液时,溶液 等于2
等于2情况二:未进行步骤ⅳ,直接用抗坏血酸标准液滴定
①情况
②理由是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在_____________ (填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____ 。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
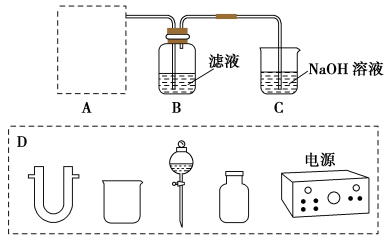
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是________ (选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)加热MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2加热MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____________ 。装置C中NaOH的作用是_______________ 。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
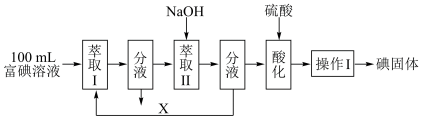
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH-→5I-+IO3-+3H2O;
5I-+IO3-+6H+→3I2+3H2O;
萃取剂X应选择________ (选填编号)。
a.100 mL苯 b.10 mL乙醇 c.10 mL CCl4 d.10 mL己烯
实验室进行萃取操作的仪器是________ 。操作Ⅰ的名称是________ 。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是_________ (填写化学式);②要测定的物理量是________ 。
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。

装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是
a.2NaCl(s)+MnO2+2H2SO4(浓)加热MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2加热MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。

萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH-→5I-+IO3-+3H2O;
5I-+IO3-+6H+→3I2+3H2O;
萃取剂X应选择
a.100 mL苯 b.10 mL乙醇 c.10 mL CCl4 d.10 mL己烯
实验室进行萃取操作的仪器是
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】海带中含有丰富的碘元素,常用作提取碘单质的原料。在实验室我们进行了海带提碘实验,实验流程如下图所示。
已知:①碘易溶于CCl4
②3I2+6NaOH=5NaI+NaIO3+3H2O___________ ,操作2选用装置___________ 。(填“序号”)___________ 。
a.稀硫酸溶液 b.氯水 c.NaOH溶液 d.CCl4
写出试剂1参与反应的离子方程式:___________
(3)加入试剂2后观察到的现象是___________ 。
(4)反萃取第一步加入足量浓NaOH溶液在分液漏斗中进行,振荡并及时放气,判断碘元素由有机层完全进入水层的现象是___________ 。分液后取___________ (填“上层”或“下层”)加入45%的H2SO4溶液
(5)写出加入45%的H2SO4溶液发生反应的离子方程式___________ 。反萃取过程中消耗NaOH和H2SO4的物质的量之比为___________ 。
已知:①碘易溶于CCl4
②3I2+6NaOH=5NaI+NaIO3+3H2O
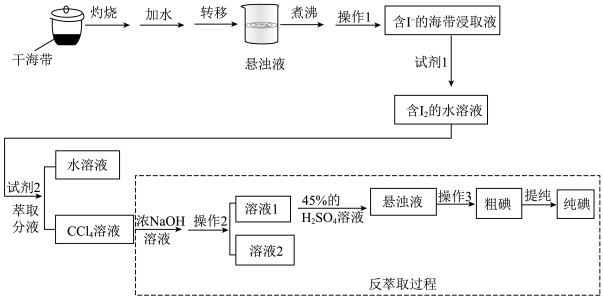
a.稀硫酸溶液 b.氯水 c.NaOH溶液 d.CCl4
写出试剂1参与反应的离子方程式:
(3)加入试剂2后观察到的现象是
(4)反萃取第一步加入足量浓NaOH溶液在分液漏斗中进行,振荡并及时放气,判断碘元素由有机层完全进入水层的现象是
(5)写出加入45%的H2SO4溶液发生反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】海水中含有丰富的人体不可缺少的碘元素,它以碘离子的形式存在。某学生为探究海带中碘元素的存在,按如图流程进行了实验:

回答下列问题:
(1)A步骤的操作名称是____ ;A步骤用到的主要玻璃仪器是____ (选填下列字母代号)
a.漏斗 b.分液漏斗 c.量筒 d.蒸发皿
(2)B步骤中加入的试剂是____ 。
(3)通入Cl2时反应的离子方程式为____ ,其中氧化剂是____ 。
(4)下列试剂,可用来萃取碘水中的碘的有:____ (填字母代号)
A.酒精 B.苯 C.水 D.四氯化碳

回答下列问题:
(1)A步骤的操作名称是
a.漏斗 b.分液漏斗 c.量筒 d.蒸发皿
(2)B步骤中加入的试剂是
(3)通入Cl2时反应的离子方程式为
(4)下列试剂,可用来萃取碘水中的碘的有:
A.酒精 B.苯 C.水 D.四氯化碳
您最近一年使用:0次



