“甲醇经济”是指利用工业废气或大气捕获的CO2制备甲醇(CH3OH),以减轻人类对化石燃料的依赖,实验室在体积为2L的密闭容器中充入1molCO2和3molH2在催化剂作用下通过反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.4kJ·mol-1制备甲醇,实验测得CH3OH和CO2的物质的量随时间的变化关系如图所示。
CH3OH(g)+H2O(g) △H=-49.4kJ·mol-1制备甲醇,实验测得CH3OH和CO2的物质的量随时间的变化关系如图所示。
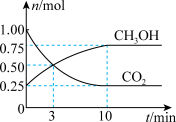
(1)0~3min内,CO2的转化率为____ 。
(2)由图可知,当反应进行到____ (填“3min”或“10min”)时,正反应速率和逆反应速率恰好相等。
(3)下列情况能说明该反应达到化学平衡状态的是____ (填字母)。
a.单位时间内消耗1molCO2的同时生成1molCH3OH
b.H2的物质的量浓度不再发生变化
c.容器内总压强不再发生变化
d.混合气体的密度不再发生变化
(4)若上述反应中生成水的总物质的量不变,但水为液态,则反应过程中放出的热量____ (填“增多”、“减少”或“不变”)。
(5)若上述反应在2L的绝热密闭容器中进行,则反应在达到平衡状态之前,正反应速率先增大后减小。请简述正反应速率增大的原因:____ 。
 CH3OH(g)+H2O(g) △H=-49.4kJ·mol-1制备甲醇,实验测得CH3OH和CO2的物质的量随时间的变化关系如图所示。
CH3OH(g)+H2O(g) △H=-49.4kJ·mol-1制备甲醇,实验测得CH3OH和CO2的物质的量随时间的变化关系如图所示。
(1)0~3min内,CO2的转化率为
(2)由图可知,当反应进行到
(3)下列情况能说明该反应达到化学平衡状态的是
a.单位时间内消耗1molCO2的同时生成1molCH3OH
b.H2的物质的量浓度不再发生变化
c.容器内总压强不再发生变化
d.混合气体的密度不再发生变化
(4)若上述反应中生成水的总物质的量不变,但水为液态,则反应过程中放出的热量
(5)若上述反应在2L的绝热密闭容器中进行,则反应在达到平衡状态之前,正反应速率先增大后减小。请简述正反应速率增大的原因:
更新时间:2022/04/24 22:51:44
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】一定温度下将3molA及3molB混合于2L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(L▪min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(L▪min)。求:
(1)平衡时B的浓度=___ mol/L。
(2)D的平均反应速率v(D)=___ mol/(L·min)。
(3)x=___ 。
 xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(L▪min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(L▪min)。求:(1)平衡时B的浓度=
(2)D的平均反应速率v(D)=
(3)x=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为___________ mol/(L·min);当活性炭消耗0.015mol时,反应的时间___________ (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是_________ 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为__________ 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理由__________ 。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| 活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)反应A(g)+B(g)=C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:
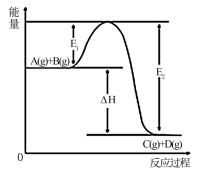
①该反应是___________ 反应(填“吸热或放热”),ΔH=___________ (用E1、E2表示);
②加入催化剂对该反应的ΔH是否有影响?___________ 。
(2)CO2会带来温室效应。目前,工业上采用氢气还原CO2制备乙醇的方法已经实现:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。在2L恒容密闭容器中充入4mol CO2和8mol H2,在一定温度下反应,测得混合气体中c(C2H5OH)与时间的关系如图所示。
C2H5OH(g)+3H2O(g)。在2L恒容密闭容器中充入4mol CO2和8mol H2,在一定温度下反应,测得混合气体中c(C2H5OH)与时间的关系如图所示。
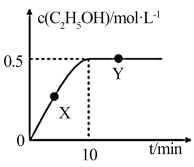
①0~10min内,v(H2O)=___________ mol∙L-1∙min-1。
②反应达到平衡时,n(H2)=___________ mol。
③在该温度下,该反应的化学平衡常数K___________ (保留两位小数)。
(3)在恒容密闭容器中发生反应CH4(g)+4NO2(g)⇌4NO(g)+CO2(g)+2H2O(g)。下列说法能作为判断该反应达到化学平衡状态标志的是____ 。
A.容器内混合气体的密度保持不变
B.v正(NO2)=4v逆(CO2)
C.容器内压强保持不变
D.单位时间内,消耗n mol NO2的同时生成n mol NO
(1)反应A(g)+B(g)=C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:

①该反应是
②加入催化剂对该反应的ΔH是否有影响?
(2)CO2会带来温室效应。目前,工业上采用氢气还原CO2制备乙醇的方法已经实现:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g)。在2L恒容密闭容器中充入4mol CO2和8mol H2,在一定温度下反应,测得混合气体中c(C2H5OH)与时间的关系如图所示。
C2H5OH(g)+3H2O(g)。在2L恒容密闭容器中充入4mol CO2和8mol H2,在一定温度下反应,测得混合气体中c(C2H5OH)与时间的关系如图所示。
①0~10min内,v(H2O)=
②反应达到平衡时,n(H2)=
③在该温度下,该反应的化学平衡常数K
(3)在恒容密闭容器中发生反应CH4(g)+4NO2(g)⇌4NO(g)+CO2(g)+2H2O(g)。下列说法能作为判断该反应达到化学平衡状态标志的是
A.容器内混合气体的密度保持不变
B.v正(NO2)=4v逆(CO2)
C.容器内压强保持不变
D.单位时间内,消耗n mol NO2的同时生成n mol NO
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由图表示:

在下列因素中
①盐酸的浓度 ②镁带的表面积 ③溶液的浓度 ④氢气的压强 ⑤Cl−的浓度
(1)影响反应速率的因素___ ;
(2)解释图中AB段形成的原因___ ;
(3)解释图中t1时刻后速率变小的原因___

在下列因素中
①盐酸的浓度 ②镁带的表面积 ③溶液的浓度 ④氢气的压强 ⑤Cl−的浓度
(1)影响反应速率的因素
(2)解释图中AB段形成的原因
(3)解释图中t1时刻后速率变小的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】含氮物质是重要的化工产品之一,研究含氮物质对能源利用、环境保护有重要的意义。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向2 L的密闭容器中加入1.0 mol活性炭和2.0 mol NO,发生反应: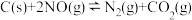
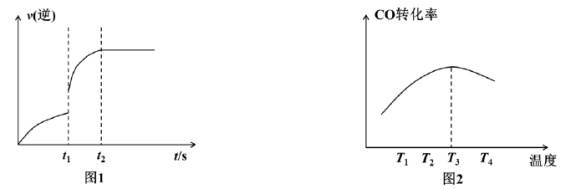
①该反应的逆反应速率随时间变化的关系如图1。在t1时改变某种条件,反应在t2时达到平衡,则改变的条件不可能是__________________
A.升温 B.加压 C.使用催化剂 D.增大NO的浓度
②T℃时,反应达到平衡,测得平衡体系中N2的体积分数为30%,则该温度下反应的平衡常数K=__________________ (保留两位有效数字).
(2)汽车尾气中主要污染物是NO和CO,在一定条件下能反应生成N2和CO2.
a.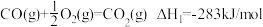
b.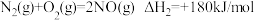
c.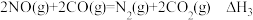
①△H3=_____________ kJ/mol。
②在恒容的密闭容器中,发生反应c,测得反应经相同时间t,CO的转化率随温度的变化关系如图2所示,请在图2画出CO的平衡转化率随温度变化曲线__________________ .
(3)实验发现生产硝酸过程中,升高温度NO和O2反应速度减慢,反应分步进行:
Ⅰ.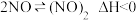 (快平衡)
(快平衡)
Ⅱ.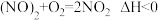 (慢反应)
(慢反应)
原因是__________________
(1)用活性炭还原法可以处理氮氧化物。某研究小组向2 L的密闭容器中加入1.0 mol活性炭和2.0 mol NO,发生反应:
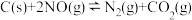

①该反应的逆反应速率随时间变化的关系如图1。在t1时改变某种条件,反应在t2时达到平衡,则改变的条件不可能是
A.升温 B.加压 C.使用催化剂 D.增大NO的浓度
②T℃时,反应达到平衡,测得平衡体系中N2的体积分数为30%,则该温度下反应的平衡常数K=
(2)汽车尾气中主要污染物是NO和CO,在一定条件下能反应生成N2和CO2.
a.
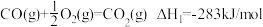
b.
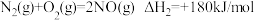
c.
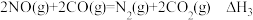
①△H3=
②在恒容的密闭容器中,发生反应c,测得反应经相同时间t,CO的转化率随温度的变化关系如图2所示,请在图2画出CO的平衡转化率随温度变化曲线
(3)实验发现生产硝酸过程中,升高温度NO和O2反应速度减慢,反应分步进行:
Ⅰ.
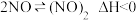 (快平衡)
(快平衡)Ⅱ.
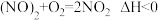 (慢反应)
(慢反应)原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。

回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____ Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图象分析:温度位于330℃—400℃时,升高温度,V反应的反应速率_____ ,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________ 。
(1)下列选项中属于重点城市空气质量日报首要污染物的是
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。

回答下面问题
①汽车尾气消污反应最适宜的反应温度是
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能
“<”、“>”或“=”),理由是
④结合反应机理和图象分析:温度位于330℃—400℃时,升高温度,V反应的反应速率
您最近一年使用:0次
【推荐1】恒容容器中发生可逆反应:M(g)+N(g)=P(g)+Q(g)+R(s) ΔH>0,请回答下列问题。
(1)该反应达到平衡状态时,下列说法正确的是___________。
(2)在某温度下,起始时c(M)=1.25mol·L-1、c(N)=2mol·L-1,达到平衡后,N的转化率为50%,此时M的转化率为___________ 。
(3)若保持温度不变,起始时c(M)=6mol·L-1、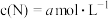 ,达到平衡后
,达到平衡后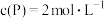 ,则
,则
___________ 。
(4)若保持温度不变,起始时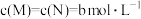 ,达到平衡后,N的转化率为
,达到平衡后,N的转化率为___________ (保留小数点后一位)。
(1)该反应达到平衡状态时,下列说法正确的是___________。
| A.体系内压强不再变化 | B.容器内气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 | D.V(M)=V(p) |
(3)若保持温度不变,起始时c(M)=6mol·L-1、
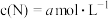 ,达到平衡后
,达到平衡后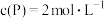 ,则
,则
(4)若保持温度不变,起始时
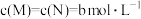 ,达到平衡后,N的转化率为
,达到平衡后,N的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】大气污染是环境污染的一个重要方面,《国家环境保护法》严禁把大气污染物大量排入大气。硫元素的氢化物与氧化物都是大气污染物,它的单质是我国古代四大发明之一黑火药的重要成分。试回答:
(1)写出硫元素的氢化物的化学式______ ,存在的化学键类型是______ 。
(2)用足量的氢氧化钠溶液来吸收硫元素的氢化物,其反应的离子方程式是______ 。
(3)硫和氧气直接反应的产物是形成酸雨的主要原因之一,则该氧化物的名称是______ 。
(4)在反应2SO2+O22SO3的平衡体系中,加入18O的氧气。平衡发生移动后,SO2中是否含有18O______ ,原因是______ 。
(5)下列实验,能说明浓硫酸有脱水性的是______ ,有氧化性的是______ ,是高沸点酸的是______ 。
a. 能与铜反应放出SO2
b. 能与NaCl反应制取氯化氢
c.浓硫酸滴在纸片上发生炭化变黑现象
(6)火药点燃后发生的反应如下:S+2KNO3+3C=K2S+3CO2↑+N2↑,其中还原剂是______ 。
(1)写出硫元素的氢化物的化学式
(2)用足量的氢氧化钠溶液来吸收硫元素的氢化物,其反应的离子方程式是
(3)硫和氧气直接反应的产物是形成酸雨的主要原因之一,则该氧化物的名称是
(4)在反应2SO2+O22SO3的平衡体系中,加入18O的氧气。平衡发生移动后,SO2中是否含有18O
(5)下列实验,能说明浓硫酸有脱水性的是
a. 能与铜反应放出SO2
b. 能与NaCl反应制取氯化氢
c.浓硫酸滴在纸片上发生炭化变黑现象
(6)火药点燃后发生的反应如下:S+2KNO3+3C=K2S+3CO2↑+N2↑,其中还原剂是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):
PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):
请回答下列问题:
(1)x的值是________ ;
(2)0-50s内,用PCl3的浓度变化表示的化学反应速率是________ ;
(3)250s以后,Cl2的物质的量不再改变的原因是_______________ ;
(4)250s时,容器中Cl2的物质的量是_____ ,PCl5的物质的量是______ ,PCl5的转化率是______ 。
 PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):
PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):t/s | 0 | 50 | 100 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x | |
(1)x的值是
(2)0-50s内,用PCl3的浓度变化表示的化学反应速率是
(3)250s以后,Cl2的物质的量不再改变的原因是
(4)250s时,容器中Cl2的物质的量是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学反应速率和化学反应限度与生产、生活密切相关。
(1) 、
、 、
、 等都是重要的能源,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中
等都是重要的能源,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中 的含量,有效地开发利用
的含量,有效地开发利用 ,工业上可以用
,工业上可以用 来生产甲醇燃料。在体积为2L的密闭容器中,充入
来生产甲醇燃料。在体积为2L的密闭容器中,充入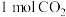 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
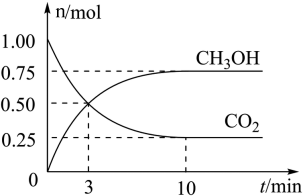
①从反应开始到平衡, 的平均反应速率
的平均反应速率
_______ 。
②达到平衡时, 的转化率为
的转化率为_______ 。
(2)某学生探究锌(足量)与100mL盐酸( )反应过程中的速率变化,为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
)反应过程中的速率变化,为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
(3)某实验小组以 分解为例,研究浓度、催化剂、温度对反应速率的影响,按照下述方案完成实验。
分解为例,研究浓度、催化剂、温度对反应速率的影响,按照下述方案完成实验。
通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
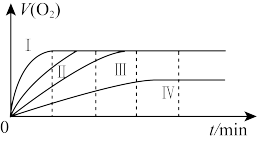
①代表实验a的图示是_______ 。
②实验c和d的目的是_______ 。
③通过表中对比实验,所得出的实验结论是_______ 。
(1)
 、
、 、
、 等都是重要的能源,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中
等都是重要的能源,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中 的含量,有效地开发利用
的含量,有效地开发利用 ,工业上可以用
,工业上可以用 来生产甲醇燃料。在体积为2L的密闭容器中,充入
来生产甲醇燃料。在体积为2L的密闭容器中,充入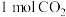 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率
②达到平衡时,
 的转化率为
的转化率为(2)某学生探究锌(足量)与100mL盐酸(
 )反应过程中的速率变化,为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
)反应过程中的速率变化,为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。| A.蒸馏水 | B. 溶液 溶液 | C.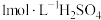 | D. 溶液 溶液 |
 分解为例,研究浓度、催化剂、温度对反应速率的影响,按照下述方案完成实验。
分解为例,研究浓度、催化剂、温度对反应速率的影响,按照下述方案完成实验。| 实验编号 | 反应物 | 催化剂 | 温度/℃ |
| a | 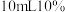 的 的 溶液 溶液 | 无 | 25 |
| b | 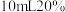 的 的 溶液 溶液 | 无 | 25 |
| c | 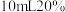 的 的 溶液 溶液 | 无 | 40 |
| d | 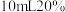 的 的 溶液 溶液 | 1~2滴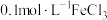 溶液 溶液 | 40 |

①代表实验a的图示是
②实验c和d的目的是
③通过表中对比实验,所得出的实验结论是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
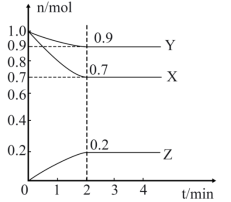
【推荐2】温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:___________ ;
(2)下列措施能加快反应速率的是___________(填序号,下同);
(3)能说明该反应已达到平衡状态的是___________ (填字母);
A.v(X)=v(Y) B.2v正(Y)=v逆(Z) C.容器内压强保持不变
D.容器内混合气体的密度保持不变 E.X、Y、Z的浓度相等
(4)反应达平衡时,此时体系的压强是开始时的___________ 倍;
(5)0到2min用X表示该反应的速率v(X)=___________ ;
(6)在2A(g)+3B(g)=C(g)+4D(g)反应中,表示该反应的化学反应速度最快的是___________。
(2)下列措施能加快反应速率的是___________(填序号,下同);
| A.恒压时充入He | B.恒容时充入He | C.恒容时充入X | D.及时分离出Z |
A.v(X)=v(Y) B.2v正(Y)=v逆(Z) C.容器内压强保持不变
D.容器内混合气体的密度保持不变 E.X、Y、Z的浓度相等
(4)反应达平衡时,此时体系的压强是开始时的
(5)0到2min用X表示该反应的速率v(X)=
(6)在2A(g)+3B(g)=C(g)+4D(g)反应中,表示该反应的化学反应速度最快的是___________。
| A.v(A)=0.5mol·L-1·s-1 | B.v(B)=0.3mol·L-1·s-1 |
| C.v(C)=0.4mol·L-1·s-1 | D.v(D)=2.0mol·L-1·min-1 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3⇌N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
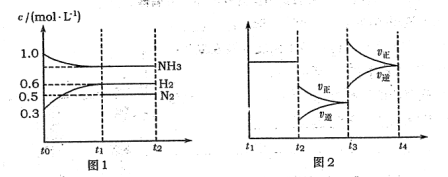
(1)能证明反应达到平衡状态的是_______ (填标号,下同)。
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl="15" s,则t0-t1阶段以H2浓度变化表示的反应速率为_______ 。
(3)t3-t4阶段改变的条件为_______ 。
(4)上述反应的平衡常数K=_______ (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡_______ 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c( )<c(Cl-)时,则反应的情况可能为
)<c(Cl-)时,则反应的情况可能为_______
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c( )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= _______ 。

(1)能证明反应达到平衡状态的是
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl="15" s,则t0-t1阶段以H2浓度变化表示的反应速率为
(3)t3-t4阶段改变的条件为
(4)上述反应的平衡常数K=
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(
 )<c(Cl-)时,则反应的情况可能为
)<c(Cl-)时,则反应的情况可能为a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(
 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次



