有效去除烟气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)O3能将NO和NO2转化成绿色硝化剂N2O5。已知下列热化学方程式:
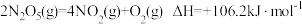
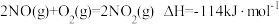

则反应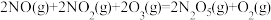 的
的
_______ 。
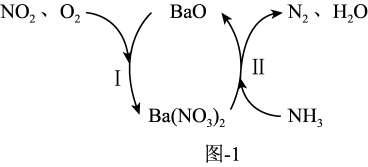
(2)一种通过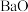 和
和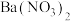 的相互转化脱除
的相互转化脱除 的原理如图1所示。脱除
的原理如图1所示。脱除 的总反应为
的总反应为_______ 。
(3)NH3在催化剂作用下能与烟气(主要为空气,含少量NOx)中的NOx反应,实现NOx的脱除。常见的催化剂有V2O5等。反应的催化剂附在载体的表面,该载体为Ti的氧化物,其有两种晶体类型,分别如图2(a)、(b)所示,其中晶体a比表面积大,附着能力强,可用作载体,一定温度下可转化为晶体b。在V2O5催化下,NOx的脱除机理如图3所示。
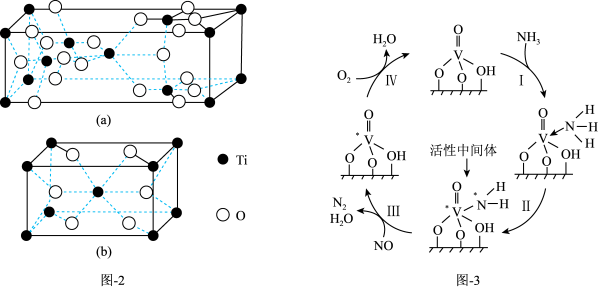
①晶体b的化学式为_______ 。
②转化IV中,V元素化合价的变化为_______ 。
③脱除NOx时须控制反应的温度,实验发现,其他条件一定,当温度过高时,NOx的脱除率会降低,原因除高温下不利于NH3的吸附、催化剂本身活性降低外,还可能的原因是_______ 和_______ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)O3能将NO和NO2转化成绿色硝化剂N2O5。已知下列热化学方程式:
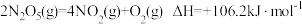
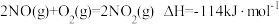

则反应
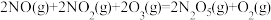 的
的
(2)一种通过
 和
和 的相互转化脱除
的相互转化脱除 的原理如图1所示。脱除
的原理如图1所示。脱除 的总反应为
的总反应为
(3)NH3在催化剂作用下能与烟气(主要为空气,含少量NOx)中的NOx反应,实现NOx的脱除。常见的催化剂有V2O5等。反应的催化剂附在载体的表面,该载体为Ti的氧化物,其有两种晶体类型,分别如图2(a)、(b)所示,其中晶体a比表面积大,附着能力强,可用作载体,一定温度下可转化为晶体b。在V2O5催化下,NOx的脱除机理如图3所示。

①晶体b的化学式为
②转化IV中,V元素化合价的变化为
③脱除NOx时须控制反应的温度,实验发现,其他条件一定,当温度过高时,NOx的脱除率会降低,原因除高温下不利于NH3的吸附、催化剂本身活性降低外,还可能的原因是
2022·江苏南通·模拟预测 查看更多[6]
(已下线)江苏省南通市如皋市2021-2022学年高三下学期 4月适应性考试(二)化学试题(已下线)化学-2022年高考押题预测卷02(江苏卷)江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题(已下线)2022年江苏卷高考真题变式题14-17山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题河南省周口恒大中学2023-2024学年高二下学期3月月考化学试题
更新时间:2022-04-21 18:22:09
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____ (填“>”“<”或“=”)7。将烟气通入 (NH4)2SO3溶液可以继续吸收SO2 ,用离子方程式表示出能吸收二氧化硫的原因_________ 。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是
N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______ (填选项编号)。
A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_______________________________________ 。
②一定条件下 , 往 2L 恒容密闭容器中充入 1.0molCO2 和 3.0molH2,在不同催化剂作用下, 相同时间内 CO2 的转化率随温度变化如图1所示:
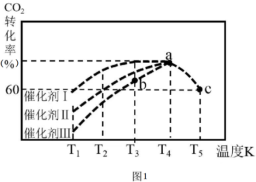
催化剂效果最佳的是催化剂______ ( 填“I ” , “Ⅱ” , “Ⅲ” ) 。 b 点 v( 正 )___ v( 逆 ) ( 填“ > ” , “ < ” , “ = ” ) 。此反应在 a 点时已达平衡状态, a 点的转化率比 c 点高的原因是 _______ 。已知容器内的起始压强为100kPa,则图中 c 点对应温度下反应的平衡常数 Kp=________ 。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
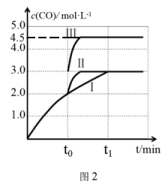
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 ____ 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 ________ 。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是
N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式
②一定条件下 , 往 2L 恒容密闭容器中充入 1.0molCO2 和 3.0molH2,在不同催化剂作用下, 相同时间内 CO2 的转化率随温度变化如图1所示:


催化剂效果最佳的是催化剂
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】现代煤化工产生的 是一种重要的工业资源。
是一种重要的工业资源。
Ⅰ. 的分解反应可用于高效制氢气,在密闭容器中充入一定量
的分解反应可用于高效制氢气,在密闭容器中充入一定量 ,发生反应
,发生反应 ,如图为
,如图为 气体的平衡转化率与温度、压强的关系。
气体的平衡转化率与温度、压强的关系。
(1)该反应的活化能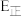
___________ 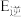 (填“>”、“<”或“=”);在
(填“>”、“<”或“=”);在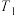 ,
,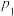 下,往2L密闭容器中充入
下,往2L密闭容器中充入 进行反应,2
进行反应,2 达到平衡状态,计算0~2
达到平衡状态,计算0~2 内
内 的平均反应速率
的平均反应速率
___________  。
。
(2)图中压强 ,
, 、
、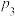 从大到小顺序为
从大到小顺序为___________ ,原因是___________ 。
Ⅱ. 可转化成羰基硫(
可转化成羰基硫(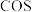 ):
):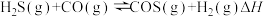
(3)已知: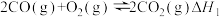
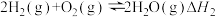
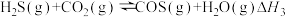
上述反应热效应之间的关系式为
___________ 。
(4)绝热恒压下,密闭容器中充入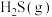 与
与 进行上述反应。下列事实能说明反应达到平衡状态的是
进行上述反应。下列事实能说明反应达到平衡状态的是___________ (填标号)。
A.混合气体的平均相对分子质量不再改变
B.生成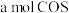 ,同时形成
,同时形成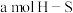 键
键
C.化学平衡常数不再改变
D.混合气体的密度不再改变
(5)T℃下,将等物质的量的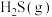 与
与 充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为
充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为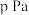 ,
, 的体积分数为10%。则此时该反应的平衡常数
的体积分数为10%。则此时该反应的平衡常数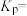
___________ (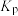 为以分压表示的平衡常数,其中分压=总压×物质的量分数)。
为以分压表示的平衡常数,其中分压=总压×物质的量分数)。
(6)利用膜电解法转化 。在酸性水溶液中,
。在酸性水溶液中, 在阳极上转化为
在阳极上转化为 ,其电极反应式为
,其电极反应式为___________ 。
 是一种重要的工业资源。
是一种重要的工业资源。Ⅰ.
 的分解反应可用于高效制氢气,在密闭容器中充入一定量
的分解反应可用于高效制氢气,在密闭容器中充入一定量 ,发生反应
,发生反应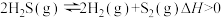 ,如图为
,如图为 气体的平衡转化率与温度、压强的关系。
气体的平衡转化率与温度、压强的关系。
(1)该反应的活化能
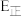
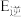 (填“>”、“<”或“=”);在
(填“>”、“<”或“=”);在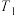 ,
,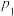 下,往2L密闭容器中充入
下,往2L密闭容器中充入 进行反应,2
进行反应,2 达到平衡状态,计算0~2
达到平衡状态,计算0~2 内
内 的平均反应速率
的平均反应速率
 。
。(2)图中压强
 ,
, 、
、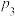 从大到小顺序为
从大到小顺序为Ⅱ.
 可转化成羰基硫(
可转化成羰基硫(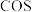 ):
):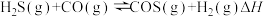
(3)已知:
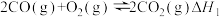
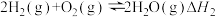
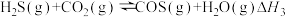
上述反应热效应之间的关系式为

(4)绝热恒压下,密闭容器中充入
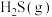 与
与 进行上述反应。下列事实能说明反应达到平衡状态的是
进行上述反应。下列事实能说明反应达到平衡状态的是A.混合气体的平均相对分子质量不再改变
B.生成
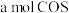 ,同时形成
,同时形成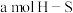 键
键C.化学平衡常数不再改变
D.混合气体的密度不再改变
(5)T℃下,将等物质的量的
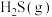 与
与 充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为
充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为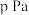 ,
, 的体积分数为10%。则此时该反应的平衡常数
的体积分数为10%。则此时该反应的平衡常数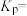
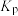 为以分压表示的平衡常数,其中分压=总压×物质的量分数)。
为以分压表示的平衡常数,其中分压=总压×物质的量分数)。(6)利用膜电解法转化
 。在酸性水溶液中,
。在酸性水溶液中, 在阳极上转化为
在阳极上转化为 ,其电极反应式为
,其电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。已知:CO(g)+2H2(g) CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________ 。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2发生反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
①5min时三个容器中的反应达到化学平衡状态的是容器_______ (填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______ 。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器___________ 。(填序号)
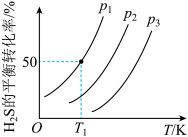
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg 与温度(T)的关系如图所示。下列说法正确的是
与温度(T)的关系如图所示。下列说法正确的是_____ (填字母)。
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
请写出加入(通入)a物质一极的电极反应式_________ ;每消耗6.4g甲醇转移的电子数为____ 。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________ 。
 CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。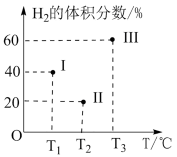
①5min时三个容器中的反应达到化学平衡状态的是容器
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg
 与温度(T)的关系如图所示。下列说法正确的是
与温度(T)的关系如图所示。下列说法正确的是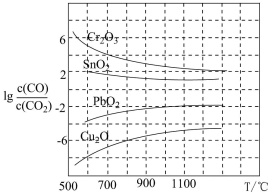
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)a物质一极的电极反应式
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(一): (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH1=-159 kJ·mol−1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g); ΔH2=a kJ·mol−1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g); ΔH3=-87kJ·mol−1
则a为___________ 。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=___________ (假设空气中氧气的体积含量为20%)。
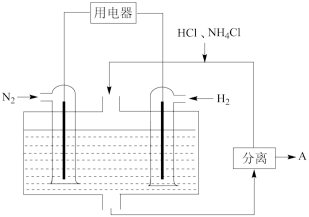
(3)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl - NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式___________ ,生产中可分离出的物质A的化学式为___________ 。
(二): 向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应:C(s) + 2NO(g) N2(g) + CO2(g) △H<0,NO和N2的物质的量变化如下表所示。
(1)T1℃温度下,反应进行了5min,用二氧化碳表示该反应的平均反应速率
___________ 。
(2)已知:气体分压(P分)=气体总压(P总)×体积分数。T1时用平衡分压代替平衡浓度计算平衡常数KP=___________ 。
(3)第15min后,温度调整到T2,数据变化如上表所示,则T1___________ T2(填“>”、“<”或“=”)。
(4)若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”)。
(一): (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH1=-159 kJ·mol−1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g); ΔH2=a kJ·mol−1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g); ΔH3=-87kJ·mol−1
则a为
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=
(3)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl - NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式

(二): 向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应:C(s) + 2NO(g) N2(g) + CO2(g) △H<0,NO和N2的物质的量变化如下表所示。
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
(1)T1℃温度下,反应进行了5min,用二氧化碳表示该反应的平均反应速率
(2)已知:气体分压(P分)=气体总压(P总)×体积分数。T1时用平衡分压代替平衡浓度计算平衡常数KP=
(3)第15min后,温度调整到T2,数据变化如上表所示,则T1
(4)若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应
您最近一年使用:0次
【推荐2】我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I: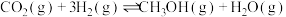
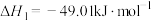
反应Ⅱ: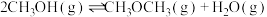
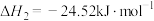
反应Ⅲ:
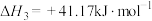
①结合计算分析反应 的自发性:
的自发性:_____ 。
②恒压、投料比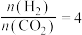 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
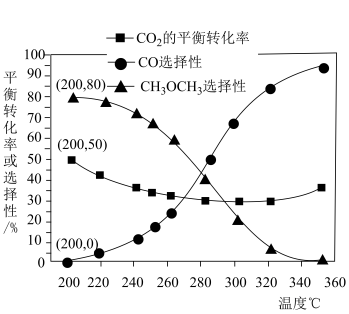
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是_____ 。
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是_____ 。
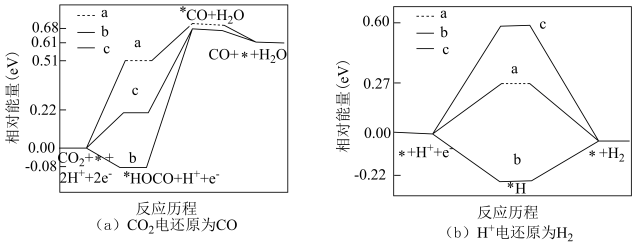
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_____ 。
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_____ (用a、b、c字母排序)。
(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。
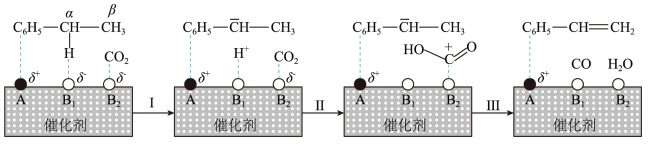
图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:_____ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I:
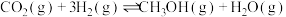
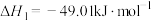
反应Ⅱ:
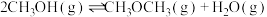
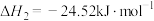
反应Ⅲ:

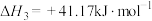
①结合计算分析反应
 的自发性:
的自发性:②恒压、投料比
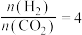 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为

(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。

图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为_______________ 。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________ 。用 CH3OH 表示反应①的速率是_____________ mo l·L-1·m i n -1,可逆反应②的平衡常数 K2=______________________ 。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是____ 。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图所示,则a=________ (填数值)。

(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为______________ 。

①CO(g)+2H2(g)
 CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1②2 CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图所示,则a=

(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为

您最近一年使用:0次
【推荐1】福州大学徐艺军教授团队通过光催化还原CO2,将其合成一碳化合物(CO、HCOOH、CH4、CH3OH等)。常见的无机非贵金属光催化还原CO2的催化剂有CuO、Cu2O、CuxCoyOz、NiO等。回答下列问题:
(1)铜元素的焰色反应呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为_______ 。
A.577~492nm B.597~577nm C.622~597nm
(2)基态Cu2+的价电子排布式为_______ 。
(3)HCOOH、CH4、CH3OH三种物质中碳原子杂化形式有_______ ,催化CO2还原的过程中可能产生 ,该离子的空间构型为
,该离子的空间构型为_______ 。CO可与金属镍形成四面体构型分子Ni(CO)4,CO中与Ni形成配位键的原子是_______ 。
(4)NiO、FeO属于离子晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO_______ (填“<”或“>”)FeO,原因是_______ 。
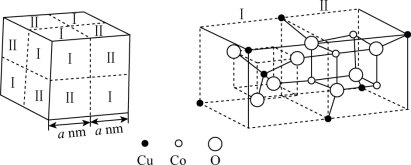
(5)CuxCoyOz还是一种新型的电极材料,其晶胞结构如图。该立方晶胞由4个I型和4个II型小立方体构成,晶体中Co3+占据O2-形成的八面体空隙,其化学式为_______ 。
(1)铜元素的焰色反应呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为
A.577~492nm B.597~577nm C.622~597nm
(2)基态Cu2+的价电子排布式为
(3)HCOOH、CH4、CH3OH三种物质中碳原子杂化形式有
 ,该离子的空间构型为
,该离子的空间构型为(4)NiO、FeO属于离子晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO
(5)CuxCoyOz还是一种新型的电极材料,其晶胞结构如图。该立方晶胞由4个I型和4个II型小立方体构成,晶体中Co3+占据O2-形成的八面体空隙,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)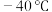 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为___________ , 水解反应的产物为
水解反应的产物为___________ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式___________ , 的分子空间构型为
的分子空间构型为___________ 。 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角___________  中
中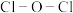 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中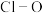 键的键长并说明原因
键的键长并说明原因___________ 。
(3)已知: 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到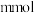 铜粉和
铜粉和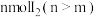 的固体混合物中,振荡。
的固体混合物中,振荡。
实验记录如下:
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是___________ 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
溶液,___________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是___________ 。
(4)一定条件下, 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
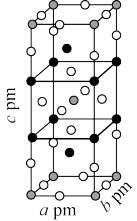
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为___________ 。
(1)
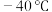 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式 的分子空间构型为
的分子空间构型为 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角 中
中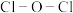 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)已知:
 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到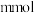 铜粉和
铜粉和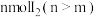 的固体混合物中,振荡。
的固体混合物中,振荡。实验记录如下:
 | 实验现象 | |
| 实验Ⅰ |  | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ |  | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 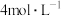 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是 溶液,
溶液,(4)一定条件下,
 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。回答下列问题:
(1)铜晶胞中,铜原子位于立方体的顶点和面心,铜原子的配位数为___________
(2)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),其中非金属元素电负性由大到小的顺序是___________ ,SO 的空间构型为
的空间构型为___________ 。
(3)氨缩脲(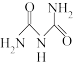 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为___________ ,σ 键与π键的数目之比为___________ 。
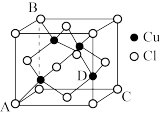
(4)已知CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距为290pm,阿伏加德罗常数的值为NA,则该晶体密度为___________ g·cm-3(列出计算式即可)。
(1)铜晶胞中,铜原子位于立方体的顶点和面心,铜原子的配位数为
(2)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),其中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为(3)氨缩脲(
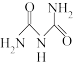 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为(4)已知CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距为290pm,阿伏加德罗常数的值为NA,则该晶体密度为

您最近一年使用:0次



