氮元素的常见化合价及其化合价对应的常见物质的化学式如下表,试回答下列问题:
(1)从化合价上看,N2O5具有_______ (填“氧化”或“还原”)性。
(2)下列试剂不能用于干燥NH3的是_______(填标号)。
(3)NO与NO2中氮元素的价态均处于中间价态,则NO与NO2均既有氧化性又有还原性。
①NO极易与氧气反应,NO表现_______ 性;在一定条件下NO与氨气发生归中反应生成N2,其化学方程式为_______ 。
②NO2可与H2O发生自身歧化反应,反应中氧化剂和还原剂的物质的量之比为_______ ;NO2与NaOH溶液反应可生成两种盐,其中一种是NaNO2,写出NO2与NaOH溶液反应的化学方程式:_______ 。
③汽车排气管上装有催化转化器,可减少尾气对环境的污染,将汽车尾气中的有害气体CO和NO转化为无害气体排放,写出相关反应的化学方程式:_______ 。
④工业生产中利用氨水吸收SO2和NO2,原理如图所示:
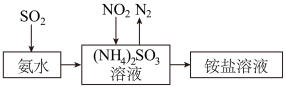
写出NO2被吸收过程中的离子方程式:_______ 。
| 化合价 | -3 | +1 | +2 | +3 | +4 | +5 |
| 化学式 | NH3 | N2O | NO | N2O3 | NO2 | N2O5 |
(1)从化合价上看,N2O5具有
(2)下列试剂不能用于干燥NH3的是_______(填标号)。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.CaCl2固体 |
①NO极易与氧气反应,NO表现
②NO2可与H2O发生自身歧化反应,反应中氧化剂和还原剂的物质的量之比为
③汽车排气管上装有催化转化器,可减少尾气对环境的污染,将汽车尾气中的有害气体CO和NO转化为无害气体排放,写出相关反应的化学方程式:
④工业生产中利用氨水吸收SO2和NO2,原理如图所示:

写出NO2被吸收过程中的离子方程式:
21-22高一下·河北邢台·阶段练习 查看更多[3]
陕西省西安市2022-2023学年高一下学期3月阶段检测化学试题(已下线)1.3.3 氧化还原反应方程式配平(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)河北省邢台市南和区第一中学2021-2022学年高一下学期第三次月考化学试题
更新时间:2022-05-01 12:22:50
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.CO2、碳酸盐、有机物等均是自然界碳循环中的重要物质。回答下列问题:
(1)下列物质属于化合物但不属于电解质的是____ (填标号)。
(2)工业上制取金刚砂的反应为SiO2+3C SiC+2CO↑,则氧化剂与还原剂的物质的量之比为
SiC+2CO↑,则氧化剂与还原剂的物质的量之比为____ 。
(3)含KCN的废水可用氯氧化法处理,反应原理为KCN+2KOH+Cl2=KOCN+2KCl+H2O。该反应中被氧化的元素是____ (填元素符号)。
Ⅱ.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(4)N2O是氨催化氧化的副产物,写出NH3与O2在加热和催化剂作用下生成N2O的化学方程式____ 。
(5)N2O的处理:用特殊催化剂使其分解为对大气友好的气体,则N2O分解的化学方程式为_____ 。
(6)NO和NO2的处理:已除去N2O的氮氧化物可用NaOH溶液吸收,主要反应为:NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。若V(NO)∶V(NO2)=5∶2的混合气体,通过足量NaOH溶液后,溶液中含有N元素的溶质为____ 。
(7)NO的处理:NO能将酸性的NaClO溶液的还原为Cl-,实验测得100mL1.2mol·L-1的NaClO溶液可以吸收标准状况下1.792LNO气体,则反应的离子方程式为____ 。
(1)下列物质属于化合物但不属于电解质的是
| A.石墨 | B.CO2 | C.NH3·H2O | D.CaCO3 |
 SiC+2CO↑,则氧化剂与还原剂的物质的量之比为
SiC+2CO↑,则氧化剂与还原剂的物质的量之比为(3)含KCN的废水可用氯氧化法处理,反应原理为KCN+2KOH+Cl2=KOCN+2KCl+H2O。该反应中被氧化的元素是
Ⅱ.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(4)N2O是氨催化氧化的副产物,写出NH3与O2在加热和催化剂作用下生成N2O的化学方程式
(5)N2O的处理:用特殊催化剂使其分解为对大气友好的气体,则N2O分解的化学方程式为
(6)NO和NO2的处理:已除去N2O的氮氧化物可用NaOH溶液吸收,主要反应为:NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。若V(NO)∶V(NO2)=5∶2的混合气体,通过足量NaOH溶液后,溶液中含有N元素的溶质为
(7)NO的处理:NO能将酸性的NaClO溶液的还原为Cl-,实验测得100mL1.2mol·L-1的NaClO溶液可以吸收标准状况下1.792LNO气体,则反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I、现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。甲同学:向1mol/L的FeCl3溶液中加少量NaOH溶液。乙同学:直接加热饱和FeCl3溶液。丙同学:向25mL沸水中逐滴加入5-6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是___________ 。
(2)证明有Fe(OH)3胶体生成的简单实验操作是___________ 。
II、高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(3)干法制备高铁酸钠的主要反应为: 2FeSO4+6Na2O2=2Na2FeO4+2X+2Na2SO4+O2↑
①该反应中物质X应是___________ ,该反应的还原剂是___________ 。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用___________
(4)已知湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO 、C1-、H2O
、C1-、H2O
①完成并配平湿法制备高铁酸钾(K2FeO4)的离子方程式,并用单线桥标出该反应的电子转移方向和数目:___________
②已知有3.21gFe(OH)3参加了反应,则上述反应共转移了___________ 个电子,
③根据(1)、(2)推测FeO 能和下列
能和下列___________ (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
(1)其中操作正确的同学是
(2)证明有Fe(OH)3胶体生成的简单实验操作是
II、高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(3)干法制备高铁酸钠的主要反应为: 2FeSO4+6Na2O2=2Na2FeO4+2X+2Na2SO4+O2↑
①该反应中物质X应是
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(4)已知湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO
 、C1-、H2O
、C1-、H2O①完成并配平湿法制备高铁酸钾(K2FeO4)的离子方程式,并用单线桥标出该反应的电子转移方向和数目:
②已知有3.21gFe(OH)3参加了反应,则上述反应共转移了
③根据(1)、(2)推测FeO
 能和下列
能和下列A.KMnO4 B.SO2 C.H2S D.O2
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母,下同)
(2)电子工业常用30%的 溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出
溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出 溶液与铜发生反应的离子方程式:
溶液与铜发生反应的离子方程式:_______ 。
(3)高铁酸钾( )是一种新型、高效、多功能绿色水处理剂,比
)是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。
①干法制备高铁酸钠的主要反应为: ,该反应中
,该反应中 是
是_______ 。
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
②湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、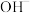 、
、 、
、 、
、 。
。
i.碱性条件下,氧化剂和还原剂的物质的量的比为 发生反应,写出并配平湿法制高铁酸钾的离子方程式:
发生反应,写出并配平湿法制高铁酸钾的离子方程式:_______ 。
ⅱ.若反应过程中转移了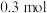 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为_______ 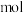 。
。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母,下同)
A. | B. | C. | D. |
 溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出
溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出 溶液与铜发生反应的离子方程式:
溶液与铜发生反应的离子方程式:(3)高铁酸钾(
 )是一种新型、高效、多功能绿色水处理剂,比
)是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。①干法制备高铁酸钠的主要反应为:
 ,该反应中
,该反应中 是
是A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
②湿法制备高铁酸钾的反应体系中有六种微粒:
 、
、 、
、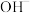 、
、 、
、 、
、 。
。i.碱性条件下,氧化剂和还原剂的物质的量的比为
 发生反应,写出并配平湿法制高铁酸钾的离子方程式:
发生反应,写出并配平湿法制高铁酸钾的离子方程式:ⅱ.若反应过程中转移了
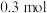 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为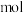 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】图中两圆相交部分(A、B、C、D)表示铁、稀盐酸、澄清石灰水、氯化铜溶液彼此之间的反应关系,写出对应的离子反应方程式。

(1)A_______ 、B_______ 、C_______ 、D_______
(2)用双线桥标出上述氧化还原反应中电子转移的方向和数目。_______
(3)自来水中的 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。_____ Al+ _____  +
+ ________ = _____  +
+_____ N2↑ +_____

(1)A
(2)用双线桥标出上述氧化还原反应中电子转移的方向和数目。
(3)自来水中的
 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。 +
+  +
+
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】“重污染天气”即为“重雾霾天气”。高密度人口的经济及社会活动必然会排放大量细颗粒物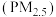 ,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。
,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。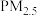 组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中
组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中 的排放显著增加。机动车尾气中的
的排放显著增加。机动车尾气中的 是氮氧化物与
是氮氧化物与 反应产生的,而
反应产生的,而 来源于
来源于 与
与 的反应。
的反应。 可直接参与到
可直接参与到 与
与 的反应中,并加速大气中
的反应中,并加速大气中 及
及 的形成,会加剧雾霾。
的形成,会加剧雾霾。
(1)写出上述材料中,雾霾形成过程中的氧化还原反应化学方程式:___________ (任写一条)。
(2)许多大城市提出“汽车限行”措施,主要指限制汽车运行如限号行驶,以减少汽车运行过程中尾气的排放。“汽车限行”带来诸多的利与弊,引起了人们广泛的讨论。请从你的认识角度,谈谈你对“汽车限行”的态度___________ (阐述观点,并用简短的语言进行论证)。
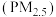 ,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。
,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。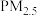 组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中
组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中 的排放显著增加。机动车尾气中的
的排放显著增加。机动车尾气中的 是氮氧化物与
是氮氧化物与 反应产生的,而
反应产生的,而 来源于
来源于 与
与 的反应。
的反应。 可直接参与到
可直接参与到 与
与 的反应中,并加速大气中
的反应中,并加速大气中 及
及 的形成,会加剧雾霾。
的形成,会加剧雾霾。(1)写出上述材料中,雾霾形成过程中的氧化还原反应化学方程式:
(2)许多大城市提出“汽车限行”措施,主要指限制汽车运行如限号行驶,以减少汽车运行过程中尾气的排放。“汽车限行”带来诸多的利与弊,引起了人们广泛的讨论。请从你的认识角度,谈谈你对“汽车限行”的态度
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为_________ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为________ 。该工艺选择氯气的优点是__________ 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为___________ mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4++ 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛bmL于锥形瓶,加入1滴酚酞,用浓度为Cmol/L的NaOH溶液中和,滴定管的初始读数V1mL,当溶液呈微红色时,滴定管的读数V2mL。
②向其中加入饱和食盐水试样amL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3mL。
则饱和食盐水中的含氮量为__________ mg/L。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4++ 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛bmL于锥形瓶,加入1滴酚酞,用浓度为Cmol/L的NaOH溶液中和,滴定管的初始读数V1mL,当溶液呈微红色时,滴定管的读数V2mL。
②向其中加入饱和食盐水试样amL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3mL。
则饱和食盐水中的含氮量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】对于氨气的催化氧化反应:4NH3 +5O2 =4NO + 6H2O
(1)该反应中的还原剂是________ ,被还原的元素是_________ ;
(2)用单线桥标出该反应中电子转移的方向和数目;4NH3 +5O2 =4NO + 6H2O_________
(3)若反应转移了2mol电子,则产生的气体在标准状态下体积约为_______ 。
(1)该反应中的还原剂是
(2)用单线桥标出该反应中电子转移的方向和数目;4NH3 +5O2 =4NO + 6H2O
(3)若反应转移了2mol电子,则产生的气体在标准状态下体积约为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】人体中含有铁元素,+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。
(l)误服亚硝酸盐会使人中毒,是因为二价铁被___ (填“氧化”或“还原”)成三价铁,此 时服用维生素C可缓解亚硝酸盐中毒,维生素C在此过程中是作____ (填“氧化剂”或“还原剂”)。
(2)现有一瓶久置的FeSO4溶液,请设计实验检验其中是否含有Fe3+:___ 。Fe2+在空气中易发生氧化还原反应而变质,可加入____ (填化学式)来防止其变质,而又不会使溶液中有新的杂质。
(3)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaCIO氧化Fe(OH)3来制备,请配平反应方程式:____ ClO—+____ Fe(OH)3+____ OH— =____ FeO42—+_________ +____ Cl—。
(4)向制得的Na2FeO4溶液中加入适量的饱和KOH溶液会析出K2FeO4,写出该反应的化学方程式:____ 。
(l)误服亚硝酸盐会使人中毒,是因为二价铁被
(2)现有一瓶久置的FeSO4溶液,请设计实验检验其中是否含有Fe3+:
(3)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaCIO氧化Fe(OH)3来制备,请配平反应方程式:
(4)向制得的Na2FeO4溶液中加入适量的饱和KOH溶液会析出K2FeO4,写出该反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO还原NO的反应为 。部分化学键的键能数据如下表(CO以
。部分化学键的键能数据如下表(CO以 键构成):
键构成):
①由以上数据可求得NO的键能为_______  。
。
②写出两条有利于提高NO平衡转化率的措施_______ 。
(2)一定条件下,向某恒容密闭容器中充入 和
和 ,发生的反应
,发生的反应 。
。
①图中能表示该反应的平衡常数K与温度T之间的变化关系曲线为_______ (填“a”或“b”),其判断依据是_______ 。

②若 、
、 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示,则在该时间段内,在
的转化率如图所示,则在该时间段内,在 时恰好达到化学平衡,此时容器内的压强与反应开始时的压强之比为
时恰好达到化学平衡,此时容器内的压强与反应开始时的压强之比为_______ 。

(3)在有氧条件下,新型催化剂M能催化 与NOx反应生成
与NOx反应生成 。
。 与
与 生成
生成 的反应中,当生成
的反应中,当生成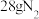 时,转移的电子数为
时,转移的电子数为_______ mol。
(1)CO还原NO的反应为
 。部分化学键的键能数据如下表(CO以
。部分化学键的键能数据如下表(CO以 键构成):
键构成):| 化学键 |  |  |  |
 | 1076 | 945 | 745 |
①由以上数据可求得NO的键能为
 。
。②写出两条有利于提高NO平衡转化率的措施
(2)一定条件下,向某恒容密闭容器中充入
 和
和 ,发生的反应
,发生的反应 。
。①图中能表示该反应的平衡常数K与温度T之间的变化关系曲线为

②若
 、
、 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示,则在该时间段内,在
的转化率如图所示,则在该时间段内,在 时恰好达到化学平衡,此时容器内的压强与反应开始时的压强之比为
时恰好达到化学平衡,此时容器内的压强与反应开始时的压强之比为
(3)在有氧条件下,新型催化剂M能催化
 与NOx反应生成
与NOx反应生成 。
。 与
与 生成
生成 的反应中,当生成
的反应中,当生成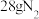 时,转移的电子数为
时,转移的电子数为
您最近一年使用:0次



