浩瀚的海洋里蕴藏着丰富的化学资源,从海带中提取碘单质和从海水中提取溴单质的工艺流程如图。回答下列问题:
I.海带提碘
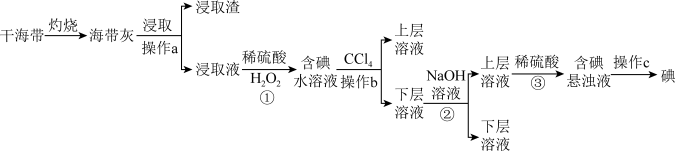
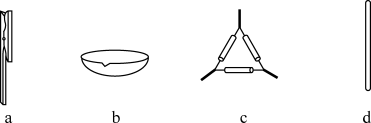
(1)在实验室进行干海带的灼烧操作时,需要用到的下列仪器有____ (填标号)。
(2)浸取液中碘主要以I-存在,写出①发生反应的离子方程式____ 。
(3)操作b的名称为____ 。
(4)写出②加入NaOH溶液的目的____ ;写出③反应中氧化剂与还原剂物质的量之比为____ 。
II.海水提溴
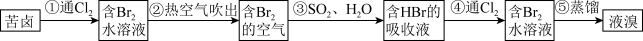
(5)流程中能说明同主族元素性质递变规律的反应为____ (写出离子方程式)。
(6)步骤③化学方程式为____ 。
I.海带提碘

(1)在实验室进行干海带的灼烧操作时,需要用到的下列仪器有

(2)浸取液中碘主要以I-存在,写出①发生反应的离子方程式
(3)操作b的名称为
(4)写出②加入NaOH溶液的目的
II.海水提溴
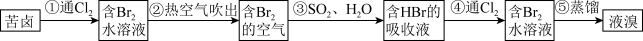
(5)流程中能说明同主族元素性质递变规律的反应为
(6)步骤③化学方程式为
更新时间:2022-05-23 11:17:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如下:

(1)向滤液Ⅰ中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为__________________________________ 。
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2发生反应的离子方程式为__________________ 。
②调滤液ⅡpH的作用是___________________________________ 。
③滤液Ⅱ中杂质金属离子是否除尽的操作和现象是_____________________ 。
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是_________________________________________ 。
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O晶体。
①为了提高产率,蒸发浓缩、冷却结晶、过滤后得到的母液要循环使用,则应该回流到流程中的________ 位置。(填a、b、c、d)
②如果得到产品的纯度不够,则应该进行________ 操作(填序号)。
A.蒸馏 B.分液 C.重结晶 D.过滤

(1)向滤液Ⅰ中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2发生反应的离子方程式为
②调滤液ⅡpH的作用是
③滤液Ⅱ中杂质金属离子是否除尽的操作和现象是
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O晶体。
①为了提高产率,蒸发浓缩、冷却结晶、过滤后得到的母液要循环使用,则应该回流到流程中的
②如果得到产品的纯度不够,则应该进行
A.蒸馏 B.分液 C.重结晶 D.过滤
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】下图所示工艺流程是一种以镀锌管废料(锌灰)为原料制取金属锌的方法。

已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。②Cu++Cl-=CuCl↓。回答下列问题:
(1)滤渣1的主要成分为_______ 。
(2)“酸浸”时,硫酸浓度不能过高,原因是_______ 。
(3)写出“沉铜”时的离子反应方程式:_______ 。
(4)“氧化”时需加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是_______ 。
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH) 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗_______ molKOH。电解池中的总反应离子方程式为:_______ 。

(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S ZnS(s)+2H+。处理后的废水中部分微粒浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒浓度为:
处理后的废水的pH=_______ ,c(Zn2+)=_______ 。[已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5]

已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。②Cu++Cl-=CuCl↓。回答下列问题:
(1)滤渣1的主要成分为
(2)“酸浸”时,硫酸浓度不能过高,原因是
(3)写出“沉铜”时的离子反应方程式:
(4)“氧化”时需加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)
 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S
 ZnS(s)+2H+。处理后的废水中部分微粒浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒浓度为:| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度/(mol·L-1) | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】实验室以二氧化铈(CeO2)废渣为原料制备含少量Cl-的Ce2(CO3)3,其部分实验过程如下:

(1)“酸浸”时将CeO2废渣粉碎的目的是_______________________ 。
(2)pH约为7的CeCl3溶液与NH4HCO3溶液反应可生成沉淀Ce2(CO3)3,该反应的离子方程式为_________________________
(3)通过“中和”“萃取”“反萃取”“沉淀”等过程,可制备含少量Cl-的Ce2(CO3)3。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为Ce3+(水层)+3HA(有机层) CeA3(有机层)+3H+(水层)。
CeA3(有机层)+3H+(水层)。
①加氨水“中和”去除过量盐酸,使溶液接近中性;
②“反萃取”过程中,加入稀硝酸的目的是___________ ;
③与“反萃取”得到的水溶液比较,过滤Ce2(CO)3)3溶液的滤液中,物质的量减小的离子有____ 、___ 。
(4)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用0.4 mol·L-1的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色。实验步骤如下:
a.准确量取25.00 mL Ce3+溶液[c(Ce3+)约为2 mol·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;
b.取出20.00 mL溶液,加入指示剂,用标准溶液进行滴定,记录数据;
c.重复步骤b的操作2~3次,处理数据。
①滴定过程中的离子方程式是__________________________________________ 。
②某同学三次实验的实验数据如表所示。根据表中数据计算c(Ce3+)=__________ (保留三位有效数字)。

(1)“酸浸”时将CeO2废渣粉碎的目的是
(2)pH约为7的CeCl3溶液与NH4HCO3溶液反应可生成沉淀Ce2(CO3)3,该反应的离子方程式为
(3)通过“中和”“萃取”“反萃取”“沉淀”等过程,可制备含少量Cl-的Ce2(CO3)3。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为Ce3+(水层)+3HA(有机层)
 CeA3(有机层)+3H+(水层)。
CeA3(有机层)+3H+(水层)。①加氨水“中和”去除过量盐酸,使溶液接近中性;
②“反萃取”过程中,加入稀硝酸的目的是
③与“反萃取”得到的水溶液比较,过滤Ce2(CO)3)3溶液的滤液中,物质的量减小的离子有
(4)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用0.4 mol·L-1的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色。实验步骤如下:
a.准确量取25.00 mL Ce3+溶液[c(Ce3+)约为2 mol·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;
b.取出20.00 mL溶液,加入指示剂,用标准溶液进行滴定,记录数据;
c.重复步骤b的操作2~3次,处理数据。
| 实验编号 | 滴定前标准溶液的体积读数/mL | 滴定后标准溶液的体积读数/mL |
| 1 | 3.20 | 14.12 |
| 2 | 3.22 | 14.30 |
| 3 | 2.56 | 15.00 |
②某同学三次实验的实验数据如表所示。根据表中数据计算c(Ce3+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】海水资源非常丰富。某化学实验小组同学为了从海带中提取碘和海水提溴,进行以下实验:
I.从海带中提取碘单质,实验流程图如下:
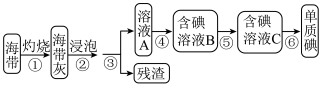
已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。
(2)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,未发现明显变化,再加入F后溶液颜色变蓝,此反应的离子方程式是___________ ;乙同学认为使用稀硫酸和H2O2溶液能更有利于提取碘,写出离子方程式___________ 。
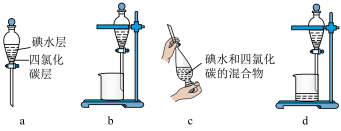
(3)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是___________ (填字母)。
(4)将得到的单质碘,干燥、称量,其质量为n g,则海带中碘元素的含量为___________ 。
II.模拟用空气吹出法从海水中提取溴的工艺流程,如下图:
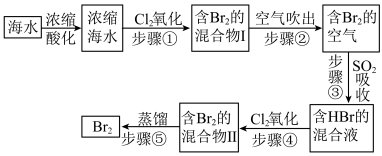
请回答下列问题。
(5)将海水浓缩的方法是___________ 。
(6)步骤②通入热空气吹出Br2,利用了Br2的___________ 性质。
(7)步骤①反应的离子方程式是___________ ,步骤③反应的离子方程式是___________ ,从理论上分析,下列也能吸收溴的是___________ (填字母)。
A.NaOH B.Na2SO3 C.H2O D.FeCl2
(8)已知海水中Br-含量为64mg/L,依据上述流程,若将5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为___________ L(忽略Cl2的溶解)。
I.从海带中提取碘单质,实验流程图如下:

已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,未发现明显变化,再加入F后溶液颜色变蓝,此反应的离子方程式是
(3)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是

(4)将得到的单质碘,干燥、称量,其质量为n g,则海带中碘元素的含量为
II.模拟用空气吹出法从海水中提取溴的工艺流程,如下图:

请回答下列问题。
(5)将海水浓缩的方法是
(6)步骤②通入热空气吹出Br2,利用了Br2的
(7)步骤①反应的离子方程式是
A.NaOH B.Na2SO3 C.H2O D.FeCl2
(8)已知海水中Br-含量为64mg/L,依据上述流程,若将5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】化学在金属矿物和海水资源的开发利用过程中具有重要的意义和作用。按要求回答下列问题。
(1)在工业生产中金属冶炼的原理错误的是_
A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3来制取 Al
C CO 还原 Fe2O3制取 Fe
D 铝热反应原理制锰:4Al+3MnO2 3Mn+2 Al2O3
3Mn+2 Al2O3
(2)下图是从海水中提取溴的简单流程:

提取溴的过程中,经过 2 次 Br- Br2转化的目的是
Br2转化的目的是_____
(3)吸收塔中发生反应的离子方程式是_____
(4)海带中富含碘元素,实验室从海带中提取 I2的途径如下图所示:

①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是_____ 。
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_____ 。
③步骤 V 加入萃取剂 M 为_____ ,步骤 VI 从 I2的有机溶液获得 I2可以用 _____ 的方法。
(1)在工业生产中金属冶炼的原理错误的是
A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3来制取 Al
C CO 还原 Fe2O3制取 Fe
D 铝热反应原理制锰:4Al+3MnO2
 3Mn+2 Al2O3
3Mn+2 Al2O3(2)下图是从海水中提取溴的简单流程:

提取溴的过程中,经过 2 次 Br-
 Br2转化的目的是
Br2转化的目的是(3)吸收塔中发生反应的离子方程式是
(4)海带中富含碘元素,实验室从海带中提取 I2的途径如下图所示:

①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
③步骤 V 加入萃取剂 M 为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海水中蕴藏的元素高达80多种,是人类的重要集散地。如图是对海水资源的综合利用的示意图。

请回答下列问题:
(1)地球上99%上的溴元素存在于海洋中,资料显示海水中溴的含量约为66 mg/L。.如图中制备溴涉及步骤I、II、III,写出步骤III中反应的离子方程式:_________________ 。
(2)制备镁的工艺中,从卤水到MgCl2(aq)经历了Mg2+→ Mg(OH)2→Mg的过程,生成Mg(OH)2的过程看似多余,其实该过程的作用是______________ 。
(3)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气的冷却剂的是_________ (填字母序号)。
A. Ar B. CO2 C. O2 D. N2
(4)在一定温度下, 冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。回答下列问题:

①a、b、c三点对应的溶液中,导电能力由弱到强的顺序是_______________ 。
②a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是______________ 。
③若使c点对应的溶液中的c(CHCOO-)增大,则下列措施中,不可行的是______ (填标号、 下同)。
A.加热 B.加入锌粒 C.加入KOH固体 D.加水 E. 加入CH3COONa固体

请回答下列问题:
(1)地球上99%上的溴元素存在于海洋中,资料显示海水中溴的含量约为66 mg/L。.如图中制备溴涉及步骤I、II、III,写出步骤III中反应的离子方程式:
(2)制备镁的工艺中,从卤水到MgCl2(aq)经历了Mg2+→ Mg(OH)2→Mg的过程,生成Mg(OH)2的过程看似多余,其实该过程的作用是
(3)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气的冷却剂的是
A. Ar B. CO2 C. O2 D. N2
(4)在一定温度下, 冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。回答下列问题:

①a、b、c三点对应的溶液中,导电能力由弱到强的顺序是
②a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是
③若使c点对应的溶液中的c(CHCOO-)增大,则下列措施中,不可行的是
A.加热 B.加入锌粒 C.加入KOH固体 D.加水 E. 加入CH3COONa固体
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】从海水中可以获得淡水、食盐并可提取镁和溴等物质。
实验(一)海水提溴:空气吹出法是工业规模提溴的常用方法,其流程如图:

(1)步骤④反应的离子方程式为_____ 。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,转移电子的物质的量为_____ mol。
实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:

已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
(2)“适量O2”中能代替O2的最佳物质是_____ 。
(3)步骤X中,萃取后分液漏斗内观察到的现象是_____ 。
(4)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为_____ ,其中操作Z的名称是_____ 。
实验(一)海水提溴:空气吹出法是工业规模提溴的常用方法,其流程如图:

(1)步骤④反应的离子方程式为
实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:

已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
(2)“适量O2”中能代替O2的最佳物质是
(3)步骤X中,萃取后分液漏斗内观察到的现象是
(4)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】自然资源的综合利用对人类极其重要。回答下列问题:
I、海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
干海带 干海带灰
干海带灰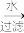 滤液
滤液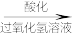
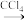
 I2
I2
(1)灼烧海带至灰烬时所用的主要仪器名称是_______ 。
(2)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_______ 。
(3)反应结束后,加入CCl4从碘水中提取碘,主要操作步骤如图:

上述3步实验操作中,不正确的是(填序号)_______ ,原因_______ 。
II、海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(4)除去粗盐中杂质(Mg2+、 、Ca2+),加入的药品顺序可以是
、Ca2+),加入的药品顺序可以是_______ (填编号)。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
(5)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是_______ 。写出步骤II中发生反应的化学方程式_______ 。
(6)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量与原溶液中I-的物质的量的比值为_______ 。
I、海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
干海带
 干海带灰
干海带灰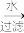 滤液
滤液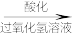
 I2
I2(1)灼烧海带至灰烬时所用的主要仪器名称是
(2)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
(3)反应结束后,加入CCl4从碘水中提取碘,主要操作步骤如图:

上述3步实验操作中,不正确的是(填序号)
II、海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(4)除去粗盐中杂质(Mg2+、
 、Ca2+),加入的药品顺序可以是
、Ca2+),加入的药品顺序可以是A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
(5)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是
(6)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量与原溶液中I-的物质的量的比值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】已知:Cl2+2I-=2Cl-+I2,海藻中富含碘元素。某化学兴趣小组的同学在实验室里用灼烧海藻的灰分提取碘,其流程如下图。请回答下列问题:

(1)验证“含I-溶液”和“碘水”中含有的I-和I2所需的试剂分别是____ 和_____ 。
(2)操作②选用CCl4的理由是___________(填序号)。
(3)用NaOH浓溶液反萃取后再加稀硫酸,可以分离I2和CCl4,有关化学方程式为:
碱性条件:3I2+6NaOH=5NaI+NaIO3+3H2O
酸性条件:5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+3H2O
以下是反萃取过程的操作,请按要求填空:
①向装有I2的CCl4溶液的___________ (填仪器名称)中加入少量1 mol·L-1NaOH溶液;
②振荡至溶液的___________ 色消失,静置、分层;
③将含碘的碱溶液从仪器的___________ (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol‧L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是___________ 。

(1)验证“含I-溶液”和“碘水”中含有的I-和I2所需的试剂分别是
(2)操作②选用CCl4的理由是___________(填序号)。
| A.CCl4不溶于水 |
| B.CCl4的密度比水大 |
| C.碘在CCl4中比在水中溶解度更大 |
| D.CCl4与碘水不反应 |
碱性条件:3I2+6NaOH=5NaI+NaIO3+3H2O
酸性条件:5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+3H2O
以下是反萃取过程的操作,请按要求填空:
①向装有I2的CCl4溶液的
②振荡至溶液的
③将含碘的碱溶液从仪器的
④边搅拌边加入几滴1 mol‧L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是
您最近一年使用:0次



