碳酸钴(CoCO3)是一种红色粉末,常用作催化剂、选矿剂和家装涂料的颜料。以含钴废渣(主要成分为CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
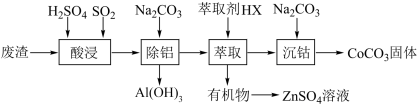
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol· L-1计算)。
回答下列问题:
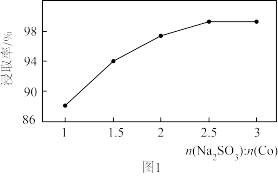
(1)“酸浸”时通入SO2的目的是_________ ,反应的离子方程式为________________ 。此处的SO2也可以用Na2SO3代替,Na2SO3用量和钴的浸取率之间的关系如图1所示,则较为适宜的条件为__________ 。
(2)除铝时,应控制溶液的pH范围为_______ ,除铝的离子方程式为_____________ 。
(3)“萃取”过程可表示为ZnSO4 (水层) +2HX(有机层) ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是_______________ 。
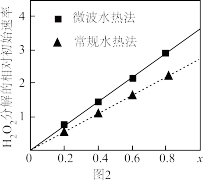
(4)用得到的CoCO3等为原料,采用微波水热法和常规水热法发可以制得两种CoxNi(1-x) Fe2O4,(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。图2是两种不同方法制得的CoxNi(1-x) Fe2O4在10° C时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:_______________ 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是_________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料中得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中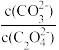 =
=______ (保留两位有效数字)。[已知:Ksp(CoC2O4)=6.3×10-8,Ksp(CoCO3)=1.4×10-13]

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol· L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是

(2)除铝时,应控制溶液的pH范围为
(3)“萃取”过程可表示为ZnSO4 (水层) +2HX(有机层)
 ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是(4)用得到的CoCO3等为原料,采用微波水热法和常规水热法发可以制得两种CoxNi(1-x) Fe2O4,(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。图2是两种不同方法制得的CoxNi(1-x) Fe2O4在10° C时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:

(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料中得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中
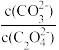 =
=
更新时间:2022-06-17 13:51:43
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】中医药典记载木耳具有“和血养营”功效。某实验小组称取一定量黑木耳以检验黑木耳中含有铁元素、并测定铁元素含量。实验过程如下:

Ⅰ.定性检验
(1)“灼烧”中用于盛装黑木耳的仪器是________ 。
(2)甲同学往“酸浸”所得溶液中加入高锰酸钾,发现溶液的紫红色褪去,因此得出“此酸浸溶液中含 ”的结论。乙同学不赞同甲同学的观点,乙同学的理由是
”的结论。乙同学不赞同甲同学的观点,乙同学的理由是________ 。
Ⅱ.定量分析1——高锰酸钾滴定法
(3)取一定量待测液,利用盐酸羟胺(在溶液中可完全电离出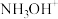 与
与 )将溶液中
)将溶液中 还原为
还原为 ,同时产生一种无污染的气体,该反应的离子方程式为
,同时产生一种无污染的气体,该反应的离子方程式为________ ;再利用酸性高锰酸钾溶液氧化 ,根据消耗的高锰酸钾溶液的体积以计算铁元素含量。
,根据消耗的高锰酸钾溶液的体积以计算铁元素含量。
(4)配制一定物质的量浓度的高锰酸钾溶液时,下列操作会使铁元素含量测量值偏高的是________。
Ⅲ.定量分析2——吸光度法
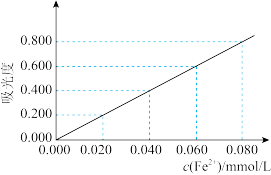
(5)取10mL待测液,利用吸光度法测得其吸光度为0.600(吸光度与 的浓度关系如下图所示)。
的浓度关系如下图所示)。
该黑木耳中铁元素的含量(溶液密度为 )=
)=________ (mg/100g)。

Ⅰ.定性检验
(1)“灼烧”中用于盛装黑木耳的仪器是
(2)甲同学往“酸浸”所得溶液中加入高锰酸钾,发现溶液的紫红色褪去,因此得出“此酸浸溶液中含
 ”的结论。乙同学不赞同甲同学的观点,乙同学的理由是
”的结论。乙同学不赞同甲同学的观点,乙同学的理由是Ⅱ.定量分析1——高锰酸钾滴定法
(3)取一定量待测液,利用盐酸羟胺(在溶液中可完全电离出
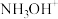 与
与 )将溶液中
)将溶液中 还原为
还原为 ,同时产生一种无污染的气体,该反应的离子方程式为
,同时产生一种无污染的气体,该反应的离子方程式为 ,根据消耗的高锰酸钾溶液的体积以计算铁元素含量。
,根据消耗的高锰酸钾溶液的体积以计算铁元素含量。(4)配制一定物质的量浓度的高锰酸钾溶液时,下列操作会使铁元素含量测量值偏高的是________。
| A.没有进行洗涤操作 |
| B.定容时俯视容量瓶的刻度线 |
| C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
| D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
Ⅲ.定量分析2——吸光度法
(5)取10mL待测液,利用吸光度法测得其吸光度为0.600(吸光度与
 的浓度关系如下图所示)。
的浓度关系如下图所示)。该黑木耳中铁元素的含量(溶液密度为
 )=
)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】经检测某工厂的酸性废水中所含离子及其浓度如表所示:
(1)
_______ 。
(2)为了减少污染并变废为宝,工程师们设计了以下流程,回收铜和绿矾( )。
)。
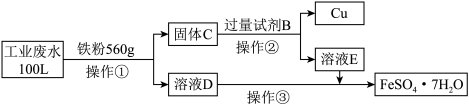
①请写出操作①中铁粉与 发生反应的离子方程式
发生反应的离子方程式_______ ;
②试剂B的化学式是_______
③上述100L废水经处理理论上可获得 的物质的量是
的物质的量是_______ mol;
④由制得的绿矾晶体配制 溶液时,实验操作中除要用到玻璃棒、托盘天平、药匙、量筒、烧杯外,还必须用到的两种玻璃仪器是
溶液时,实验操作中除要用到玻璃棒、托盘天平、药匙、量筒、烧杯外,还必须用到的两种玻璃仪器是_______ ,需称量绿矾晶体_______ g,在配制溶液过程中按以下实验操作,会导致所配溶液浓度偏高的是_______
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
c.转移溶液前容量瓶内有少量蒸馏水
d.定容后摇匀,发现液面降低,未补加蒸馏水
e.定容时,俯视刻度线
| 离子 |  |  |  |  |  |
| 浓度/(mol/L) | 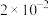 | 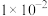 | 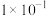 | 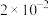 |

(2)为了减少污染并变废为宝,工程师们设计了以下流程,回收铜和绿矾(
 )。
)。
①请写出操作①中铁粉与
 发生反应的离子方程式
发生反应的离子方程式②试剂B的化学式是
③上述100L废水经处理理论上可获得
 的物质的量是
的物质的量是④由制得的绿矾晶体配制
 溶液时,实验操作中除要用到玻璃棒、托盘天平、药匙、量筒、烧杯外,还必须用到的两种玻璃仪器是
溶液时,实验操作中除要用到玻璃棒、托盘天平、药匙、量筒、烧杯外,还必须用到的两种玻璃仪器是a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
c.转移溶液前容量瓶内有少量蒸馏水
d.定容后摇匀,发现液面降低,未补加蒸馏水
e.定容时,俯视刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氮化锶( )在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。
)在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。 通过
通过___________ 法制得。Sr的单质与氧气加热反应时能生成过氧化锶,过氧化锶的电子式为___________ 。
(2)用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气,其反应的离子方程式是___________ ,该反应中每生成标准状况下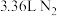 ,转移电子的物质的量为
,转移电子的物质的量为___________ 。
(3)装置C中装有___________ ,实验时,先点燃酒精灯___________ (填“A”或“B”),原因是___________
(4)氮化锶要干燥保存,遇水会剧烈反应,有氨气产生,该反应的化学方程式为___________ 。
 )在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。
)在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。
 通过
通过(2)用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气,其反应的离子方程式是
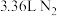 ,转移电子的物质的量为
,转移电子的物质的量为(3)装置C中装有
(4)氮化锶要干燥保存,遇水会剧烈反应,有氨气产生,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有 、
、 、
、 以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
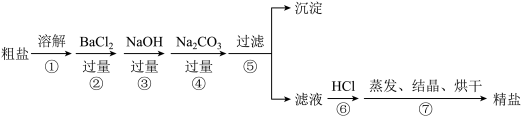
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________ 。
(2)第②步操作的目的是除去粗盐中的___________ (填化学式,下同),第⑥步操作的目的是除去滤液中___________ 、___________ 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、 、
、 、
、___________ 、___________ (填化学式)。
(4)第④步的离子方程式为___________ 、___________ 。
 、
、 、
、 以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、
 、
、 、
、(4)第④步的离子方程式为
您最近一年使用:0次
【推荐2】 是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:

回答下列问题:
(1) 中
中 的化合价为
的化合价为_______ 。
(2)写出“反应”步骤中生成 气体的化学方程式
气体的化学方程式_______ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的 和
和 ,需加入的试剂分别为:
,需加入的试剂分别为:_______ 、_______ (填化学式);“电解”中氧化产物主要是_______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 。此过程中发生反应的化学方程式为:
。此过程中发生反应的化学方程式为: (未配平),其中还原剂与氧化剂的物质的量之比为
(未配平),其中还原剂与氧化剂的物质的量之比为_______ 。
 是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:
回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)写出“反应”步骤中生成
 气体的化学方程式
气体的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的
 和
和 ,需加入的试剂分别为:
,需加入的试剂分别为:(4)“尾气吸收”是吸收“电解”过程排出的少量
 。此过程中发生反应的化学方程式为:
。此过程中发生反应的化学方程式为: (未配平),其中还原剂与氧化剂的物质的量之比为
(未配平),其中还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、 饱和K2CO3溶液 、NaOH溶液、 KOH溶液、 BaCl2溶液 、Ba(NO3)2溶液
(1)欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的各种试剂,按滴加顺序依次为____________ (填化学式);
(2)蒸发浓缩溶液Ⅱ得到的糊状物的化学成分最多的是_________ (填化学式);
(3)用提纯过的NaCl固体来配制480 mL 0.4 mol·L-1NaCl溶液时,所用仪器除烧杯、药匙、玻璃棒、天平、胶头滴管外还有___________ (填仪器名称);需NaCl________ g。
(4)电解饱和食盐水的装置如图所示:
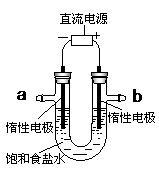
若收集到的H2为2 L,则同样条件下收集到的Cl2体积__ (填“>”、“=”或“<”)2 L,其原因是:_________ (文字描述);若将此装置的b口密封住,则电解一段时间后,U型管中可以获得一种消毒液,写出获得此消毒液的一个总反应方程式:______________ 。

提供的试剂:饱和Na2CO3溶液、 饱和K2CO3溶液 、NaOH溶液、 KOH溶液、 BaCl2溶液 、Ba(NO3)2溶液
(1)欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的各种试剂,按滴加顺序依次为
(2)蒸发浓缩溶液Ⅱ得到的糊状物的化学成分最多的是
(3)用提纯过的NaCl固体来配制480 mL 0.4 mol·L-1NaCl溶液时,所用仪器除烧杯、药匙、玻璃棒、天平、胶头滴管外还有
(4)电解饱和食盐水的装置如图所示:

若收集到的H2为2 L,则同样条件下收集到的Cl2体积
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮的化合物在生产实践及科学研究中应用广泛
(1)目前工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
2NH3(1)+H2O(1)+CO2(g)⇌(NH4)2CO3(aq)K1
NH3(l)+H2O(1)+CO2(g)⇌NH4HCO3(aq)K2
(NH4)2CO3(aq)+H2O(1)+CO2(g)⇌2NH4HCO3(aq)K3
则K3=___ (用含K1、K2的代数式表示)。
(2)利用CO2制备乙烯是我国能源领域的一个重要战略方向,具体如下:CO2催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g);ΔH=akJ·mol-1。起始时按n(CO2):n(H2)=1:3的投料比充入20L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a___ 0(选填“>”或“<”)。
②下列说法正确的是___ (填字母序号)。
A.使用催化剂,可降低反应活化能,加快反应速率
B.其它条件不变时,若扩大容器容积,则v正减小,v逆增大
C.测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,则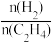 将
将___ (填“变大”、“不变”或“变小”)。
(3)N2H4为二元弱碱,在水中的电离方程式与氨相似,常温下,向10mL0.1mol/L的联氨溶液中,滴加0.1mol/L的HCl溶液xmL溶液中N2H4、N2H 、N2H
、N2H 的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示。
的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示。
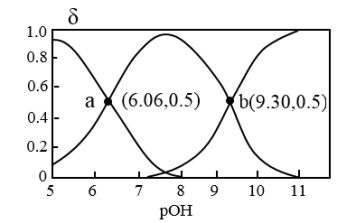
①25℃时,写出N2H4在水中第一步电离方程式___ 。
②25℃时,N2H4在水中的第二步电离常数值为___ 。
③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:___ 。

(1)目前工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
2NH3(1)+H2O(1)+CO2(g)⇌(NH4)2CO3(aq)K1
NH3(l)+H2O(1)+CO2(g)⇌NH4HCO3(aq)K2
(NH4)2CO3(aq)+H2O(1)+CO2(g)⇌2NH4HCO3(aq)K3
则K3=
(2)利用CO2制备乙烯是我国能源领域的一个重要战略方向,具体如下:CO2催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g);ΔH=akJ·mol-1。起始时按n(CO2):n(H2)=1:3的投料比充入20L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a
②下列说法正确的是
A.使用催化剂,可降低反应活化能,加快反应速率
B.其它条件不变时,若扩大容器容积,则v正减小,v逆增大
C.测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,则
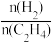 将
将(3)N2H4为二元弱碱,在水中的电离方程式与氨相似,常温下,向10mL0.1mol/L的联氨溶液中,滴加0.1mol/L的HCl溶液xmL溶液中N2H4、N2H
 、N2H
、N2H 的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示。
的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示。
①25℃时,写出N2H4在水中第一步电离方程式
②25℃时,N2H4在水中的第二步电离常数值为
③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】铁及其化合物在催化、生产中具有重要作用。
(1)以 和
和 为原料,熔融
为原料,熔融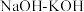 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在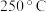 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。
①基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:___________ 和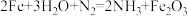 。
。
(2)在 催化作用下,合成氨反应
催化作用下,合成氨反应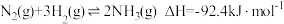 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):
化学吸附: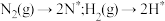 ;
;
表面反应: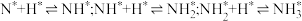 ;
;
脱附:
其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
实际生产中,常用工艺条件, 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强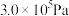 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为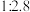 。
。
①分析说明原料气中 过量的理由
过量的理由___________ 。
②关于合成氨工艺的下列理解,正确的是___________ 。
A.控制温度( )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
B.当温度、压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(3)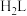 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其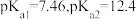 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中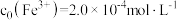 ,
,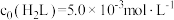 。体系中含
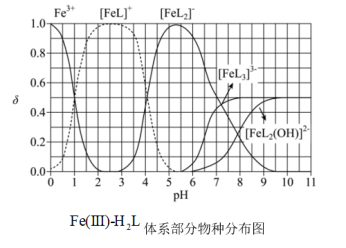
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数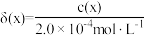 。
。 时,
时,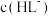
___________ 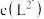 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②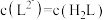 时,
时,
___________ ;
③当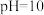 时,参与配位的
时,参与配位的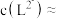
___________  (写出计算过程)。
(写出计算过程)。
(1)以
 和
和 为原料,熔融
为原料,熔融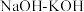 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在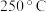 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。①基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:
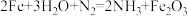 。
。(2)在
 催化作用下,合成氨反应
催化作用下,合成氨反应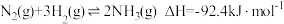 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):化学吸附:
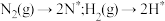 ;
;表面反应:
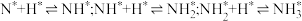 ;
;脱附:

其中,
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,常用工艺条件,
 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强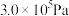 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为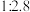 。
。①分析说明原料气中
 过量的理由
过量的理由②关于合成氨工艺的下列理解,正确的是
A.控制温度(
 )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率B.当温度、压强一定时,在原料气(
 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率C.基于
 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行D.分离空气可得
 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。(3)
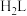 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其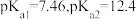 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中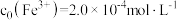 ,
,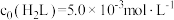 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数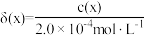 。
。
 时,
时,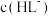
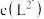 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
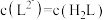 时,
时,
③当
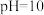 时,参与配位的
时,参与配位的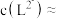
 (写出计算过程)。
(写出计算过程)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________ 。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________ 。
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________ 。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
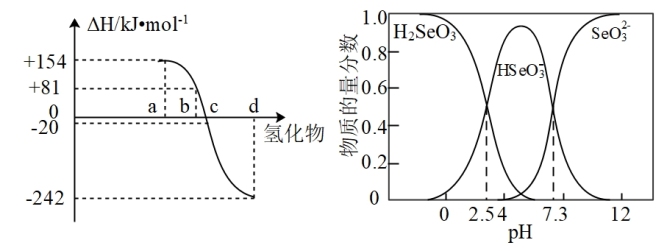
①向亚硒酸溶液滴入NaOH溶液至pH=5,该过程中主要反应的离子方程式________ 。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______ 。
③下列说法正确的是____ (填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO )+2c(SeO
)+2c(SeO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO )>c(HSeO
)>c(HSeO )>c(H2SeO3)
)>c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________ 。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。

①向亚硒酸溶液滴入NaOH溶液至pH=5,该过程中主要反应的离子方程式
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是
③下列说法正确的是
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO
 )+2c(SeO
)+2c(SeO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)c.在Na2SeO3溶液中,c(SeO
 )>c(HSeO
)>c(HSeO )>c(H2SeO3)
)>c(H2SeO3)④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=
您最近一年使用:0次




