焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。
(1)已知Na2S2O5中O元素的化合价为-2,则S元素的化合价为_______ 。Na2S2O5在酸性条件下会放出SO2,其反应的离子方程式为_______ 。
(2)Na2S2O5是一种食品添加剂、Na2S2O5晶体中常含有 。
。
①Na2S2O5作脱氧剂时的反应原理为 ,用单线桥法标出该反应中电子转移的数目和方向:
,用单线桥法标出该反应中电子转移的数目和方向:_______ 。
②检验其中含有 的方法是
的方法是_______ 。
(3)葡萄酒中常加入Na2S2O5作抗氧化剂。测定某葡萄酒中Na2S2O5残留量的实验方法如下:取20.00mL葡萄酒样品,慢慢滴加5.00mL0.010mol/LI2标准液恰好反应(以淀粉溶液作指示剂)。已知实验过程中发生的反应为 。计算该葡萄酒中Na2S2O5的残留量为
。计算该葡萄酒中Na2S2O5的残留量为_______ mol/L。
(1)已知Na2S2O5中O元素的化合价为-2,则S元素的化合价为
(2)Na2S2O5是一种食品添加剂、Na2S2O5晶体中常含有
 。
。①Na2S2O5作脱氧剂时的反应原理为
 ,用单线桥法标出该反应中电子转移的数目和方向:
,用单线桥法标出该反应中电子转移的数目和方向:②检验其中含有
 的方法是
的方法是(3)葡萄酒中常加入Na2S2O5作抗氧化剂。测定某葡萄酒中Na2S2O5残留量的实验方法如下:取20.00mL葡萄酒样品,慢慢滴加5.00mL0.010mol/LI2标准液恰好反应(以淀粉溶液作指示剂)。已知实验过程中发生的反应为
 。计算该葡萄酒中Na2S2O5的残留量为
。计算该葡萄酒中Na2S2O5的残留量为
更新时间:2022-07-06 11:19:37
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】过二硫酸盐[例:(NH4)2S2O8、Na2S2O8]都具有强氧化性,可作为氧化剂和漂白剂,(NH4)2S2O8被广泛用于蓄电池工业,在照相工业上用来除去海波。
I.(NH4)2S2O8的制备原理为H2O2+2H2SO4+2NH3=(NH4)2S2O8+2H2O。实验室模拟制备(NH4)2S2O8的装置如图所示。
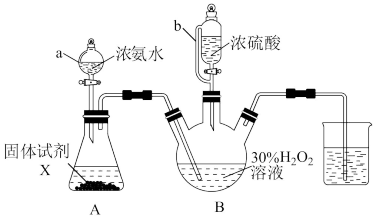
(1)仪器a的名称是________ 。
(2)充分反应后,将B中混合液经一系列操作得到晶体,用无水乙醚洗涤,目的是______ 。
(3)烘干产品时,用红外灯低温供干,可能的原因是_______ 。
II.(NH4)2S2O8的性质及应用。
(4)过二硫酸(H2S2O8)是一种强氧化性酸,在Ag+催化作用下, 能与Mn2+在水溶液中发生反应生成
能与Mn2+在水溶液中发生反应生成 和
和 ,1mol
,1mol 能氧化的Mn2+的物质的量为
能氧化的Mn2+的物质的量为_____ mol。过二硫酸铵可用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为 ),写出该反应的离子方程式
),写出该反应的离子方程式______ 。
III.标定(NH4)2S2O8溶液的浓度。
(5)称取一定质量的(NH4)2S2O8,配制成溶液,并用碘量法标定该溶液的浓度,移取20.00mL(NH4)2S2O8溶液于锥形瓶中,加入过量的KI,然后加入几滴淀粉溶液,再用0.1mol·L-1的Na2S2O3溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为
。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为______ ,所标定的(NH4)2S2O8的浓度为________ mol∙L-1。
I.(NH4)2S2O8的制备原理为H2O2+2H2SO4+2NH3=(NH4)2S2O8+2H2O。实验室模拟制备(NH4)2S2O8的装置如图所示。

(1)仪器a的名称是
(2)充分反应后,将B中混合液经一系列操作得到晶体,用无水乙醚洗涤,目的是
(3)烘干产品时,用红外灯低温供干,可能的原因是
II.(NH4)2S2O8的性质及应用。
(4)过二硫酸(H2S2O8)是一种强氧化性酸,在Ag+催化作用下,
 能与Mn2+在水溶液中发生反应生成
能与Mn2+在水溶液中发生反应生成 和
和 ,1mol
,1mol 能氧化的Mn2+的物质的量为
能氧化的Mn2+的物质的量为 ),写出该反应的离子方程式
),写出该反应的离子方程式III.标定(NH4)2S2O8溶液的浓度。
(5)称取一定质量的(NH4)2S2O8,配制成溶液,并用碘量法标定该溶液的浓度,移取20.00mL(NH4)2S2O8溶液于锥形瓶中,加入过量的KI,然后加入几滴淀粉溶液,再用0.1mol·L-1的Na2S2O3溶液滴定,发生反应:I2+2
 =2I-+
=2I-+ 。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为
。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)4.5 g H2O与_______ g H2SO4所含的分子数相等,它们所含氧原子数之比是 _______ 。
(2)8.4 g N2与9.6 g某单质Rx所含原子数相同,且分子数之比为3:2,则R的相对原子质量是_______ ,x值是_______ 。
(3)NO和O2发生反应:2NO+O2=2NO2,现有amol NO和bmol O2充分反应后氮原子与氧原子的个数比为_______ 。
(4)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_______ 。
(5)现用Zn与实验室中的盐酸反应制取6.72 L H2(标准状况)。
①如果选用所贴标签为3.0mol·L-1的盐酸,至少需该盐酸多少毫升_______ ?
②该盐酸密度为1.052g·mL-1,则该盐酸溶质的质量分数是多少_______ ? (保留三位有效数字)
(1)4.5 g H2O与
(2)8.4 g N2与9.6 g某单质Rx所含原子数相同,且分子数之比为3:2,则R的相对原子质量是
(3)NO和O2发生反应:2NO+O2=2NO2,现有amol NO和bmol O2充分反应后氮原子与氧原子的个数比为
(4)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为
(5)现用Zn与实验室中的盐酸反应制取6.72 L H2(标准状况)。
①如果选用所贴标签为3.0mol·L-1的盐酸,至少需该盐酸多少毫升
②该盐酸密度为1.052g·mL-1,则该盐酸溶质的质量分数是多少
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有下列9种物质:①铝 ②纯醋酸 ③CO2④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦稀盐酸 ⑧NaHSO4⑨碳酸钙 ⑩乙醇
(1)上述物质中能导电的是___________ 属于电解质的有___________ (填序号)。
(2)向⑥中逐渐滴加④的溶液,看到的现象是___________ 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为: ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(4)⑧在水中的电离方程式为___________ 。
(5)⑨和⑦混合反应离子方程式为___________ 。
(6)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率( )随新物质加入体积(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是
)随新物质加入体积(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是___________ (填序号)。

①向氨水中通入HCl气体至恰好完全反应
②向饱和石灰水中不断通入
③向硝酸溶液中逐滴加入等浓度的氢氧化钾溶液至恰好完全反应
(1)上述物质中能导电的是
(2)向⑥中逐渐滴加④的溶液,看到的现象是
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:
 ,则该反应的化学方程式为
,则该反应的化学方程式为(4)⑧在水中的电离方程式为
(5)⑨和⑦混合反应离子方程式为
(6)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(
 )随新物质加入体积(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是
)随新物质加入体积(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是
①向氨水中通入HCl气体至恰好完全反应
②向饱和石灰水中不断通入

③向硝酸溶液中逐滴加入等浓度的氢氧化钾溶液至恰好完全反应
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有下列六种物质:
①稀盐酸 ②小苏打 ③NH3 ④NaOH溶液 ⑤熔融KHSO4 ⑥红褐色的氢氧化铁胶体
(1)上述六种物质中,属于非电解质的有_____ (填序号,下同)。
(2)①~⑤物质,在上述状态下可导电的物质是______ 。
(3)请写出实验室制备⑥物质的化学 方程式___________ 。
(4)胃液中含有①,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的②,能治疗胃酸过多,请写出其反应的离子 方程式______ 。
(5)往⑥中,逐滴加入①直至过量,整个过程中观察到的现象是_______________ 。
(6)将冷却后的⑤加到④的溶液中,④的溶液导电能力变化为_____ (填“增强”“减弱”或“基本不变”)。
①稀盐酸 ②小苏打 ③NH3 ④NaOH溶液 ⑤熔融KHSO4 ⑥红褐色的氢氧化铁胶体
(1)上述六种物质中,属于非电解质的有
(2)①~⑤物质,在上述状态下可导电的物质是
(3)请写出实验室制备⑥物质的
(4)胃液中含有①,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的②,能治疗胃酸过多,请写出其反应的
(5)往⑥中,逐滴加入①直至过量,整个过程中观察到的现象是
(6)将冷却后的⑤加到④的溶液中,④的溶液导电能力变化为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I、下表是生活生产中常见的物质.表中列出了它们的一种主要成分(其中加碘盐是氯化钠中添加适量的 ,其他成分未列出)
,其他成分未列出)
(1)请你对表中①~⑦的主要成分进行分类,既不是电解质又不是非电解质的是___________ (填序号)。
(2)写出④在水中的电离方程式______________________ 。
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的离子方程式:______________________ 。
(4)已知①中 和
和 的混合气体
的混合气体 共
共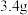 ,则①中
,则①中 的质量为
的质量为___________ g。
II.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为 。
。
(5)该反应中还原产物为___________ ,每生成 (标准状况下)的
(标准状况下)的 转移的电子个数为
转移的电子个数为___________ .
(6)请用双线桥标出电子转移方向和数目的情况______________________ 。
 ,其他成分未列出)
,其他成分未列出)名称 | 水煤气 | 葡萄糖 | 醋酸 | 小苏打 | 生石灰 | 铁丝 | 加碘盐 |
主要成分 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
(2)写出④在水中的电离方程式
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的离子方程式:
(4)已知①中
 和
和 的混合气体
的混合气体 共
共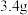 ,则①中
,则①中 的质量为
的质量为II.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为
 。
。(5)该反应中还原产物为
 (标准状况下)的
(标准状况下)的 转移的电子个数为
转移的电子个数为(6)请用双线桥标出电子转移方向和数目的情况
您最近一年使用:0次
【推荐1】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)在催化剂作用下,NH3可与NO2发生如下反应:NH3+NO2-N2+H2O(未配平)
①该反应的还原剂是____ 。
②配平反应方程式并用单线桥表示该反应中电子转移的方向和数目:____ 。
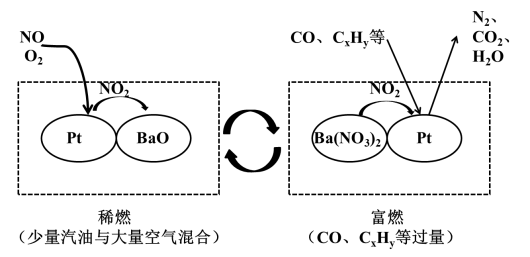
③汽车发动机稀燃和富燃系统条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理如图所示,请写出富燃条件下,NO2被CO还原的反应____ 。
(2)水体中含有较多的硝酸盐会污染水质。一种用铁粉处理水体中的硝酸盐的反应:Fe+ +H+-Fe2++
+H+-Fe2++ +H2O(未配平)
+H2O(未配平)
①配平后的反应中H+前的化学计量数为____ 。
②由反应可知酸性条件下粒子的氧化性大小:____ >____ 。
(1)在催化剂作用下,NH3可与NO2发生如下反应:NH3+NO2-N2+H2O(未配平)
①该反应的还原剂是
②配平反应方程式并用单线桥表示该反应中电子转移的方向和数目:
③汽车发动机稀燃和富燃系统条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理如图所示,请写出富燃条件下,NO2被CO还原的反应

(2)水体中含有较多的硝酸盐会污染水质。一种用铁粉处理水体中的硝酸盐的反应:Fe+
 +H+-Fe2++
+H+-Fe2++ +H2O(未配平)
+H2O(未配平)①配平后的反应中H+前的化学计量数为
②由反应可知酸性条件下粒子的氧化性大小:
您最近一年使用:0次
【推荐2】Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
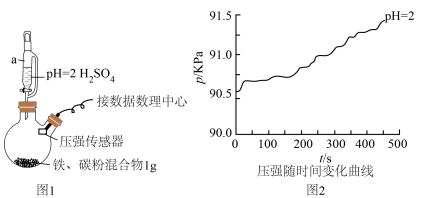
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
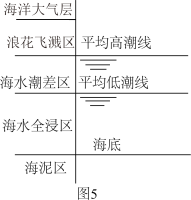
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。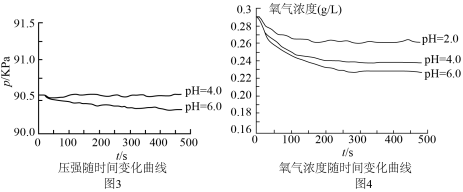
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应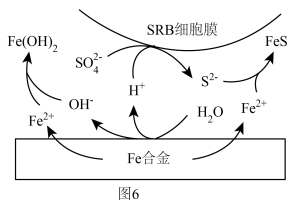
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如下图所示,由图中数据分析可得:
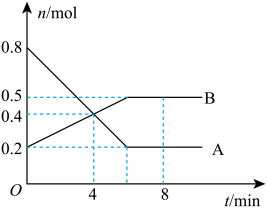
(1)该反应的化学方程式为___________ 。
(2)第4min时,正、逆反应速率的大小关系为v正___________ (填“>” “<”或“=”)v逆
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为___________ mol ·L-1·min-1。
(4)平衡时混合气体中B的体积分数为___________ 。
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(5)写出上述反应的离子方程式___________ 。
(6)若实验探究温度对该反应速率的影响,则a=___________ 采用比较实验的序号是___________ (填实验序号)

(1)该反应的化学方程式为
(2)第4min时,正、逆反应速率的大小关系为v正
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为
(4)平衡时混合气体中B的体积分数为
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
| 实验序号 | 反应温度(°C) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | a |
| C | 25 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
(6)若实验探究温度对该反应速率的影响,则a=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为_____ ,B在周期表中的位置____ 。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146g·mol-1,该物质的化学式为___ 。已知DBn 在温度高于45度时为气态。DBn属于____ 晶体。
(3)C与氢元素组成1:1的化合物,与水发生剧烈反应生成一种气体,写出该反应化学反应方程式_______ 。
(4)D元素的+4价含氧酸钠盐,该钠盐在空气中容易变质,设计实验方案证明该盐已经变质____ 。
(1)A元素气态氢化物的电子式为
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146g·mol-1,该物质的化学式为
(3)C与氢元素组成1:1的化合物,与水发生剧烈反应生成一种气体,写出该反应化学反应方程式
(4)D元素的+4价含氧酸钠盐,该钠盐在空气中容易变质,设计实验方案证明该盐已经变质
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】“绿水青山,就是金山银山”,工业排放的废水要检测合格才能排放,某化工生产基地排放的废水中可能含有以下离子中的若干种:K+、 、Mg2+、Cu2+、Cl-、
、Mg2+、Cu2+、Cl-、 、
、 ,相关专业人士现各取100mL无色溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生;②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);③向第三份加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余2.33g。
,相关专业人士现各取100mL无色溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生;②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);③向第三份加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余2.33g。
试回答下列问题:
(1)该溶液中肯定不存在的离子有___ 。
(2)可能存在的离子是___ ,判断该离子存在与否的实验操作方法是___ 。
(3)若存在K+,则c(K+)至少为___ mol·L-1,说明理由___ 。(若不存在K+此空可以不填)
 、Mg2+、Cu2+、Cl-、
、Mg2+、Cu2+、Cl-、 、
、 ,相关专业人士现各取100mL无色溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生;②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);③向第三份加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余2.33g。
,相关专业人士现各取100mL无色溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生;②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);③向第三份加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余2.33g。试回答下列问题:
(1)该溶液中肯定不存在的离子有
(2)可能存在的离子是
(3)若存在K+,则c(K+)至少为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】石膏转化为硫酸钾和CaCl2的工艺流程如图:

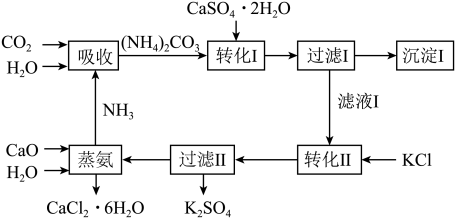
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___ (用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___ ,检验滤液中含有CO32-的方法__ 。
(3)转化Ⅱ中发生反应的化学方程式为___ ,转化Ⅱ中可获得K2SO4的原因是__ 。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___ 。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___ ,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___ mol。


(1)CO2是一种很重要的副产品,工业上获得CO2的途径是
(2)过滤Ⅰ得到的滤液是
(3)转化Ⅱ中发生反应的化学方程式为
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式
您最近一年使用:0次

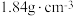 ,则该浓硫酸中
,则该浓硫酸中 的物质的量浓度是
的物质的量浓度是




 和
和

