二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳的排放。
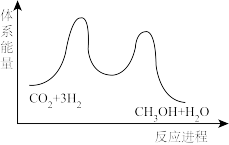
(1)二氧化碳加氢制甲醇的总反应为 ,能量变化如图所示,该反应为
,能量变化如图所示,该反应为_______ (“放热”或“吸热”)反应。
(2)在恒温恒容条件下进行二氧化碳加氢制甲醇反应。起始时,向反应容器中充入 和
和 ,反应达到平衡时生成
,反应达到平衡时生成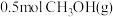 。
。
①下列能够说明总反应已达到化学平衡状态的是_______ (填标号)。
A.气体的平均相对分子质量保持不变 B.容器内总压强不再改变
C. 的比值保持不变 D.
的比值保持不变 D. 的体积分数不再改变
的体积分数不再改变
②达到平衡时, 的转化率是
的转化率是_______ ,容器内起始压强与平衡压强之比是_______ 。
(3)一定条件下,将 与
与 以体积比1∶2置于密闭容器中发生上述反应,测定甲醇时空收率随温度的变化曲线如图所示,已知:甲醇时空收率表示在1mol催化剂表面,生成甲醇的平均速率。
以体积比1∶2置于密闭容器中发生上述反应,测定甲醇时空收率随温度的变化曲线如图所示,已知:甲醇时空收率表示在1mol催化剂表面,生成甲醇的平均速率。
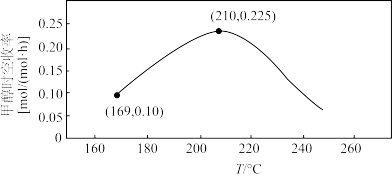
①使用1mol活性镓镍催化剂时,若反应温度由169℃升高到210℃,生成甲醇的平均速率之比
_______ 。
②温度高于210℃时,甲醇时空收率降低的原因可能是_______ 。
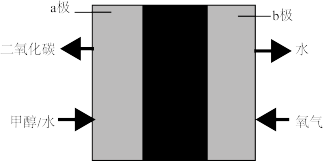
(4)直接甲醇燃料电池工作原理如图所示。a极是电池的_______ (“正极”或“负极”),b极电极反应式为_______ 。
(1)二氧化碳加氢制甲醇的总反应为
 ,能量变化如图所示,该反应为
,能量变化如图所示,该反应为
(2)在恒温恒容条件下进行二氧化碳加氢制甲醇反应。起始时,向反应容器中充入
 和
和 ,反应达到平衡时生成
,反应达到平衡时生成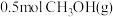 。
。①下列能够说明总反应已达到化学平衡状态的是
A.气体的平均相对分子质量保持不变 B.容器内总压强不再改变
C.
 的比值保持不变 D.
的比值保持不变 D. 的体积分数不再改变
的体积分数不再改变②达到平衡时,
 的转化率是
的转化率是(3)一定条件下,将
 与
与 以体积比1∶2置于密闭容器中发生上述反应,测定甲醇时空收率随温度的变化曲线如图所示,已知:甲醇时空收率表示在1mol催化剂表面,生成甲醇的平均速率。
以体积比1∶2置于密闭容器中发生上述反应,测定甲醇时空收率随温度的变化曲线如图所示,已知:甲醇时空收率表示在1mol催化剂表面,生成甲醇的平均速率。
①使用1mol活性镓镍催化剂时,若反应温度由169℃升高到210℃,生成甲醇的平均速率之比

②温度高于210℃时,甲醇时空收率降低的原因可能是
(4)直接甲醇燃料电池工作原理如图所示。a极是电池的

更新时间:2022-08-01 17:49:36
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:

反应前
①I试管发生的离子方程式:_______________________ ;
②两支试管中 充分反应后生成的气体总量Ⅰ_____ Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____ Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________ (吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________ (吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________ 。
A.18.5℃ B. 24.2℃ C.16.2℃

反应前
①I试管发生的离子方程式:
②两支
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| 1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| 2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
| 3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
| 4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
| 5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
| 6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
①Na2CO3的饱和溶液和盐酸的反应是
②NaHCO3的饱和溶液和盐酸的反应是
③表中⑤号试验混合后温度T℃可能是(填编号)
A.18.5℃ B. 24.2℃ C.16.2℃
您最近一年使用:0次
【推荐2】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
则2H2(g)+O2(g)=2H2O(g)ΔH=___________ kJ·mol-1
②通过物质所含能量计算。已知反应A+B=C+D中A、B、C、D所具有的能量依次可表示为EA、EB、EC、ED,该反应ΔH=___________ 。
③通过盖斯定律计算。已知在25℃、101kPa时,2Na(s)+ O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1的盐酸,则还需加入___________ (填字母)。
A.50mL0.50mol·L-1NaOH溶液B.50mL0.55mol·L-1NaOH溶液C.1.0gNaOH固体
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.Na2O与水反应 |
| B.铝和氧化铁反应 |
| C.CaCO3受热分解 |
| D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键 | H—H | O=O | O—H |
| 键能(kJ·mol-1) | 436 | 496 | 463.4 |
②通过物质所含能量计算。已知反应A+B=C+D中A、B、C、D所具有的能量依次可表示为EA、EB、EC、ED,该反应ΔH=
③通过盖斯定律计算。已知在25℃、101kPa时,2Na(s)+
 O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1写出Na2O2与Na反应生成Na2O的热化学方程式:
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1的盐酸,则还需加入
A.50mL0.50mol·L-1NaOH溶液B.50mL0.55mol·L-1NaOH溶液C.1.0gNaOH固体
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫酰氯( )是化工生产的重要原料,实验室合成
)是化工生产的重要原料,实验室合成 的原理为
的原理为 ,该反应会放出大量的热。已知:
,该反应会放出大量的热。已知: 的熔点为-54.1℃,沸点为69.1℃,能与水发生剧烈反应,产生白雾以及有刺激性气味的气体。其实验装置如图所示(部分夹持仪器已省略):
的熔点为-54.1℃,沸点为69.1℃,能与水发生剧烈反应,产生白雾以及有刺激性气味的气体。其实验装置如图所示(部分夹持仪器已省略):
(1)从下列装置(A或B)___________ 中选择制备 的装置甲并写出反应的化学方程式:
的装置甲并写出反应的化学方程式:___________ 。___________ ,其作用是___________ 。
(3)画出装置丙中的能量变化图:___________ 。___________ 。
(5)实验结束后,装置戊还能储存一定量的 ,此时若关闭分液漏斗的活塞和止水夹k,装置戊中的现象为
,此时若关闭分液漏斗的活塞和止水夹k,装置戊中的现象为___________ 。
(6)实验开始时,向装置甲中加入ag亚硫酸钠,假设亚硫酸钠在硫酸的作用下完全反应,若实验结束后得到硫酰氯bmol(氯气足量),则硫酰氯的产率为___________ (列出表达式即可)。
 )是化工生产的重要原料,实验室合成
)是化工生产的重要原料,实验室合成 的原理为
的原理为 ,该反应会放出大量的热。已知:
,该反应会放出大量的热。已知: 的熔点为-54.1℃,沸点为69.1℃,能与水发生剧烈反应,产生白雾以及有刺激性气味的气体。其实验装置如图所示(部分夹持仪器已省略):
的熔点为-54.1℃,沸点为69.1℃,能与水发生剧烈反应,产生白雾以及有刺激性气味的气体。其实验装置如图所示(部分夹持仪器已省略):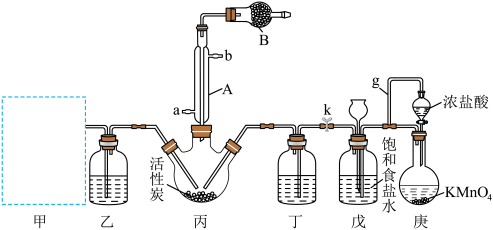
(1)从下列装置(A或B)
 的装置甲并写出反应的化学方程式:
的装置甲并写出反应的化学方程式: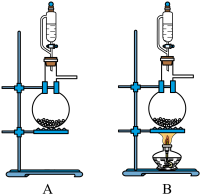
(3)画出装置丙中的能量变化图:

(5)实验结束后,装置戊还能储存一定量的
 ,此时若关闭分液漏斗的活塞和止水夹k,装置戊中的现象为
,此时若关闭分液漏斗的活塞和止水夹k,装置戊中的现象为(6)实验开始时,向装置甲中加入ag亚硫酸钠,假设亚硫酸钠在硫酸的作用下完全反应,若实验结束后得到硫酰氯bmol(氯气足量),则硫酰氯的产率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量___________ (填“大于”、“小于”或“等于”生成物的化学键形成要放出的能量。
(2)下列可以说明该反应达到平衡的是___________。
(3)在温度为T的条件下,向该恒容密闭容器中充入0.04
 ,
,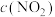 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。

①在图中画出0~16min时间段内,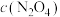 随时间的变化曲线
随时间的变化曲线___________ 。
②1~4四个点中, 的点有
的点有___________ 。
③反应进行到4min时, 的转化率是
的转化率是___________ 。
④下列措施能使该反应速率加快的是___________ 。
A.增大容器体积 B.增大 的浓度 C.恒容条件下充入He D.加入合适的催化剂
的浓度 C.恒容条件下充入He D.加入合适的催化剂
(4)如图是氢氧燃料电池构造示意图:

该电池工作时,电流的流向为___________ (填“a→b”或“b→a”),正极的电极反应式为___________ 。
 (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量
(2)下列可以说明该反应达到平衡的是___________。
A.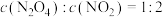 | B. |
| C.容器内气体的平均摩尔质量不再变化 | D.混合气体的密度不再变化 |

 ,
,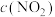 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。
①在图中画出0~16min时间段内,
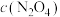 随时间的变化曲线
随时间的变化曲线②1~4四个点中,
 的点有
的点有③反应进行到4min时,
 的转化率是
的转化率是④下列措施能使该反应速率加快的是
A.增大容器体积 B.增大
 的浓度 C.恒容条件下充入He D.加入合适的催化剂
的浓度 C.恒容条件下充入He D.加入合适的催化剂(4)如图是氢氧燃料电池构造示意图:

该电池工作时,电流的流向为
您最近一年使用:0次
【推荐2】2020年,我国明确提出“碳达峰”与“碳中和”研究二氧化碳的回收对这一宏伟目标的实现具有现实意义。
(1)已知:CH4(g) C(s) + 2H2(g) △H= +75.0kJ·mol-1
C(s) + 2H2(g) △H= +75.0kJ·mol-1
CO2(g) + H2(g) CO(g) + H2O(g) △H=+41.0kJ·mol-1
CO(g) + H2O(g) △H=+41.0kJ·mol-1
CO(g) + H2(g) C(s) + H2O(g) △H=-131.0kJ·mol-1
C(s) + H2O(g) △H=-131.0kJ·mol-1
则反应I:CO2(g)+CH4(g) 2CO(g) +2H2(g)的△H=
2CO(g) +2H2(g)的△H=_______ 。
(2)若在一密闭容器中通入1mol CO2和1mol CH4,一定条件下发生反应I,测得CH4的平衡转化率、温度及压强的关系如图所示:
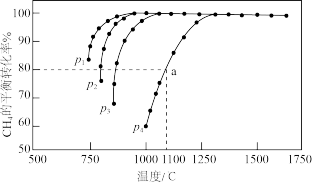
①下列描述能说明该反应处于化学平衡状态的是_______ (填标号)。
A.CO的体积分数保持不变
B.容器内混合气体的总质量保持不变
C.v(H2) =2v(CH4)
D.容器内混合气体的平均相对分子质量保持不变
②图中p1、p2、p3、p4,压强最小的是_______ ,判断理由是_______ 。
③已知v正(CO)=1.28×10-2 p(CH4)·p(CO2) (kPa·s-1),p(CH4)、p(CO2)代表各组分的分压(分压=总压×物质的量分数)。当p4=360kPa时,a点v正(CO2) =_______ kPa·s-1,此时平衡常数Kp=_______ (列出计算式即可,用平衡分压代替平衡浓度计算)。
(3)EleyRideal的反应机理认为CO2和CH4重整的反应历程如图所示。

①该重整反应的决速步骤为_______ (填“反应①” 或“反应②”)。
②不同温度下,产品气(H2和CO)的体积分数和氢碳比(H2/CO)如表所示。1000℃时的氢碳比与900℃时相比几乎没有变化,原因是_______ 。
(1)已知:CH4(g)
 C(s) + 2H2(g) △H= +75.0kJ·mol-1
C(s) + 2H2(g) △H= +75.0kJ·mol-1CO2(g) + H2(g)
 CO(g) + H2O(g) △H=+41.0kJ·mol-1
CO(g) + H2O(g) △H=+41.0kJ·mol-1CO(g) + H2(g)
 C(s) + H2O(g) △H=-131.0kJ·mol-1
C(s) + H2O(g) △H=-131.0kJ·mol-1则反应I:CO2(g)+CH4(g)
 2CO(g) +2H2(g)的△H=
2CO(g) +2H2(g)的△H=(2)若在一密闭容器中通入1mol CO2和1mol CH4,一定条件下发生反应I,测得CH4的平衡转化率、温度及压强的关系如图所示:

①下列描述能说明该反应处于化学平衡状态的是
A.CO的体积分数保持不变
B.容器内混合气体的总质量保持不变
C.v(H2) =2v(CH4)
D.容器内混合气体的平均相对分子质量保持不变
②图中p1、p2、p3、p4,压强最小的是
③已知v正(CO)=1.28×10-2 p(CH4)·p(CO2) (kPa·s-1),p(CH4)、p(CO2)代表各组分的分压(分压=总压×物质的量分数)。当p4=360kPa时,a点v正(CO2) =
(3)EleyRideal的反应机理认为CO2和CH4重整的反应历程如图所示。

①该重整反应的决速步骤为
②不同温度下,产品气(H2和CO)的体积分数和氢碳比(H2/CO)如表所示。1000℃时的氢碳比与900℃时相比几乎没有变化,原因是
| 温度(℃) | H2(%) | CO(%) | H2/CO |
| 800 | 19.02 | 22.26 | 0.85 |
| 900 | 28.97 | 40.23 | 0.72 |
| 1000 | 38.27 | 53.76 | 0.71 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ.在T℃时,发生反应C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为_______ 。
②该反应达到平衡的标志是_______ 。
A.气体的平均相对分子质量不变
B.气体的密度不变
C.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
D.气体的总物质的量不变
E.ʋ(H2O)=ʋ(H2)
Ⅱ.化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。化学电源与我们生产、生活息息相关,请回答下列问题:
(2)下列有关电池的叙述中正确的是_______ 。
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
(3)锌铜原电池如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列正确的是_______
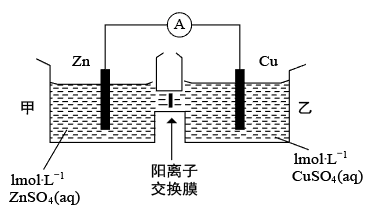
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c( )减小
)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
(4)乙烷碱性燃料电池负极反应方程式为_______ 。
(5)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是_______ 。
 CO(g)+H2(g)。
CO(g)+H2(g)。(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为
②该反应达到平衡的标志是
A.气体的平均相对分子质量不变
B.气体的密度不变
C.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
D.气体的总物质的量不变
E.ʋ(H2O)=ʋ(H2)
Ⅱ.化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。化学电源与我们生产、生活息息相关,请回答下列问题:
(2)下列有关电池的叙述中正确的是
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
(3)锌铜原电池如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列正确的是

A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(
 )减小
)减小C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
(4)乙烷碱性燃料电池负极反应方程式为
(5)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
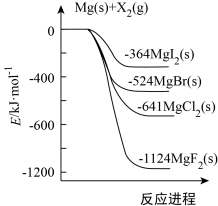
【推荐1】(1)下图是金属镁和卤素单质(X2)反应的能量变化示意图。
写出MgBr2(s)与Cl2(g)生成MgCl(s)和Br2(l)的热化学方程式______________________________ 。
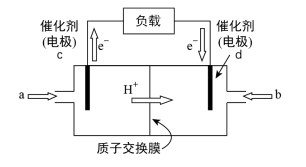
(2)甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。当电池中有2mol e-发生转移时,左右两侧溶液的质量之差为______ g(假设反应物耗尽,忽略气体的溶解)。
(3)250mLK2SO4和CuSO4的混合溶液中c(SO42-)=0. 5mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况下)。假定电解后溶液体积仍为250mL,写出阴极电极反应式______________ 原混合溶液中c(K+)=__________________
(4)NaHSO3溶液在不同温度下均可被过量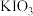 KIO3氧化。将浓度均为0.020mol/L
KIO3氧化。将浓度均为0.020mol/L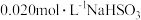 NaHSO3溶液(含少量淀粉)10ml
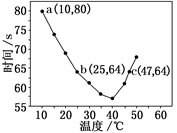
NaHSO3溶液(含少量淀粉)10ml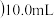 、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的
、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的 NaHSO3反应速率为
NaHSO3反应速率为________________
写出MgBr2(s)与Cl2(g)生成MgCl(s)和Br2(l)的热化学方程式
(2)甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。当电池中有2mol e-发生转移时,左右两侧溶液的质量之差为
(3)250mLK2SO4和CuSO4的混合溶液中c(SO42-)=0. 5mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况下)。假定电解后溶液体积仍为250mL,写出阴极电极反应式
(4)NaHSO3溶液在不同温度下均可被过量
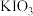 KIO3氧化。将浓度均为0.020mol/L
KIO3氧化。将浓度均为0.020mol/L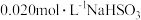 NaHSO3溶液(含少量淀粉)10ml
NaHSO3溶液(含少量淀粉)10ml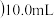 、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的
、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的 NaHSO3反应速率为
NaHSO3反应速率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知Fe2O3(s) + 3 C(s) = 2 Fe(s) + 3CO (g) △H1= +489.0 kJ/mol,
C(s)+CO2(g)=2CO(g) △H2= +172.5.0 kJ/mol,
则CO还原Fe2O3(s)的热化学方程式为__________________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液),写出该电池的负极反应式_______________ 。
(3)在一定温度下,将CO2和H2充入固定体积的密闭容器中,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①请用各组分平衡浓度表示该反应的平衡常数表达式_____ 。
②上述反应达到平衡的标志是_____ 。
A v正(CO2)= v逆(H2O)
B 单位时间生成3 mol H2的同时消耗1 mol CH3OH
C 容器内的总压强不再随时间变化
D 混合气体的密度不再随时间变化
E 混合气体的平均摩尔质量不再随时间变化
③在两种温度条件下,测得上述反应中CH3OH的物质的量随时间的变化曲线如图所示,曲线I、II对应的平衡常数大小关系为KI_______ KII(填“>”、“=”或“<”)

④若某温度下,在2 L的密闭容器中充入2 mol CO2和6 mol H2发生上述反应,5 min达到平衡,平衡时CO2的转化率为60%,用H2表示该反应的平均速率是______ ,该温度下的平衡常数为________ ,若该温度下,在2 L的密闭容器中充入1.5 mol CO2、3 mol H2、1 mol CH3OH和0.5 mol H2O(g),则此时该反应向_______ 方向(填“正反应”或“逆反应”)移动,请说明理由:____________ 。
(1)CO可用于炼铁,
已知Fe2O3(s) + 3 C(s) = 2 Fe(s) + 3CO (g) △H1= +489.0 kJ/mol,
C(s)+CO2(g)=2CO(g) △H2= +172.5.0 kJ/mol,
则CO还原Fe2O3(s)的热化学方程式为
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液),写出该电池的负极反应式
(3)在一定温度下,将CO2和H2充入固定体积的密闭容器中,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)①请用各组分平衡浓度表示该反应的平衡常数表达式
②上述反应达到平衡的标志是
A v正(CO2)= v逆(H2O)
B 单位时间生成3 mol H2的同时消耗1 mol CH3OH
C 容器内的总压强不再随时间变化
D 混合气体的密度不再随时间变化
E 混合气体的平均摩尔质量不再随时间变化
③在两种温度条件下,测得上述反应中CH3OH的物质的量随时间的变化曲线如图所示,曲线I、II对应的平衡常数大小关系为KI

④若某温度下,在2 L的密闭容器中充入2 mol CO2和6 mol H2发生上述反应,5 min达到平衡,平衡时CO2的转化率为60%,用H2表示该反应的平均速率是
您最近一年使用:0次
【推荐3】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)反应②是________ (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________ (用K1、K2表示)。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)a物质一极的电极反应式_________________ ;
Ⅱ. 我国是一个多煤少油的国家,科学家致力于以煤为原料生产重要的化工原料烯烃,目前已取得重大突破,制乙烯的原理如下:
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) Δ H1=+ 131.3kJ·mol -1
反应②:CO(g)+2H2(g)⇌CH3OH(g) Δ H2
反应③:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) Δ H3=- 23.9 kJ·mol -1
反应④: CH3OCH3(g)⇌C2H4(g)+H2O(g) Δ H4=- 29.1kJ·mol -1
(1)反应①能自发进行的条件是____ (填“高温”或“低温”)。
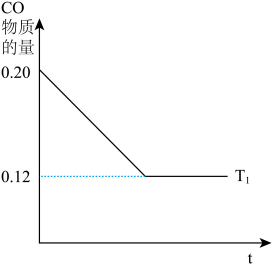
(2)温度为T1 时,向2 L密闭容器中投0.20 mol CO和0.40 mol H2,发生反应②, CO的物质的量与时间的关系如图所示,则该温度时反应的平衡常数K=____ ;已知温度T2>T1,请在原图上画出 在温度T2时反应过程中CO的物质的量与时间的关系图___ 。
(3)根据已知条件求算下列反应的反应热
2CH3OH(g)⇌C2H4(g)+2H2O(g) Δ H =________ kJ·mol -1
(4)某课题研究小组将甲醇蒸气以一定的流速持续通过相同量的催化剂,研究温度对甲醇转化率和乙烯产率的影响,得如下图象,则下列结论不正确 的是_______ 。

A. 制乙烯的同时还发生了其它反应
B. 一段时间后甲醇转化率下降是由于反应逆向进行了
C. 乙烯的产率随温度升高而增大
D. 制乙烯比较适宜的温度是400-450°C
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O CH3OH(g)+H2O | K3 | ||
(1)反应②是
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)a物质一极的电极反应式
Ⅱ. 我国是一个多煤少油的国家,科学家致力于以煤为原料生产重要的化工原料烯烃,目前已取得重大突破,制乙烯的原理如下:
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) Δ H1=+ 131.3kJ·mol -1
反应②:CO(g)+2H2(g)⇌CH3OH(g) Δ H2
反应③:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) Δ H3=- 23.9 kJ·mol -1
反应④: CH3OCH3(g)⇌C2H4(g)+H2O(g) Δ H4=- 29.1kJ·mol -1
(1)反应①能自发进行的条件是
(2)温度为T1 时,向2 L密闭容器中投0.20 mol CO和0.40 mol H2,发生反应②, CO的物质的量与时间的关系如图所示,则该温度时反应的平衡常数K=

(3)根据已知条件求算下列反应的反应热
2CH3OH(g)⇌C2H4(g)+2H2O(g) Δ H =
(4)某课题研究小组将甲醇蒸气以一定的流速持续通过相同量的催化剂,研究温度对甲醇转化率和乙烯产率的影响,得如下图象,则下列结论

A. 制乙烯的同时还发生了其它反应
B. 一段时间后甲醇转化率下降是由于反应逆向进行了
C. 乙烯的产率随温度升高而增大
D. 制乙烯比较适宜的温度是400-450°C
您最近一年使用:0次



