配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)基态镍原子的价电子排布式为_______ 。
(2) 可以形成多种配离子,如[Ni(NH3)4]2+、[Ni(CN)4]2-、丁二酮肟镍分子(见图)等。
可以形成多种配离子,如[Ni(NH3)4]2+、[Ni(CN)4]2-、丁二酮肟镍分子(见图)等。
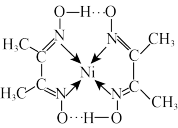
①1 mol[Ni(NH3)4]2+中含有_______ molσ键。
②[Ni(NH3)4]2+中H—N—H键角比NH3分子中H—N—H键角_______ (填“大”或“小”)。
③丁二酮肟镍分子内含有的作用力有_______ (填字母)。
a.配位键 b.离子键 c.氢键 d.范德华力
(3)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则Al(OH)4]-中存在_______ (填序号)
a.共价键 b.非极性键 c.配位键 d. 键 e. π键
键 e. π键
(4)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象。则第一种配合物的结构式可表示为_______ ,第二种配合物的结构式可表示为_______ 。若在第二种配合物的溶液中滴加AgNO3溶液,则产生的现象是_______ 。
(5)关于[Ti(NH3)5Cl]Cl2的说法中错误的是_______ 。
A.中心原子的化合价为+3价
B.中心原子的配位数是6
C.含1mol[Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生3mol白色沉淀
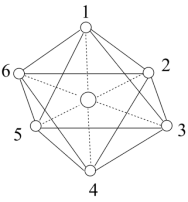
(6)已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+的结构的数目为_______ 。
(1)基态镍原子的价电子排布式为
(2)
 可以形成多种配离子,如[Ni(NH3)4]2+、[Ni(CN)4]2-、丁二酮肟镍分子(见图)等。
可以形成多种配离子,如[Ni(NH3)4]2+、[Ni(CN)4]2-、丁二酮肟镍分子(见图)等。
①1 mol[Ni(NH3)4]2+中含有
②[Ni(NH3)4]2+中H—N—H键角比NH3分子中H—N—H键角
③丁二酮肟镍分子内含有的作用力有
a.配位键 b.离子键 c.氢键 d.范德华力
(3)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则Al(OH)4]-中存在
a.共价键 b.非极性键 c.配位键 d.
 键 e. π键
键 e. π键(4)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象。则第一种配合物的结构式可表示为
(5)关于[Ti(NH3)5Cl]Cl2的说法中错误的是
A.中心原子的化合价为+3价
B.中心原子的配位数是6
C.含1mol[Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生3mol白色沉淀
(6)已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+的结构的数目为

更新时间:2022-07-18 17:19:35
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D、E、F 6种元素,它们的核电荷数依次增大,且都小于36。其中C、E、F是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。请回答下列问题:
(1)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)_______________ 。
(2)元素B与D的电负性的大小关系是__________ ,C与E的第一电离能的大小关系是_______ 。(填>、<、=,用元素符号表示)
(3)用轨道表示式表示D元素原子的价电子构型_______________________ 。
(4)C、E最高价氧化物对应的水化物相互反应的离子方程式为_________________ 。
(5)F在元素周期表中的位置是___________ 区,其基态原子的电子排布式为____________________ 。
(6)均为A、B、D、E四种元素组成的两种化合物可以相互反应,写出该反应的离子方程式为________ 。
(1)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)
(2)元素B与D的电负性的大小关系是
(3)用轨道表示式表示D元素原子的价电子构型
(4)C、E最高价氧化物对应的水化物相互反应的离子方程式为
(5)F在元素周期表中的位置是
(6)均为A、B、D、E四种元素组成的两种化合物可以相互反应,写出该反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图所示。试回答:
(1)镓的基态原子的电子排布式是______ 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___ ,与同一个镓原子相连的砷原子构成的空间构型为____ 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是___ (用氢化物分子式表示)。
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为____ 。
(5)比较二者的第一电离能:As____ Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是__ (填字母)。
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga C.砷化镓晶体中含有配位键
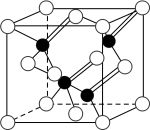
(1)镓的基态原子的电子排布式是
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为
(5)比较二者的第一电离能:As
(6)下列说法正确的是
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga C.砷化镓晶体中含有配位键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______ ,其中能量较高的是_______ 。(填标号)
a.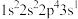 b.
b.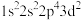 c.
c.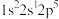 d.
d.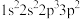
(2)①一氯乙烯(C2H3Cl)分子中,C的一个_______ 杂化轨道与Cl的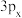 轨道形成
轨道形成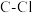
_______ 键,并且Cl的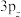 轨道与C的
轨道与C的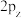 轨道形成3中心4电子的大
轨道形成3中心4电子的大 键
键 。
。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,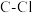 键长的顺序是
键长的顺序是_______ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的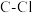 键越强;(ⅱ)
键越强;(ⅱ)_______ 。
(1)氟原子激发态的电子排布式有
a.
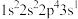 b.
b.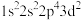 c.
c.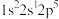 d.
d.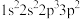
(2)①一氯乙烯(C2H3Cl)分子中,C的一个
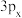 轨道形成
轨道形成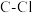
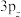 轨道与C的
轨道与C的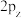 轨道形成3中心4电子的大
轨道形成3中心4电子的大 键
键 。
。②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,
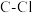 键长的顺序是
键长的顺序是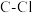 键越强;(ⅱ)
键越强;(ⅱ)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
(1)已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色。下列反应曾用于检测司机是否酒后驾驶:2
在溶液中为黄色。下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH。
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH。
①配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是_______ (填元素符号)。
②向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液,产生0.2mol沉淀,已知Cr3+的配位数为6,则CrCl3·6H2O的化学式可表示为_______ 。
(2)有下列实验:

①溶剂X可以是_______ (填名称)。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是_______ 。
(3)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4。
①Ni(CO)4的结构式为_______ 。
②下列可作为溶解Ni(CO)4的溶剂是_______
A.水B.四氯化碳C.盐酸D.氯化钠溶液
(1)已知:
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色。下列反应曾用于检测司机是否酒后驾驶:2
在溶液中为黄色。下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH。
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH。①配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是
②向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液,产生0.2mol沉淀,已知Cr3+的配位数为6,则CrCl3·6H2O的化学式可表示为
(2)有下列实验:

①溶剂X可以是
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
(3)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4。
①Ni(CO)4的结构式为
②下列可作为溶解Ni(CO)4的溶剂是
A.水B.四氯化碳C.盐酸D.氯化钠溶液
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】某兴趣小组探究氨水与硫酸铜反应的实验现象,做了如下实验:操作步骤及实验现象如下表。回答下列相关问题:
经查资料:①深蓝色透明溶液及深蓝色晶体中,深蓝色都是由于存在
② 结构为平面四边形
结构为平面四边形
③深蓝色晶体是
(1)配离子 中中心离子的核外电子占据最高能级为
中中心离子的核外电子占据最高能级为___________ 。
(2)配离子 中
中 采取的杂化类型为
采取的杂化类型为___________ ,配体中N采取的杂化类型为___________ (填标号)。
A. B.
B. C.
C. D.
D.
(3) 中
中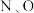 的第一电离能N
的第一电离能N___________ O(填“>”,“<”或“=”),基态 比
比 稳定的原因是
稳定的原因是___________ 。
(4)操作2涉及的离子方程式为___________ 。
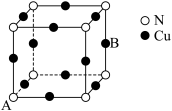
(5)N和Cu形成的化合物的晶胞结构如图所示,若 为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是
为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是___________  。
。
| 操作步骤 | 实验现象 |
操作1:向盛有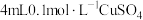 溶液的试管里滴加几滴1mol/L氨水; 溶液的试管里滴加几滴1mol/L氨水; | 形成难溶物; |
| 操作2:继续滴加氨水并振荡试管: | 难溶物溶解,得到深蓝色透明溶液; |
| 操作3:再向试管中加入极性小的溶剂(如8mL95%的乙醇) | 析出深蓝色的晶体。 |

②
 结构为平面四边形
结构为平面四边形③深蓝色晶体是

(1)配离子
 中中心离子的核外电子占据最高能级为
中中心离子的核外电子占据最高能级为(2)配离子
 中
中 采取的杂化类型为
采取的杂化类型为A.
 B.
B. C.
C. D.
D.
(3)
 中
中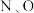 的第一电离能N
的第一电离能N 比
比 稳定的原因是
稳定的原因是(4)操作2涉及的离子方程式为
(5)N和Cu形成的化合物的晶胞结构如图所示,若
 为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是
为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
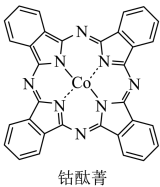
【推荐3】将钴酞菁和三氯化铝复合嵌接在碳纳米管上,可制得一种高效催化剂。
(1)碳的几种单质如图所示。___________ 。
②下列说法正确的是_____ 。
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
(2)钴酞菁是配位化合物,其分子结构如图所示。____________ 。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。________ 。
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是_____________ 。
③AlF3晶体距离F最近的阳离子有_____ 个。
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为_____________ g•cm﹣3。(列出计算式,阿伏加德罗常数用NA表示,1nm=10﹣7cm)
(1)碳的几种单质如图所示。
②下列说法正确的是
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
(2)钴酞菁是配位化合物,其分子结构如图所示。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。
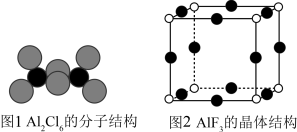
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是
③AlF3晶体距离F最近的阳离子有
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________ ,Ni在元素周期表中的位置是_________ 。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______ ,中心原子的轨道杂化类型是_______ 。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:
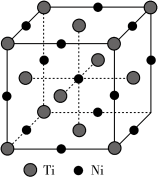
①该合金中Ti的配位数为________ 。
②若合金的密度为d g/cm3,晶胞边长a=________ pm。(用含d的计算式表示)
(1)写出基态Ti原子的电子排布式:
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为
②若合金的密度为d g/cm3,晶胞边长a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
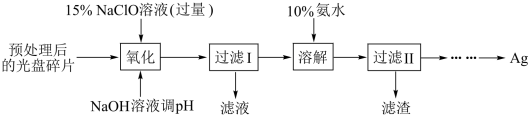
【推荐2】某科研小组采用如下方案回收一种光盘金属层中的少量 (金属层中其他金属含量过低,对实验的影响可忽略)。
(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:① 溶液在受热或酸性条件下易分解,如:
溶液在受热或酸性条件下易分解,如: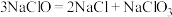
② 可溶于氨水生成
可溶于氨水生成
③常温时 (水合肼)在碱性条件下能还原
(水合肼)在碱性条件下能还原 :
: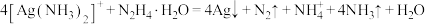 。
。
(1)“氧化”阶段需在 条件下进行,适宜的加热方式为
条件下进行,适宜的加热方式为___________ 。
(2) 溶液与
溶液与 反应的产物为
反应的产物为 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。 也能氧化
也能氧化 ,从反应产物的角度分析,以
,从反应产物的角度分析,以 代替
代替 的缺点是
的缺点是___________ 。
(3)为提高 的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并___________ 。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加 氨水,则需要增加氨水的用量,除因过量
氨水,则需要增加氨水的用量,除因过量 与
与 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为___________ 。
(5)“溶解”阶段发生反应的离子方程式为___________ 。
(6)请设计从“过滤Ⅱ”后的滤液中获取单质 的实验方案:
的实验方案:___________ (实验中须使用的试剂有: 水合肼溶液,
水合肼溶液,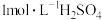 )。
)。
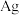 (金属层中其他金属含量过低,对实验的影响可忽略)。
(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:①
 溶液在受热或酸性条件下易分解,如:
溶液在受热或酸性条件下易分解,如: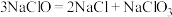
②
 可溶于氨水生成
可溶于氨水生成
③常温时
 (水合肼)在碱性条件下能还原
(水合肼)在碱性条件下能还原 :
: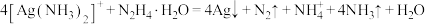 。
。(1)“氧化”阶段需在
 条件下进行,适宜的加热方式为
条件下进行,适宜的加热方式为(2)
 溶液与
溶液与 反应的产物为
反应的产物为 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 也能氧化
也能氧化 ,从反应产物的角度分析,以
,从反应产物的角度分析,以 代替
代替 的缺点是
的缺点是(3)为提高
 的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加
 氨水,则需要增加氨水的用量,除因过量
氨水,则需要增加氨水的用量,除因过量 与
与 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为(5)“溶解”阶段发生反应的离子方程式为
(6)请设计从“过滤Ⅱ”后的滤液中获取单质
 的实验方案:
的实验方案: 水合肼溶液,
水合肼溶液,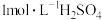 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】以Pd(NH3)2Cl2固体为原料制备纯PdCl2,其部分实验过程如图:
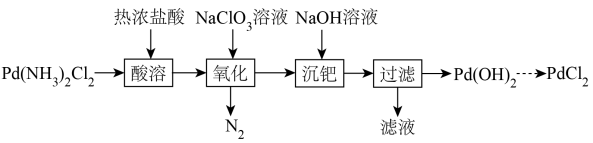
已知:①Pd(NH3)2Cl2+2HCl=(NH4)2[PdCl4];
②H2PdCl4+4NaOH=Pd(OH)2↓+4NaCl+2H2O;
③Pd(OH)2有两性,遇氨水会生成[Pd(NH3)4]2+。
(1)H2PdCl4为二元强酸,写出“氧化”时主要发生反应的离子方程式:________ 。
(2)“氧化”时易产生一种黄绿色的有毒气体,该气体的化学式为_______ 。
(3)若“氧化”不充分会导致“沉钯”时Pd(OH)2的产率降低,原因可能是_______ 。氧化液中Pd的浓度一定,为提高Pd(OH)2的产率,“沉钯”时需控制的条件有反应的温度、_______ 。
(4)在配合物Pd(NH3)2Cl2中,提供空轨道的元素为_______ 。
(5)CO可将PdCl2溶液还原得到金属Pd,同时产生一种温室气体,写出反应的化学方程式:________ 。标准状况下,1体积的钯粉大约可吸附896体积的氢气形成一种氢化物(钯粉的密度为10.64g•cm-3,Pd的相对原子质量为106.4),据此可知该种钯(Pd)的氢化物的化学式为________ 。若用H2代替CO还原PdCl2,消耗的H2质量比理论值略高,其原因是______ 。

已知:①Pd(NH3)2Cl2+2HCl=(NH4)2[PdCl4];
②H2PdCl4+4NaOH=Pd(OH)2↓+4NaCl+2H2O;
③Pd(OH)2有两性,遇氨水会生成[Pd(NH3)4]2+。
(1)H2PdCl4为二元强酸,写出“氧化”时主要发生反应的离子方程式:
(2)“氧化”时易产生一种黄绿色的有毒气体,该气体的化学式为
(3)若“氧化”不充分会导致“沉钯”时Pd(OH)2的产率降低,原因可能是
(4)在配合物Pd(NH3)2Cl2中,提供空轨道的元素为
(5)CO可将PdCl2溶液还原得到金属Pd,同时产生一种温室气体,写出反应的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价层电子的电子排布式为_______ ;单晶硅的晶体类型为_______ 。 是生产高纯硅的前驱体,其中Si采取的杂化类型为
是生产高纯硅的前驱体,其中Si采取的杂化类型为_______ 。
(2)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇( ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是_______ 。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为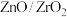 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。

 离子在晶胞中的配位数是
离子在晶胞中的配位数是_______ ,晶胞参数为a pm、a pm、c pm,该晶体密度为_______  (写出表达式)。
(写出表达式)。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价层电子的电子排布式为
 是生产高纯硅的前驱体,其中Si采取的杂化类型为
是生产高纯硅的前驱体,其中Si采取的杂化类型为(2)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(
 ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
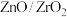 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。
 离子在晶胞中的配位数是
离子在晶胞中的配位数是 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.根据所学知识回答下列问题:
(1)铁原子价电子轨道表示式为______ ,与铁同周期的元素的基态原子中,最外层电子数与铁相同的元素共有_____ 种(包含铁)。
(2)下列关于铁的说法,不正确的是_____ (填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2违反了泡利原理
B.铁属于黑色金属,在周期表中属于ds区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,配体CO中C是配原子
(3)某铁的化合物结构简式如图所示。
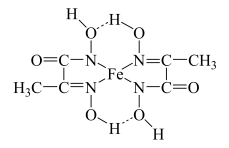
①组成上述化合物中5种元素原子电负性由小到大的顺序为_____ 。
②上述化合物中氮原子的杂化方式有_____ 。
③在图中用“→”标出亚铁离子的配位键_____ 。
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是后者,原因是_____ 。
(1)铁原子价电子轨道表示式为
(2)下列关于铁的说法,不正确的是
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2违反了泡利原理
B.铁属于黑色金属,在周期表中属于ds区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,配体CO中C是配原子
(3)某铁的化合物结构简式如图所示。

①组成上述化合物中5种元素原子电负性由小到大的顺序为
②上述化合物中氮原子的杂化方式有
③在图中用“→”标出亚铁离子的配位键
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是后者,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________ ,3d能级上的未成对电子数为_________ ,能量最高能级的电子云形状为_________ 。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________ ,写出一个与SCN-具有相同空间构型的分子:_________ 。
(3)氮元素的最简单氢化物为氨,氨的沸点_________ (填“高于”或“低于”)膦(PH3),原因是_________ 。氮元素另一种氢化物联氨(N2H4)是_________ (填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________ 。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________ 。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________ 。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________ g/cm3(设阿伏伽德罗常数的值为NA)。
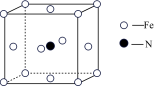
(1)铁元素基态原子的电子排布式为
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为
(3)氮元素的最简单氢化物为氨,氨的沸点
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:

您最近一年使用:0次



