请回答下列问题:
(1)写出醋酸的电离方程式:_______ ;
(2)向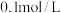 醋酸溶液中加入少量水,电离平衡向
醋酸溶液中加入少量水,电离平衡向_______ 移动(填“左”或“右”)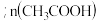
_______ ;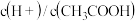
_______ (填“增大”、“减小”或“不变”)。
(3)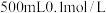 醋酸溶液
醋酸溶液 和
和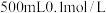 盐酸溶液
盐酸溶液 ,溶液的导电能力a
,溶液的导电能力a_______ b;完全中和这两种酸,消耗 的量a
的量a_______ b(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(4)已知 时部分弱电解质的电离平衡常数数据如表所示:
时部分弱电解质的电离平衡常数数据如表所示:
以下说法不正确的是_______。(填选项)
(1)写出醋酸的电离方程式:
(2)向
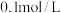 醋酸溶液中加入少量水,电离平衡向
醋酸溶液中加入少量水,电离平衡向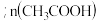
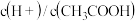
(3)
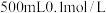 醋酸溶液
醋酸溶液 和
和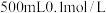 盐酸溶液
盐酸溶液 ,溶液的导电能力a
,溶液的导电能力a 的量a
的量a ”、“
”、“ ”或“
”或“ ”)。
”)。(4)已知
 时部分弱电解质的电离平衡常数数据如表所示:
时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | 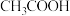 |  | 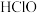 |
| 电离平衡常数 | 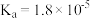 | 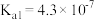 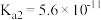 | 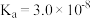 |
A.向弱酸溶液中加入少量 溶液,电离平衡常数变大 溶液,电离平衡常数变大 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.表中三种酸,酸性最强的是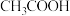 |
D.向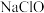 溶液中通入 溶液中通入 气体,可以生成 气体,可以生成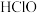 |
更新时间:2022-09-02 10:07:57
|
【知识点】 弱电解质在水溶液中的电离平衡解读
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】测得某温度下0.5mol·L-1 HNO2(亚硝酸)溶液的pH约为2。
(1)写出HNO2的电离方程式___ 。
(2)将溶液加水稀释至10倍后,c(NO2-)___ (填“增大”、“减小”或“不变”),n(H+)___ (填“增大”、“减小”或“不变”),pH区间范围是___ 。
A.1~2 B.2~3 C.3~4 D.4~5
(3)分别取同浓度同体积的盐酸与亚硝酸,以同样的操作与足量NaOH溶液反应,测得反应溶液的最高温度盐酸要高于亚硝酸,说明可能的原因___ 。
(4)0.1mol·L-1 NaNO2溶液pH___ 7(填“>”、“<”或“=”),溶液中含有___ 种分子,溶液中c(Na+)___ c(NO2-)(填“>”、“<”或“=”),下列措施能提高溶液中c(OH-)的是___ 。
A.适当升高温度 B.增加压强 C.加水 D.加入NH4Cl固体 E.加入Na2CO3固体
(1)写出HNO2的电离方程式
(2)将溶液加水稀释至10倍后,c(NO2-)
A.1~2 B.2~3 C.3~4 D.4~5
(3)分别取同浓度同体积的盐酸与亚硝酸,以同样的操作与足量NaOH溶液反应,测得反应溶液的最高温度盐酸要高于亚硝酸,说明可能的原因
(4)0.1mol·L-1 NaNO2溶液pH
A.适当升高温度 B.增加压强 C.加水 D.加入NH4Cl固体 E.加入Na2CO3固体
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】现有a.盐酸、b.醋酸、c.硫酸三种稀溶液,用字母回答下列问题。
(1) 若三种酸的物质的量浓度相等。
① 三种溶液中的c(H+)大小关系为___________ 。
② 取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为___________ 。
③ 若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为___________ 。
④ 若取等质量相同状态下的Zn分别跟这三种溶液反应,反应速率大小关系为___________ 。
(2) 若三种酸溶液中的c(H+)相等。
① 三种酸的物质的量浓度大小关系为___________ 。
② 取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为___________ 。
③ 若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为___________ 。
(1) 若三种酸的物质的量浓度相等。
① 三种溶液中的c(H+)大小关系为
② 取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为
③ 若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为
④ 若取等质量相同状态下的Zn分别跟这三种溶液反应,反应速率大小关系为
(2) 若三种酸溶液中的c(H+)相等。
① 三种酸的物质的量浓度大小关系为
② 取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为
③ 若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
I.某学生用 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是_______ (填编号)。
(2)滴定终点的现象为滴入最后半滴氢氧化钠溶液后,_______ 。
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______ 中(从图中选填“甲”或“乙”)。

II.常温下,有浓度均为 的下列6种溶液:
的下列6种溶液:
①NaCN溶液 ②NaOH溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液 ⑥
溶液 ⑥ 溶液
溶液
(4)溶液③pH=10的原因是_______ (用离子方程式表示)。
(5)溶液①中各离子浓度由大到小的顺序是_______ 。
(6)pH相等的溶液②和溶液④,稀释相同的倍数,则稀释后pH(NaOH)_______ 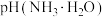 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(7)25℃时,向①NaCN溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
I.某学生用
 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是
(2)滴定终点的现象为滴入最后半滴氢氧化钠溶液后,
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入

II.常温下,有浓度均为
 的下列6种溶液:
的下列6种溶液:①NaCN溶液 ②NaOH溶液 ③
 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液 ⑥
溶液 ⑥ 溶液
溶液| HCN |  |  |
 | 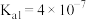 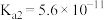 | 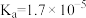 |
(5)溶液①中各离子浓度由大到小的顺序是
(6)pH相等的溶液②和溶液④,稀释相同的倍数,则稀释后pH(NaOH)
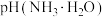 (填“>”“<”或“=”)
(填“>”“<”或“=”)(7)25℃时,向①NaCN溶液中通入少量
 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次



