实验小组欲用0.5000mol•L-1标准NaOH溶液标定未知浓度的H2SO4溶液,其操作分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.5000mol•L-1标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的为_____ 个。
(2)排除碱式滴定管中气泡的方法应采用如图所示操作中的_____ (填序号)。
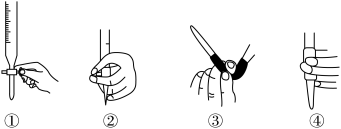
(3)步骤⑤滴定时眼睛应注视__________ ;到达滴定终点的现象是_____ 。
(4)以下是实验数据记录表:
根据表中数据计算该H2SO4溶液的物质的量浓度为_____ mol/L。
(5)下列操作可能使所测H2SO4溶液的浓度偏高的是_____ (填字母)。
①用蒸馏水洗涤碱式滴定管,注入0.5000mol•L-1标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的为
(2)排除碱式滴定管中气泡的方法应采用如图所示操作中的

(3)步骤⑤滴定时眼睛应注视
(4)以下是实验数据记录表:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 2.20 | 18.40 |
| 3 | 20.00 | 2.00 | 18.16 |
(5)下列操作可能使所测H2SO4溶液的浓度偏高的是
| A.锥形瓶装液前,留有少量蒸馏水 |
| B.碱式滴定管盛装标准液前未润洗 |
| C.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| D.滴定过程中刚变色就立即停止滴定 |
更新时间:2022-09-06 21:26:33
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。
①a=___ (忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ⅱ显酸性的原因:___ 。
③试剂ⅱ中微粒浓度关系正确的有___ (填序号)。
a.c(CH3COOH)>c(Na+)>c(CH3COO-)
b.2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c.c(CH3COOH)+c(CH3COO-)=0.2mol/L
④由表中数据可知,试剂ⅱ的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是___ (填序号)。
a.HCl—NaCl b.KOH—KCl c.NH3•H2O—NH4Cl d.Na2CO3—NaHCO3
(2)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,丙为0.1mol/L的CH3COOH溶液,某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,选用酚酞作指示剂,得到如图所示两条滴定曲线,请完成有关问题:
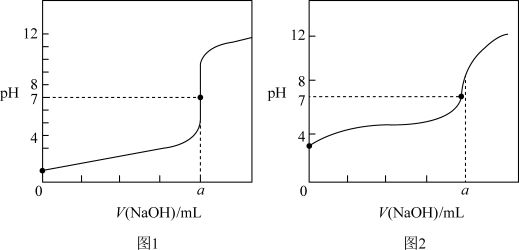
①甲溶液滴定丙溶液的曲线是___ 填“图1”或“图2”);
②a=___ 。
③用甲溶液滴定乙溶液,当___ 时,停止滴定。
④误差分析:在本实验的滴定过程中,下列操作会使实验结果偏小的是___ 。
a.酸式滴定管未用待测液液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.配制标准液时NaOH已部分潮解
d.锥形瓶洗净后未干燥
e.滴定前仰视读数,滴定后读数正确
⑤甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___ 。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。
| 试剂 | pH | ||
| 初始 | 通入0.01molHCl气体 | 加入0.01molNaOH固体 | |
| ⅰ.1LH2O | 7 | a | 12 |
| ⅱ.0.10molCH3COOH、0.10molCH3COONa配制成1L的溶液 | 4.76 | 4.67 | 4.85 |
②结合化学用语解释试剂ⅱ显酸性的原因:
③试剂ⅱ中微粒浓度关系正确的有
a.c(CH3COOH)>c(Na+)>c(CH3COO-)
b.2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c.c(CH3COOH)+c(CH3COO-)=0.2mol/L
④由表中数据可知,试剂ⅱ的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是
a.HCl—NaCl b.KOH—KCl c.NH3•H2O—NH4Cl d.Na2CO3—NaHCO3
(2)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,丙为0.1mol/L的CH3COOH溶液,某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,选用酚酞作指示剂,得到如图所示两条滴定曲线,请完成有关问题:

①甲溶液滴定丙溶液的曲线是
②a=
③用甲溶液滴定乙溶液,当
④误差分析:在本实验的滴定过程中,下列操作会使实验结果偏小的是
a.酸式滴定管未用待测液液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.配制标准液时NaOH已部分潮解
d.锥形瓶洗净后未干燥
e.滴定前仰视读数,滴定后读数正确
⑤甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】滴定是分析化学重要的分析方法,根据其原理回答下列问题:
Ⅰ.用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液(装置如图),某次滴定前、后盛放盐酸的滴定管中液面的位置。
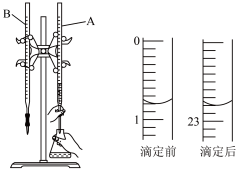
(1)仪器B的名称是___________ 。
(2)此次滴定消耗的盐酸是___________ mL。
(3)由下表可知,三次滴定中,有一次滴定所用标准盐酸体积有明显偏差,可能的原因是___________ 。(填写相应的字母)
a.锥形瓶用待测液润洗
b.滴定前滴定管尖嘴部分有气泡,滴定结束时气泡消失
c.滴定过程中锥形瓶中溶液溅出瓶外
d.滴定结束时,俯视读数
Ⅱ.高锰酸钾常用于亚硝酸盐含量的测定。有化学小组测定某样品中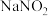 的含量,设计如下实验:
的含量,设计如下实验:
①称取样品a g,加水溶解,配成100mL溶液
②取25.00mL溶液于锥形瓶中,用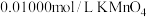 标准溶液(酸性)进行滴定,滴定终点时消耗标准溶液V mL。
标准溶液(酸性)进行滴定,滴定终点时消耗标准溶液V mL。
(4)向酸式滴定管中注入 标准溶液之前的一步操作为
标准溶液之前的一步操作为___________ 。
(5)达到滴定终点时的现象是___________ 。
(6)测得该样品中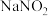 的质量分数为
的质量分数为___________ 。
Ⅰ.用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液(装置如图),某次滴定前、后盛放盐酸的滴定管中液面的位置。

(1)仪器B的名称是
(2)此次滴定消耗的盐酸是
(3)由下表可知,三次滴定中,有一次滴定所用标准盐酸体积有明显偏差,可能的原因是
| 待测NaOH溶液体积(mL) | 标准盐酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | |
| 10.00 | 0.40 | 20.50 |
| 10.00 | 2.10 | 24.20 |
| 10.00 | 4.10 | 24.00 |
b.滴定前滴定管尖嘴部分有气泡,滴定结束时气泡消失
c.滴定过程中锥形瓶中溶液溅出瓶外
d.滴定结束时,俯视读数
Ⅱ.高锰酸钾常用于亚硝酸盐含量的测定。有化学小组测定某样品中
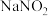 的含量,设计如下实验:
的含量,设计如下实验:①称取样品a g,加水溶解,配成100mL溶液
②取25.00mL溶液于锥形瓶中,用
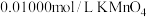 标准溶液(酸性)进行滴定,滴定终点时消耗标准溶液V mL。
标准溶液(酸性)进行滴定,滴定终点时消耗标准溶液V mL。(4)向酸式滴定管中注入
 标准溶液之前的一步操作为
标准溶液之前的一步操作为(5)达到滴定终点时的现象是
(6)测得该样品中
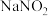 的质量分数为
的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】准确称取上述流程中的产品重铬酸钠晶体(Na2Cr2O7·2H2O)3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O =2I-+S4O
=2I-+S4O 用0.1000 mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:___________ 。
 =2I-+S4O
=2I-+S4O 用0.1000 mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是___________ 。
(2)如图装置中碎泡沫塑料及泡沫碎料板的作用是___________ 。
(3)将NaOH溶液倒入小烧杯中的确操作为___________ 。A.分多次倒入 B.一次倒入
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________ ;用Ba(OH)2溶液和稀硫酸代替氢氧化钠溶液和盐酸测得的中和热的数值会___________ 。(均填“偏大”“偏小”“无影响”)

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是
(2)如图装置中碎泡沫塑料及泡沫碎料板的作用是
(3)将NaOH溶液倒入小烧杯中的确操作为
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
(1)用___________ 式滴定管盛装0.2500 mol/L盐酸标准液。如图表示第二次滴定前后50mL滴定管中液面的位置。

该次滴定所用标准盐酸体积为______ mL。
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选用_____ 作指示剂。
| 滴定序号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | —— | —— | —— |
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
(1)用

该次滴定所用标准盐酸体积为
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选用
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.酸碱中和滴定实验:用标准NaOH溶液滴定待测的稀盐酸。
(1)仪器A的名称为___________ 。关于该仪器的使用方法正确的是___________ (选填序号)。

①使用前应检查仪器是否漏水;②洗涤该仪器:先用水洗,再用待盛溶液润洗2~3次;③排出该滴定管中气泡的操作为 ;④可用该仪器盛装高锰酸钾溶液等试剂。
;④可用该仪器盛装高锰酸钾溶液等试剂。
(2)取20.00mL待测稀盐酸置于锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用标准0.1000 NaOH溶液进行滴定。重复上述滴定操作3次,记录所用NaOH溶液的体积分别为18.05mL、17.95mL、18.00mL。
NaOH溶液进行滴定。重复上述滴定操作3次,记录所用NaOH溶液的体积分别为18.05mL、17.95mL、18.00mL。
①滴定终点的现象是___________ 。
②计算该待测稀盐酸的浓度:
___________  。
。
Ⅱ.试回答下列有关计算。
(3)25℃时,0.1 NaOH溶液中由水电离出的
NaOH溶液中由水电离出的
___________ 。与该NaOH溶液同pH的 溶液的物质的量浓度为
溶液的物质的量浓度为___________ 。
(4)已知T℃时pH=3的盐酸中由水电离出的 。则:
。则:
①T℃时,
___________ 。
②T℃时,0.01 NaOH溶液的pH=
NaOH溶液的pH=___________ 。
③T℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液恰好呈中性,则a与b之间应满足的关系是___________ 。
(1)仪器A的名称为

①使用前应检查仪器是否漏水;②洗涤该仪器:先用水洗,再用待盛溶液润洗2~3次;③排出该滴定管中气泡的操作为
 ;④可用该仪器盛装高锰酸钾溶液等试剂。
;④可用该仪器盛装高锰酸钾溶液等试剂。(2)取20.00mL待测稀盐酸置于锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用标准0.1000
 NaOH溶液进行滴定。重复上述滴定操作3次,记录所用NaOH溶液的体积分别为18.05mL、17.95mL、18.00mL。
NaOH溶液进行滴定。重复上述滴定操作3次,记录所用NaOH溶液的体积分别为18.05mL、17.95mL、18.00mL。①滴定终点的现象是
②计算该待测稀盐酸的浓度:

 。
。Ⅱ.试回答下列有关计算。
(3)25℃时,0.1
 NaOH溶液中由水电离出的
NaOH溶液中由水电离出的
 溶液的物质的量浓度为
溶液的物质的量浓度为(4)已知T℃时pH=3的盐酸中由水电离出的
 。则:
。则:①T℃时,

②T℃时,0.01
 NaOH溶液的pH=
NaOH溶液的pH=③T℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液恰好呈中性,则a与b之间应满足的关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_______ (填“偏大”、“偏小”或“不变”)。

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】用滴定法可以快速测定NaI溶液中 的浓度,主要步骤如下:
的浓度,主要步骤如下:
Ⅰ.配制标准溶液
①配制 标准溶液,放在棕色试剂瓶中备用。
标准溶液,放在棕色试剂瓶中备用。
②配制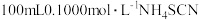 标准溶液,备用。
标准溶液,备用。
Ⅱ.滴定(主要步骤)
③取25.00mL待测NaI溶液于锥形瓶中,再加入 标准溶液(过量),使
标准溶液(过量),使 完全转化为AgI沉淀。
完全转化为AgI沉淀。
④加入 溶液作指示剂。
溶液作指示剂。
⑤用 标准溶液滴定过量的
标准溶液滴定过量的 至终点(原理为
至终点(原理为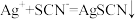 )。
)。
⑥重复上述操作两次。
三次实验测得的数据如表所示:
⑦数据处理。
已知:AgSCN为不溶于水的白色沉淀。
回答下列问题。
(1)存放 溶液的试剂瓶的瓶塞应选用
溶液的试剂瓶的瓶塞应选用___________ (填“玻璃塞”或“橡胶塞”)。
(2)指示剂 溶液不能在
溶液不能在 溶液之前加入,原因是
溶液之前加入,原因是___________ 。
(3)根据实验数据,计算出
___________ mol/L。
(4)下列操作会使测量结果偏小的是___________ (填序号)。
A.加 标准溶液时,少量
标准溶液时,少量 标准溶液洒出锥形瓶
标准溶液洒出锥形瓶
B.滴定管洗净后,直接装入 标准溶液
标准溶液
C.在滴定终点时仰视读数
 的浓度,主要步骤如下:
的浓度,主要步骤如下:Ⅰ.配制标准溶液
①配制
 标准溶液,放在棕色试剂瓶中备用。
标准溶液,放在棕色试剂瓶中备用。②配制
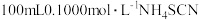 标准溶液,备用。
标准溶液,备用。Ⅱ.滴定(主要步骤)
③取25.00mL待测NaI溶液于锥形瓶中,再加入
 标准溶液(过量),使
标准溶液(过量),使 完全转化为AgI沉淀。
完全转化为AgI沉淀。④加入
 溶液作指示剂。
溶液作指示剂。⑤用
 标准溶液滴定过量的
标准溶液滴定过量的 至终点(原理为
至终点(原理为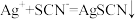 )。
)。⑥重复上述操作两次。
三次实验测得的数据如表所示:
| 实验序号 | 1 | 2 | 3 |
消耗 标准溶液的体积/mL 标准溶液的体积/mL | 10.24 | 10.02 | 9.98 |
⑦数据处理。
已知:AgSCN为不溶于水的白色沉淀。
回答下列问题。
(1)存放
 溶液的试剂瓶的瓶塞应选用
溶液的试剂瓶的瓶塞应选用(2)指示剂
 溶液不能在
溶液不能在 溶液之前加入,原因是
溶液之前加入,原因是(3)根据实验数据,计算出

(4)下列操作会使测量结果偏小的是
A.加
 标准溶液时,少量
标准溶液时,少量 标准溶液洒出锥形瓶
标准溶液洒出锥形瓶B.滴定管洗净后,直接装入
 标准溶液
标准溶液C.在滴定终点时仰视读数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________ (填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________ (电离度= ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________ b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________ mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________ 时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差分析:在本实验的滴定过程中,下列操作会使实验结果偏大的是_________ 。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图
(2)滴定前CH3COOH的电离度为
 ×100%)。
×100%)。(3)达到B、D状态时,反应消耗的NaOH溶液的体积a
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当
⑤重复②、③、④步骤3次。
数据记录如下:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为
(3)误差分析:在本实验的滴定过程中,下列操作会使实验结果偏大的是
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】国家标准规定,酿造的食醋中醋酸的含量不得低于3.5g/100mL。选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后_______ 。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为_______ mL。

③下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后用白醋稀溶液润洗
D.滴定过程中摇动锥形瓶时有液滴溅出
E.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
F.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用0.1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1
NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。

①滴定醋酸的曲线是_______ (填“Ⅰ”或“Ⅱ”)。
②滴定醋酸时,M点时微粒浓度大小关系是_______ ( 除外)。
除外)。
③滴定醋酸过程中,下列关系正确的是_______ 。
A.M点时溶液中有: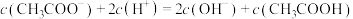
B.醋酸恰好反应完全时,溶液中有:
C.滴定过程中,曲线上任何一点,溶液中都有:
D.滴定过程中可能出现: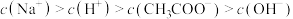
E.v=20mL时,溶液中有:
④若25℃时,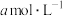 的醋酸与0.01
的醋酸与0.01 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为_______ (用含a的代数式表示)。

(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为

③下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后用白醋稀溶液润洗
D.滴定过程中摇动锥形瓶时有液滴溅出
E.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
F.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用0.1
 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1
NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是
②滴定醋酸时,M点时微粒浓度大小关系是
 除外)。
除外)。③滴定醋酸过程中,下列关系正确的是
A.M点时溶液中有:
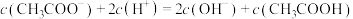
B.醋酸恰好反应完全时,溶液中有:

C.滴定过程中,曲线上任何一点,溶液中都有:

D.滴定过程中可能出现:
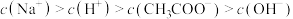
E.v=20mL时,溶液中有:

④若25℃时,
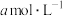 的醋酸与0.01
的醋酸与0.01 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现使用酸碱中和滴定法测定某盐酸的浓度。
Ⅰ.实验步骤
(1)如图,用___________ (填“甲”或“乙”)量取待测盐酸溶液20.00mL于锥形瓶中,向其中滴加2滴___________ 作指示剂。

(2)读取盛装0.1000 NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___________ mL。
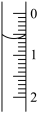
(3)滴定。左手___________ ,右手___________ ,眼睛___________ 。当___________ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定3次。
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(4)根据图表数据平均消耗的NaOH溶液的体积V=___________ mL,数据处理,可得
___________ 
(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是___________(填字母)。
Ⅰ.实验步骤
(1)如图,用

(2)读取盛装0.1000
 NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
(3)滴定。左手
Ⅱ.实验记录
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
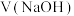 /mL /mL | 15.95 | 15.00 | 15.05 | 14.95 |
(4)根据图表数据平均消耗的NaOH溶液的体积V=


(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是___________(填字母)。
| A.碱式滴定管在滴定时未用NaOH标准溶液润洗 |
| B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失 |
| C.锥形瓶中加入待测盐酸溶液后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
您最近一年使用:0次

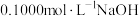 溶液滴定
溶液滴定 溶液,pH的变化如图所示。用化学符号表示滴定过程中溶液里微粒之间的浓度关系:
溶液,pH的变化如图所示。用化学符号表示滴定过程中溶液里微粒之间的浓度关系:




