用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是_______________ 1;
(2)KMnO4-氧化Fe2+的离子方程式补充完整:______
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:._________________ ;
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是_____________ ;
②Ⅳ中加入MnSO4的目的是:______________ ;
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:.
(4)已知:一定条件下,MnO
 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是
②Ⅳ中加入MnSO4的目的是:
2013·北京·高考真题 查看更多[4]
河南省范县第一中学2021-2022学年高一上学期第三次月考检测化学试题吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题(已下线)2014届高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)
更新时间:2019-01-30 18:14:09
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某兴趣小组同学向一定体积的 溶液中逐滴滴加稀
溶液中逐滴滴加稀 ,不断搅拌并测定溶液导电能力的变化(装置如图所示)。
,不断搅拌并测定溶液导电能力的变化(装置如图所示)。

I.实验测得混合溶液的导电能力随时间变化的曲线如图所示。

(1)写出 溶液与稀硫酸反应的离子方程式
溶液与稀硫酸反应的离子方程式_______ 。
(2)该小组的同学关于如图的说法中正确的是_______ (填“序号”)。
①AB段溶液的导电能力不断减弱,说明生成的 不是电解质
不是电解质
②B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
③BC段溶液的导电能力不断增大,主要是由于过量的 ,电离出的离子导电
,电离出的离子导电
④a时刻 溶液与稀H2SO4恰好中和
溶液与稀H2SO4恰好中和
Ⅱ.配制250mL 1.0mol/L 溶液。
溶液。
(3)计算:需要用量筒量取18mol/L 溶液
溶液_______ mL。
(4)下列操作将导致所配制的 溶液浓度偏大有
溶液浓度偏大有_______ 。
a.移液过程有 溶液溅出瓶外
溶液溅出瓶外
b.将量取浓硫酸的量筒洗涤干净,洗涤液也转移到容量瓶中
c.定容时俯视容量瓶刻度线
d.加水超过刻度线,用胶头滴管吸出多余液体
(5)现有浓度为18mol/L的浓硫酸溶液200g,需要加入一定量的水将其稀释为9mol/L,则加入水的体积是_______ 。
A.大于200mL B.小于200mL C.等于200mL
 溶液中逐滴滴加稀
溶液中逐滴滴加稀 ,不断搅拌并测定溶液导电能力的变化(装置如图所示)。
,不断搅拌并测定溶液导电能力的变化(装置如图所示)。
I.实验测得混合溶液的导电能力随时间变化的曲线如图所示。

(1)写出
 溶液与稀硫酸反应的离子方程式
溶液与稀硫酸反应的离子方程式(2)该小组的同学关于如图的说法中正确的是
①AB段溶液的导电能力不断减弱,说明生成的
 不是电解质
不是电解质②B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
③BC段溶液的导电能力不断增大,主要是由于过量的
 ,电离出的离子导电
,电离出的离子导电④a时刻
 溶液与稀H2SO4恰好中和
溶液与稀H2SO4恰好中和Ⅱ.配制250mL 1.0mol/L
 溶液。
溶液。(3)计算:需要用量筒量取18mol/L
 溶液
溶液(4)下列操作将导致所配制的
 溶液浓度偏大有
溶液浓度偏大有a.移液过程有
 溶液溅出瓶外
溶液溅出瓶外b.将量取浓硫酸的量筒洗涤干净,洗涤液也转移到容量瓶中
c.定容时俯视容量瓶刻度线
d.加水超过刻度线,用胶头滴管吸出多余液体
(5)现有浓度为18mol/L的浓硫酸溶液200g,需要加入一定量的水将其稀释为9mol/L,则加入水的体积是
A.大于200mL B.小于200mL C.等于200mL
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有下列九种物质:①盐酸溶液 ②石墨 ③蔗糖 ④CO2⑤熔融NaHSO4⑥Ba(OH)2固体 ⑦氨水 ⑧纯硫酸 ⑨NaCl固体
(1)属于电解质的有__________ ;属于非电解质的有________ ;能导电的物质有________ 。
(2)②和SiO2在高温下可发生如下反应:3C+SiO2 SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是
SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______ ;氧化剂与还原剂物质的量之比为_______ 。
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为________________________
(4)⑤的电离方程式为______________________ 。
(1)属于电解质的有
(2)②和SiO2在高温下可发生如下反应:3C+SiO2
 SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是
SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为
(4)⑤的电离方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】将地球储量丰富的小分子电催化转化为有高附加值的 、
、 、
、 及
及 (如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
(如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
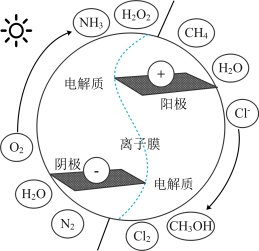
(1) 是一种绿色氧化剂,它的电子式为
是一种绿色氧化剂,它的电子式为___________ ;目前工业上采用蒽醌法生产 的原理为:
的原理为:
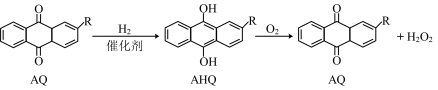 。
。
该总反应的原子利用率为___________ %;测定 的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为
的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为___________ 。
(2) 还原
还原 制取X(方程式中部分物质的化学计量数已略)可表示为
制取X(方程式中部分物质的化学计量数已略)可表示为
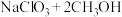


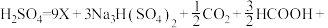

 ,则X为
,则X为___________ (填化学式)。
(3)电催化制取有高附加值物质的方法有很多。
①下列说法错误的是___________ (填标号)。
A. 及
及 电催化制
电催化制 时,
时, 在阴极区生成
在阴极区生成
B. 及
及 电催化制
电催化制 时,
时, 在阳极区生成
在阳极区生成
C.隔膜电解槽电解饱和食盐水制 时,用阴离子交换膜
时,用阴离子交换膜
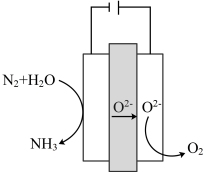
②一种合成氨的装置如图所示,阴极的电极反应式为___________ ,电解总反应为___________ 。
 、
、 、
、 及
及 (如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
(如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
(1)
 是一种绿色氧化剂,它的电子式为
是一种绿色氧化剂,它的电子式为 的原理为:
的原理为: 。
。该总反应的原子利用率为
 的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为
的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为(2)
 还原
还原 制取X(方程式中部分物质的化学计量数已略)可表示为
制取X(方程式中部分物质的化学计量数已略)可表示为
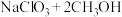


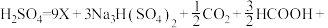

 ,则X为
,则X为(3)电催化制取有高附加值物质的方法有很多。
①下列说法错误的是
A.
 及
及 电催化制
电催化制 时,
时, 在阴极区生成
在阴极区生成B.
 及
及 电催化制
电催化制 时,
时, 在阳极区生成
在阳极区生成C.隔膜电解槽电解饱和食盐水制
 时,用阴离子交换膜
时,用阴离子交换膜②一种合成氨的装置如图所示,阴极的电极反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】SO2在生产、生活中具有重要的作用,据所学知识回答相关问题。
(1)SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有___ (填“酸性”“氧化性”“还原性”或“漂白性”,下同),SO2通入品红溶液中,品红溶液褪色,说明SO2具有___ 。
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为___ (填化学式,下同),氧化产物为___ 。
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①当该反应中有0.1mol电子转移时,则生成ZnS2O4___ g。
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为___ 。
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。

0~20min内,溶液pH几乎不变的原因是___ ,SO2吸收率在30min后迅速降低,其原因是___ 。
(1)SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①当该反应中有0.1mol电子转移时,则生成ZnS2O4
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。

0~20min内,溶液pH几乎不变的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
的一种制备方法如下图所示:

①加入 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为___________ ;生成的沉淀与硝酸反应,生成___________ 后可循环使用。
②通入 的过程中,若氧化产物只有一种,该氧化产物的化学式为
的过程中,若氧化产物只有一种,该氧化产物的化学式为___________ 。
(2)以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入稍过量的
溶液中加入稍过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的第一步反应的离子方程式为
的第一步反应的离子方程式为___________ ;第二步中 至少为
至少为___________ mol。
(3) 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是___________ 。(已知 在
在 溶液中可发生反应
溶液中可发生反应 )
)
(1)
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
①加入
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为②通入
 的过程中,若氧化产物只有一种,该氧化产物的化学式为
的过程中,若氧化产物只有一种,该氧化产物的化学式为(2)以
 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入稍过量的
溶液中加入稍过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的第一步反应的离子方程式为
的第一步反应的离子方程式为 至少为
至少为(3)
 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,该反应的离子方程式为
,该反应的离子方程式为 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是 在
在 溶液中可发生反应
溶液中可发生反应 )
)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.已知制备Cl2的方法可以为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用双线桥法表示该反应电子转移的方向和数目___________ 。
(2)反应中氧化剂是___________ ,氧化产物是___________ ,被氧化与未被氧化的的HCl质量之比为___________ ;
(3)HCl在上述反应中显示出来的性质是___________;
(4)若有112L(标准状况)Cl2生成,反应中转移电子的数目为___________ 。
Ⅱ.制取新型净水剂高铁酸钠( )原理为:
)原理为:
___________ ___________
___________ ___________ —___________
___________ —___________ ___________
___________ ___________(缺项处填
___________(缺项处填 、
、 或
或 )
)
(5)请配平该化学方程式___________ 。
Ⅲ.NaHCO3是生活中常见的物质,请回答下列问题:
(6)写出NaHCO3在水溶液中的电离方程式:___________ 。
(7)NaHCO3属于“酸”、“碱”、“盐”中的___________ 。
(8)写出NaHCO3溶液与NaOH溶液反应的离子方程式___________ 。
(9)Na2CO3固体中含有少量的NaHCO3杂质,除去杂质发生反应的化学方程式为___________ 。
(1)用双线桥法表示该反应电子转移的方向和数目
(2)反应中氧化剂是
(3)HCl在上述反应中显示出来的性质是___________;
| A.氧化性 | B.还原性 | C.酸性 | D.挥发性 |
Ⅱ.制取新型净水剂高铁酸钠(
 )原理为:
)原理为:___________
 ___________
___________ ___________ —___________
___________ —___________ ___________
___________ ___________(缺项处填
___________(缺项处填 、
、 或
或 )
)(5)请配平该化学方程式
Ⅲ.NaHCO3是生活中常见的物质,请回答下列问题:
(6)写出NaHCO3在水溶液中的电离方程式:
(7)NaHCO3属于“酸”、“碱”、“盐”中的
(8)写出NaHCO3溶液与NaOH溶液反应的离子方程式
(9)Na2CO3固体中含有少量的NaHCO3杂质,除去杂质发生反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】粉煤灰(主要含有 SiO2、Fe2O3、Al2O3 等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有 很大的价值。
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式_____ 。
②初步分离得到的滤渣主要成分是_____ 。
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因____ 。
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为_____ 。
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是______________ ,选择该范围的理由是___________________ 。

Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____ 。
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。____________ ,___________
4NH4Al(SO4)2 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑

Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式
②初步分离得到的滤渣主要成分是
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是

Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。
4NH4Al(SO4)2
 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】按要求填空:
(1)实验室检验亚铁盐溶液中阳离子的方法_______ 。
(2)列举Al2O3一种用途_______ 。
(3)书写工业制硝酸流程中,氨催化氧化的化学方程式_______ 。
(1)实验室检验亚铁盐溶液中阳离子的方法
(2)列举Al2O3一种用途
(3)书写工业制硝酸流程中,氨催化氧化的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】I.实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2 + 2KCl + 5Cl2↑ + 8H2O,请回答以下问题:
(1)上述化学反应方程式改写为离子方程式___________
(2)该反应中氧化剂为___________ (填化学式)。起酸作用的HCl与起还原作用的HCl的质量之比___________
(3)已知在碱性溶液中可发生如下反应2R(OH)3+3ClO-+4OH-=2RO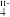 +3Cl-+5H2O,则RO
+3Cl-+5H2O,则RO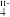 中R的化合价是___________
中R的化合价是___________
II.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)

(4)①②③所涉及的操作方法中,包含过滤的是___________ (填序号)
(5)根据上图,写出①中发生反应的化学方程式______
(6)煅烧NaHCO3固体的化学方程式是______
(1)上述化学反应方程式改写为离子方程式
(2)该反应中氧化剂为
(3)已知在碱性溶液中可发生如下反应2R(OH)3+3ClO-+4OH-=2RO
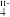 +3Cl-+5H2O,则RO
+3Cl-+5H2O,则RO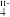 中R的化合价是___________
中R的化合价是___________| A.+3 | B.+4 | C.+5 | D.+6 |
II.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)

(4)①②③所涉及的操作方法中,包含过滤的是
(5)根据上图,写出①中发生反应的化学方程式
(6)煅烧NaHCO3固体的化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】环己酮可作为涂料和油漆的溶剂。在实验室中以环己醇为原料制备环己酮。
回答下列问题:
(1)环己酮的提纯过程为:
①在馏分中加NaCl固体至饱和,静置,分液;加NaCl的目的是_______ 。
②加入无水MgSO4块状固体;目的是_______ 。
③_______ (填操作名称)后进行蒸馏,收集150~155℃的馏分。

| 物质 | 沸(熔)点/(℃,1atm) | 密度/(g/cm3) | 溶解性 |
| 环己醇 | 161.1(-21) | 0.96 | 能溶于水,易溶于常见有机溶剂 |
| 环己酮 | 155.6(-47) | 0.94 | 微溶于水 |
| 醋酸 | 118(16.6) | 1.05 | 易溶于水 |
(1)环己酮的提纯过程为:
①在馏分中加NaCl固体至饱和,静置,分液;加NaCl的目的是
②加入无水MgSO4块状固体;目的是
③
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】工业上从海水中提取单质溴,其中有一种工艺采用如下方法:
(1)向海水中通入氯气将海水中的溴化物氧化,其离子方程式为:________ 。
(2)向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,这时,溴就转化成溴离子和溴酸根离子,其化学方程式为:____________ ;通入空气吹出Br2,并用Na2CO3吸收的目的是_________________ 。
(3)将(2)所得溶液用H2SO4酸化,又可得到单质溴,再用有机溶液萃取溴后,还可以得到副产品Na2SO4。 这一过程可用化学方程式表示为:___________ 。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中加入________ (填字母)。
a.CCl4 b.NaBr溶液 c.NaOH溶液 d.Na2SO3溶液
(1)向海水中通入氯气将海水中的溴化物氧化,其离子方程式为:
(2)向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,这时,溴就转化成溴离子和溴酸根离子,其化学方程式为:
(3)将(2)所得溶液用H2SO4酸化,又可得到单质溴,再用有机溶液萃取溴后,还可以得到副产品Na2SO4。 这一过程可用化学方程式表示为:
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中加入
a.CCl4 b.NaBr溶液 c.NaOH溶液 d.Na2SO3溶液
您最近一年使用:0次



