按要求回答下列问题。
(1)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______ mL 2 mol·L-1的盐酸(忽略加入盐酸体积)。
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=_______ 。
(4)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中 c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为_______ 。
(1)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略
 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=(4)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中 c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为
2022高三·全国·专题练习 查看更多[1]
(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)
更新时间:2022-09-28 14:12:51
|
相似题推荐
计算题
|
较难
(0.4)
解题方法
【推荐1】我国某地粉煤灰中主要含有Al2O3,除此之外还含有Ga2O3及少量Fe2O3、CaO、MgO和SiO2等物质。已知从粉煤灰中回收铝并提取镓的工艺流程如下所示:
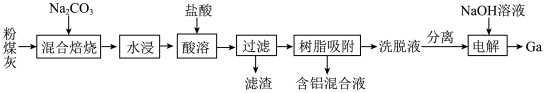
洗脱液中往往还有少量Fe3+,需要进一步分离。若使Fe3+恰好完全沉淀[c(Fe3+)=1×10-5mol/L]时,Ga3+浓度至少为___________ mol/L才会开始沉淀。(已知:Ksp[Ga(OH)3]=1.4×10-34,Ksp[Fe(OH)3]=4.0×10-38)

洗脱液中往往还有少量Fe3+,需要进一步分离。若使Fe3+恰好完全沉淀[c(Fe3+)=1×10-5mol/L]时,Ga3+浓度至少为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】(1) 25 ℃时,H2S的电离平衡常数Ka1=1.3×10-7、Ka2=7.0×10-15。用NaOH溶液吸收H2S气体得到pH=10的Na2S溶液,在此过程中水的电离程度将______ (填“增大”“减小”或“不变”);此时溶液中 =
=______ 。
(2)已知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=1.3×10-33,当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______ 。
(3)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:
Ⅰ.CuCl(s) Cu+(aq)+Cl-(aq) Ksp=1.4×10-6
Cu+(aq)+Cl-(aq) Ksp=1.4×10-6
Ⅱ.CuCl(s)+Cl-(aq) CuCl
CuCl (aq) K=0.35
(aq) K=0.35
请写出c(Cu+)与c(CuCl )的数学关系为
)的数学关系为______ 。
 =
=(2)已知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=1.3×10-33,当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为
(3)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl
 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:Ⅰ.CuCl(s)
 Cu+(aq)+Cl-(aq) Ksp=1.4×10-6
Cu+(aq)+Cl-(aq) Ksp=1.4×10-6Ⅱ.CuCl(s)+Cl-(aq)
 CuCl
CuCl (aq) K=0.35
(aq) K=0.35请写出c(Cu+)与c(CuCl
 )的数学关系为
)的数学关系为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】与K相关的计算:已知 时,
时,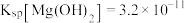 ,
,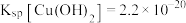 。
。
(1) 时,
时, 的溶解度为
的溶解度为_______ 。
(2)向 溶液中加入
溶液中加入 固体,要生成
固体,要生成 沉淀,溶液中
沉淀,溶液中 最小为
最小为_______ 。
(3)向浓度均为 和
和 混合液中逐滴加入
混合液中逐滴加入 溶液,先生成
溶液,先生成_______ 沉淀,当两种沉淀共存时,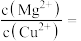
_______ 。
(4) +的水解平衡常数为
+的水解平衡常数为_______ 。
(5) ,已知
,已知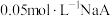 溶液
溶液 ,则
,则 的
的
_______ (近似值)。
(6) 时,向
时,向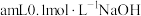 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液
溶液 ,混合溶液恰好呈中性(体积变化忽略不计),已知
,混合溶液恰好呈中性(体积变化忽略不计),已知 的
的 ,
,
_______ 。
 时,
时,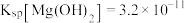 ,
,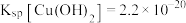 。
。(1)
 时,
时, 的溶解度为
的溶解度为(2)向
 溶液中加入
溶液中加入 固体,要生成
固体,要生成 沉淀,溶液中
沉淀,溶液中 最小为
最小为(3)向浓度均为
 和
和 混合液中逐滴加入
混合液中逐滴加入 溶液,先生成
溶液,先生成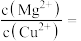
(4)
 +的水解平衡常数为
+的水解平衡常数为(5)
 ,已知
,已知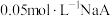 溶液
溶液 ,则
,则 的
的
(6)
 时,向
时,向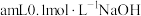 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液
溶液 ,混合溶液恰好呈中性(体积变化忽略不计),已知
,混合溶液恰好呈中性(体积变化忽略不计),已知 的
的 ,
,
您最近一年使用:0次



