已知氟、氯、溴、碘在元素周期表中位于同一纵行,都是典型的非金属元素,都能与大多数金属化合生成盐,故统称为卤素。卤素单质都具有氧化性,其氧化性强弱顺序是F2>Cl2>Br2>I2,它们都能与H2、H2O等反应。
(1)若用X2表示卤素单质,则X2与H2化合的化学方程式是_______ ,其反应条件难易规律是_______ 。
(2)氧化性强的卤素单质(如Cl2)能把氧化性弱的卤素从其卤化物(如NaBr或KI)中置换出来。请写出将氯气通入碘化钾溶液中的化学方程式________ 。
(3)已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
①氯化铝是_______ 。(填“离子化合物”或“共价化合物”)
②在500 K和1.01×105 Pa时,它的蒸气密度(换算为标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态时的化学式为_______ 。
③设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是_______ 。
(1)若用X2表示卤素单质,则X2与H2化合的化学方程式是
(2)氧化性强的卤素单质(如Cl2)能把氧化性弱的卤素从其卤化物(如NaBr或KI)中置换出来。请写出将氯气通入碘化钾溶液中的化学方程式
(3)已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
①氯化铝是
②在500 K和1.01×105 Pa时,它的蒸气密度(换算为标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态时的化学式为
③设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是
更新时间:2022-09-24 22:30:39
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:
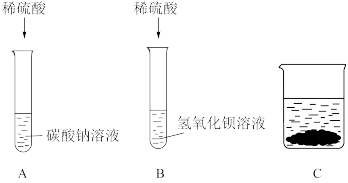
(1)B试管中发生反应的离子方程式为___________ 。
(2)【实验一】A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;

据此判断B试管中反应后所得溶液中的溶质是____ (填化学式)。
(3)【实验二】将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到____ 的实验现象,进而证明滤渣为混合物;
(4)【猜想与假设】实验二C烧杯的滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二:Na+、H+、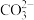
猜想三:Na+、OH-、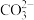
猜想四:Na+、OH-、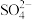
猜想五:___________ (写出一种即可);
小组同学一致认为猜想___________ 不正确,理由是___________ 。
(5)【实验探究】为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到___________ 的实验现象,最终证明了溶液的溶质成分为Na+、Ba2+、OH-。向Ba(OH)2溶液中滴加稀H2SO4反应至过量,导电能力随时间变化的曲线图为___________ 。
A.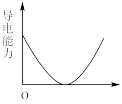 B.
B. C.
C.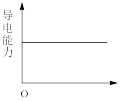 D.
D.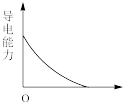
若将稀硫酸改为等浓度的Na2SO4溶液,测得的溶液的导电性曲线是否与上述曲线相同___________ 。(填“是”或“否”)

(1)B试管中发生反应的离子方程式为
(2)【实验一】A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;

据此判断B试管中反应后所得溶液中的溶质是
(3)【实验二】将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到
(4)【猜想与假设】实验二C烧杯的滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二:Na+、H+、
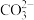
猜想三:Na+、OH-、
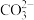
猜想四:Na+、OH-、
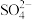
猜想五:
小组同学一致认为猜想
(5)【实验探究】为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到
A.
 B.
B. C.
C. D.
D.
若将稀硫酸改为等浓度的Na2SO4溶液,测得的溶液的导电性曲线是否与上述曲线相同
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:


(1) B试管中发生反应的离子方程式为_________________ 。
(2) [实验一] A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;
据此判断B试管中反应后所得溶液中的溶质是_____________ (填化学式) ;
(3) [ 实验二]将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到________ 的实验现象,进而证明滤渣为混合物;
(4) [猜想与假设] C烧杯滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二: Na+、H+、 CO
猜想三:Na+、 OH-、CO
猜想四:Na+、 OH-、SO
猜想五:①_________________ (写出一种即可) ;
②小组同学一致认为猜想_________ 不正确,理由是______________ 。
(5) [实验探究] 为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到______ 的实验现象,最终证明了溶液的溶质成分。
(6)向Ba(OH)2溶液中滴加稀H2SO4反应至过量,导电能力随时间变化的曲线图为______ 。
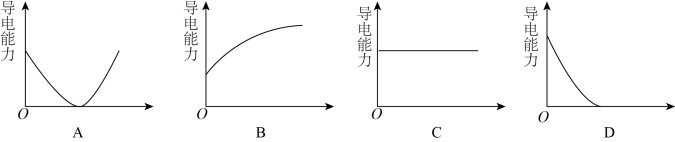
若将稀硫酸改为等浓度的Na2SO4溶液,测得的溶液的导电性曲线是否与上述曲线相同。并说明理由_______________________ 。


(1) B试管中发生反应的离子方程式为
(2) [实验一] A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;
据此判断B试管中反应后所得溶液中的溶质是
(3) [ 实验二]将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到
(4) [猜想与假设] C烧杯滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二: Na+、H+、 CO

猜想三:Na+、 OH-、CO

猜想四:Na+、 OH-、SO

猜想五:①
②小组同学一致认为猜想
(5) [实验探究] 为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到
(6)向Ba(OH)2溶液中滴加稀H2SO4反应至过量,导电能力随时间变化的曲线图为

若将稀硫酸改为等浓度的Na2SO4溶液,测得的溶液的导电性曲线是否与上述曲线相同。并说明理由
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学实验小组探究学习钠盐相关内容。
Ⅰ.实验室研究氯化钠的性质及制备
(1)下图表示 在水中溶解过程的微观状态示意图。
在水中溶解过程的微观状态示意图。
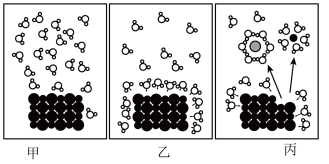
下列说法中,不正确的是______________ 。
a.干燥的 固体不导电,是由于其中不存在
固体不导电,是由于其中不存在 和
和
b.由上图可知,水分子在形成自由移动的 和
和 中起到了至关重要的作用
中起到了至关重要的作用
c. 溶液能导电,是由于在电流作用下,其可解离出自由移动的
溶液能导电,是由于在电流作用下,其可解离出自由移动的 和
和
d.加热至熔融状态的 也可以解离出自由移动的
也可以解离出自由移动的 和
和
(2)电解熔融 可制得单质钠,钠与水反应的化学方程式为
可制得单质钠,钠与水反应的化学方程式为____________________________________ 。
Ⅱ.工业生产中氯化钠的制备
我国食盐的来源主要为海盐、湖盐、井矿盐。粗食盐中除了含泥沙等难溶性杂质外,还含有 、
、 ,
, 等可溶性杂质。为得到精制食盐水,某同学设计如下除杂流程,用到的试剂有:
等可溶性杂质。为得到精制食盐水,某同学设计如下除杂流程,用到的试剂有: 溶液、
溶液、 溶液、
溶液、 溶液和盐酸。
溶液和盐酸。
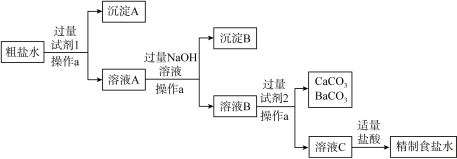
(3)操作 的名称是
的名称是_______________ ,试剂2是_______________ 。
(4)溶液 中除
中除 和
和 外,还存在的离子有
外,还存在的离子有_______________ 。
(5)沉淀 主要成分的化学式是
主要成分的化学式是________________ 。
(6)用离子方程式表示盐酸的作用_______________ 、_______________ 。
Ⅲ.探究碳酸氢钠的性质
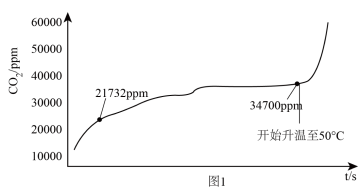
(7)探究实验1:在锥形瓶内装入饱和 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 的分压,测得
的分压,测得 的分压与温度的变化如图1所示。温度在50℃之前,
的分压与温度的变化如图1所示。温度在50℃之前, 的分压增大的主要原因是
的分压增大的主要原因是________________________ :温度升高到50℃之后, 的分压急剧增大的原因是
的分压急剧增大的原因是____________________________________ 。
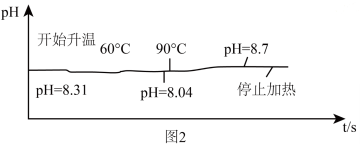
(8)探究实验2:将 为8.31的
为8.31的 溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液
溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液 变化与加热时间的关系如图2所示,冷却至室温,测得溶液
变化与加热时间的关系如图2所示,冷却至室温,测得溶液 为8.86。根据溶液
为8.86。根据溶液 的变化,请用文字描述加热过程中的溶液的颜色变化
的变化,请用文字描述加热过程中的溶液的颜色变化______________________________________________ 。
Ⅰ.实验室研究氯化钠的性质及制备
(1)下图表示
 在水中溶解过程的微观状态示意图。
在水中溶解过程的微观状态示意图。
下列说法中,不正确的是
a.干燥的
 固体不导电,是由于其中不存在
固体不导电,是由于其中不存在 和
和
b.由上图可知,水分子在形成自由移动的
 和
和 中起到了至关重要的作用
中起到了至关重要的作用c.
 溶液能导电,是由于在电流作用下,其可解离出自由移动的
溶液能导电,是由于在电流作用下,其可解离出自由移动的 和
和
d.加热至熔融状态的
 也可以解离出自由移动的
也可以解离出自由移动的 和
和
(2)电解熔融
 可制得单质钠,钠与水反应的化学方程式为
可制得单质钠,钠与水反应的化学方程式为Ⅱ.工业生产中氯化钠的制备
我国食盐的来源主要为海盐、湖盐、井矿盐。粗食盐中除了含泥沙等难溶性杂质外,还含有
 、
、 ,
, 等可溶性杂质。为得到精制食盐水,某同学设计如下除杂流程,用到的试剂有:
等可溶性杂质。为得到精制食盐水,某同学设计如下除杂流程,用到的试剂有: 溶液、
溶液、 溶液、
溶液、 溶液和盐酸。
溶液和盐酸。
(3)操作
 的名称是
的名称是(4)溶液
 中除
中除 和
和 外,还存在的离子有
外,还存在的离子有(5)沉淀
 主要成分的化学式是
主要成分的化学式是(6)用离子方程式表示盐酸的作用
Ⅲ.探究碳酸氢钠的性质
(7)探究实验1:在锥形瓶内装入饱和
 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 的分压,测得
的分压,测得 的分压与温度的变化如图1所示。温度在50℃之前,
的分压与温度的变化如图1所示。温度在50℃之前, 的分压增大的主要原因是
的分压增大的主要原因是 的分压急剧增大的原因是
的分压急剧增大的原因是
(8)探究实验2:将
 为8.31的
为8.31的 溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液
溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液 变化与加热时间的关系如图2所示,冷却至室温,测得溶液
变化与加热时间的关系如图2所示,冷却至室温,测得溶液 为8.86。根据溶液
为8.86。根据溶液 的变化,请用文字描述加热过程中的溶液的颜色变化
的变化,请用文字描述加热过程中的溶液的颜色变化
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室用如下装置制取氯气,并进行性质实验。回答下列问题;
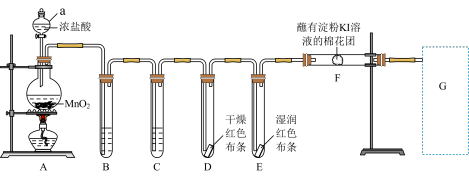
(1)写出A中反应的离子方程式_______ ;该反应体现了浓盐酸的性质是_______ 。
(2)能证明氯气无漂白性的现象是_______ 。
(3)F处观察到棉花团变蓝色,说明氯气具有_______ 性(填“氧化”或“还原”)。
(4)补齐G处装置及试剂_______ 。
(5)实验室还可用KMnO4固体与浓盐酸常温下反应制备氯气; (未配平)。请写出该反应配平后的离子方程式:
(未配平)。请写出该反应配平后的离子方程式:_______ 。若生成等量的Cl2,所需MnO2与KMnO4的物质的量之比为_______ 。

(1)写出A中反应的离子方程式
(2)能证明氯气无漂白性的现象是
(3)F处观察到棉花团变蓝色,说明氯气具有
(4)补齐G处装置及试剂
(5)实验室还可用KMnO4固体与浓盐酸常温下反应制备氯气;
 (未配平)。请写出该反应配平后的离子方程式:
(未配平)。请写出该反应配平后的离子方程式:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酸钠(NaNO2)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是____ ,装置乙的作用是____ 。
(2)甲中滴入稀硝酸前需先通入N2,原因是____ 。
(3)甲装置中发生反应的离子方程式为____ 。
(4)反应过程中观察到丙中的现象为___ 。
(5)丁中酸性KMnO4的作用是____ 。
(6)设计实验证明丙装置有NaNO2生成____ (写出操作、试剂和现象)。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是
(2)甲中滴入稀硝酸前需先通入N2,原因是
(3)甲装置中发生反应的离子方程式为
(4)反应过程中观察到丙中的现象为
(5)丁中酸性KMnO4的作用是
(6)设计实验证明丙装置有NaNO2生成
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】氯是一种典型的非金属元素,具有多种化合价,可以形成食盐、漂白粉等多种含氯化合物。从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。以下是氯元素的“价类二维图”的部分信息。
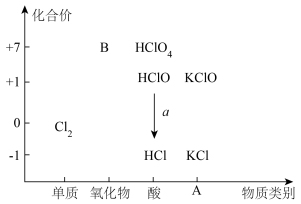
请回答下列问题:
(1)缺失的类别A为___________ ,物质B为___________ (填化学式),能够实现图中a转化的反应方程式为___________ (写一个即可)
(2)已知: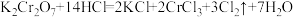 ,按要求完成下列问题。
,按要求完成下列问题。
①用双线桥标明电子转移方向和数目:___________ 。
②该反应中,氧化剂是___________ ,还原剂是___________ ,还原性
___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
③ 完全反应,产生的
完全反应,产生的 在标准状况下的体积为
在标准状况下的体积为___________ L,
(3)写出 在强碱性介质中与
在强碱性介质中与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。

请回答下列问题:
(1)缺失的类别A为
(2)已知:
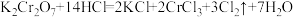 ,按要求完成下列问题。
,按要求完成下列问题。①用双线桥标明电子转移方向和数目:
②该反应中,氧化剂是

 (填“大于”或“小于”)。
(填“大于”或“小于”)。③
 完全反应,产生的
完全反应,产生的 在标准状况下的体积为
在标准状况下的体积为(3)写出
 在强碱性介质中与
在强碱性介质中与 反应生成
反应生成 的离子方程式为
的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
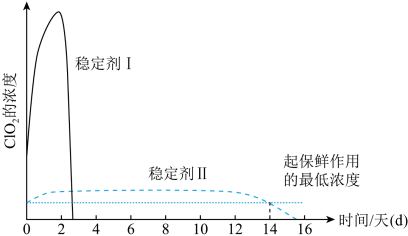
【推荐1】二氧化氯常温下为黄绿色气体,在30℃时分解,50℃时发生爆炸性分解,与Cl2的氧化性相近。在生活中被广泛应用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。_______ 。
(2)ClO2的吸收:关闭活塞B,向D中缓慢加入稀盐酸,ClO2在D中被稳定剂完全吸收生成NaClO2,在该反应过程中装置A、D均应控制反应温度低于30C,理由是_______ 。
(3)ClO2的释放:在酸性条件下NaClO2发生反应: ,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为
,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为_______ ,在ClO2释放实验中,打开活塞E,D中发生反应,说明有ClO2释放的实验现象是_______ 。
(4)ClO2的应用:己吸收ClO2气体的稳定剂I和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化情况如图所示,若将其用于水果保鲜,稳定剂Ⅱ优于稳定剂I,若稳定剂Ⅱ中ClO2气体的起始浓度为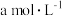 ,如图所示剩余
,如图所示剩余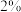 时便失去保鲜作用,则该稳定剂的平均失效速率为
时便失去保鲜作用,则该稳定剂的平均失效速率为_______ 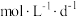 。
。
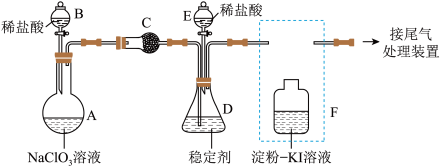
(2)ClO2的吸收:关闭活塞B,向D中缓慢加入稀盐酸,ClO2在D中被稳定剂完全吸收生成NaClO2,在该反应过程中装置A、D均应控制反应温度低于30C,理由是
(3)ClO2的释放:在酸性条件下NaClO2发生反应:
 ,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为
,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为(4)ClO2的应用:己吸收ClO2气体的稳定剂I和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化情况如图所示,若将其用于水果保鲜,稳定剂Ⅱ优于稳定剂I,若稳定剂Ⅱ中ClO2气体的起始浓度为
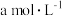 ,如图所示剩余
,如图所示剩余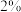 时便失去保鲜作用,则该稳定剂的平均失效速率为
时便失去保鲜作用,则该稳定剂的平均失效速率为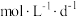 。
。
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有关物质的转化关系如下图所示。A 是生活中一种常见的调味品,B 是最常见的无色液体,X、Y是两种常见的金属单质。D、E、F为气体,且 E为黄绿色,F能使品红溶液褪色,E 与 F 以等物质的量反应。请回答下列问题:
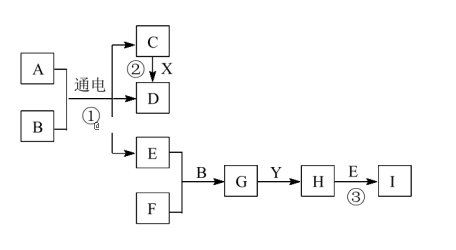
(1)F的化学式是________ 。溶液 G 中含有的主要离子为_____________ (用离子符号表示)。
(2)反应②的化学方程式为___________________ 。
(3)反应③的离子方程式为________________________________ 。
(4)请补充完整检验H中阳离子的实验方案:取少量H中的溶液于试管中,_____________

(1)F的化学式是
(2)反应②的化学方程式为
(3)反应③的离子方程式为
(4)请补充完整检验H中阳离子的实验方案:取少量H中的溶液于试管中,
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是_____ ,实验室制氯气,常用MnO2做氧化剂制得,写出其化学方程式:_____ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是_____ (填字母编号)。
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_____ ,该现象_____ (填“能”或“不能”)说明溴单质的氧化性强于碘。

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为6,D是同周期中简单离子半径最小的元素。
(1)五种元素中,E在元素周期表中的位置是______ ,画出C的原子结构示意图:________ 。
(2)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为_____ 。
(3)C的最高价氧化物对应的水化物与D的最高价氧化物反应的化学方程式为__________________ 。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示的转化关系:
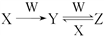
①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程式为______ ;若W是强碱,且Y是白色难溶固体,则反应Y →Z的离子方程式为__________________ 。
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为_____________________ 。
(1)五种元素中,E在元素周期表中的位置是
(2)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为
(3)C的最高价氧化物对应的水化物与D的最高价氧化物反应的化学方程式为
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示的转化关系:
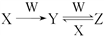
①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程式为
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A的原子半径最小,B的最外层电子数是次外层的3倍;B、E同主族,B、C的最外层电子数之和与F的最外层电子数相等,D是地壳中含量最多的金属元素。回答下列问题:
(1)E在元素周期表中的位置是_______
(2)B、C、D三种元素中,形成的简单离子的半径由小到大的顺序是_______ (填离子符号 )
(3)C、D、E、F形成的最高价氧化物对应的水化物中:
①酸性最强的是_______ (用化学式 填写)。
②D单质能与C的最高价氧化物的水化物溶液反应,其反应的离子方程式是:_______ 。
③Cu单质与E的最高价氧化物的水化物溶液反应,其反应的化学方程式是:_______ 。
(4)写出下列物质的电子式C2B2_______
(5)下列事实能说明F元素的非金属性比E元素的非金属性强的是_______ (填序号 )
①最高价氧化物对应水化物的酸性:F>E
②F原子得到电子的数目比E原子少
③F元素的最高正价比E元素的最高正价要高
④元素的简单气态氢化物的稳定性:F>E
⑤气态氢化物溶于水后的酸性:F>E
(1)E在元素周期表中的位置是
(2)B、C、D三种元素中,形成的简单离子的半径由小到大的顺序是
(3)C、D、E、F形成的最高价氧化物对应的水化物中:
①酸性最强的是
②D单质能与C的最高价氧化物的水化物溶液反应,其反应的离子方程式是:
③Cu单质与E的最高价氧化物的水化物溶液反应,其反应的化学方程式是:
(4)写出下列物质的电子式C2B2
(5)下列事实能说明F元素的非金属性比E元素的非金属性强的是
①最高价氧化物对应水化物的酸性:F>E
②F原子得到电子的数目比E原子少
③F元素的最高正价比E元素的最高正价要高
④元素的简单气态氢化物的稳定性:F>E
⑤气态氢化物溶于水后的酸性:F>E
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】如图为元素周期表的一部分,图中所列字母分别代表一种化学元素。

(1)元素b、c、e形成的常见稳定单质中最易与H2化合的是___________ (填化学式)。
(2)元素d、c所形成的某化合物的摩尔质量为78g/mol,该化合物的化学式为___________ ,其中所含化学键的类型有___________ 。
(3)推测原子序数为35的元素在元素周期表中的位置是___________ 。
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是___________(填字母)。
(5)含有非极性键的c的氢化物,其电子式为___________ 。(ab)2称为拟卤素,性质与卤素单质相似,常温下其与NaOH溶液反应的化学方程式为___________ 。

(1)元素b、c、e形成的常见稳定单质中最易与H2化合的是
(2)元素d、c所形成的某化合物的摩尔质量为78g/mol,该化合物的化学式为
(3)推测原子序数为35的元素在元素周期表中的位置是
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是___________(填字母)。
| A.f的单质常温下呈气态 | B.f的单质具有强氧化性 |
| C.fc2属于酸性氧化物 | D.fc2既有氧化性又有还原性 |
您最近半年使用:0次



