按要求填空
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
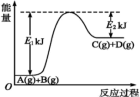
①该反应是_______ (填“吸热”或“放热”)反应,反应的ΔH=_______ kJ· mol-1(用含E1、E2的代数式表示)。
②该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.
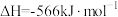
Ⅲ.
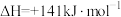
①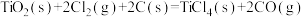 的
的
_______ 。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

①该反应是
②该反应过程中,断裂旧化学键吸收的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.


Ⅱ.

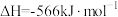
Ⅲ.

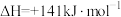
①
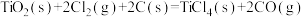 的
的
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
更新时间:2022-09-18 20:48:08
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:
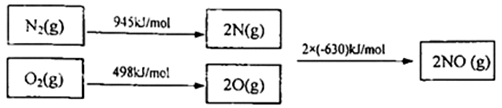
则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________ 。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g) N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
①0~2 s 内用N2表示的化学反应速率为______ 该温度下,反应的平衡常数K1________ 。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___ K2 (填“>”、“<”或“=”),原因是____________________ 。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
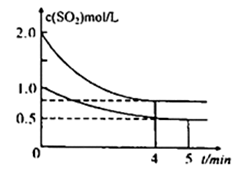
下列说法正确的是_________ (填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。
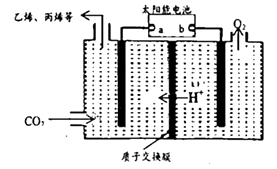
①该工艺中能量转化方式主要有___________________ 。
②电解时,生成乙烯的电极反应式是__________________________ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)
 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
下列说法正确的是
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有
②电解时,生成乙烯的电极反应式是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】 减排和转化利用以及化学电池的发展都是目前研究的重要方向。
减排和转化利用以及化学电池的发展都是目前研究的重要方向。
(1)CO在炼铁高炉中与 存在以下反应:
存在以下反应:
I.

II.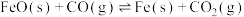

III.

①
___________ 
②1500℃时,反应III的平衡常数 。该温度下,在某体积可变的密闭容器中,按物质的量之比3:4加入
。该温度下,在某体积可变的密闭容器中,按物质的量之比3:4加入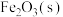 和
和 发生反应III,平衡时
发生反应III,平衡时 的转化率为
的转化率为___________ (保留三位有效数字)。
(2)二氧化氮-空气燃料电池的工作原理示意图如图所示,a极为___________ (填“正极”或“负极”),b极的电极反应式为___________ 。若放电过程中消耗标准状况下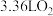 ,则生成
,则生成 的质量为
的质量为___________ g。

(3)下图为相互串联的甲、乙两电解池。

铁极为___________ (填“阳极”或“阴极”)。常温下,若电解一段时间后甲池的阴极增重12.8g,假设乙池中溶液体积不变且产生的气体全部逸出,则电解后乙池溶液的pH为___________ 。
 减排和转化利用以及化学电池的发展都是目前研究的重要方向。
减排和转化利用以及化学电池的发展都是目前研究的重要方向。(1)CO在炼铁高炉中与
 存在以下反应:
存在以下反应:I.


II.
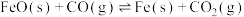

III.


①


②1500℃时,反应III的平衡常数
 。该温度下,在某体积可变的密闭容器中,按物质的量之比3:4加入
。该温度下,在某体积可变的密闭容器中,按物质的量之比3:4加入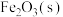 和
和 发生反应III,平衡时
发生反应III,平衡时 的转化率为
的转化率为(2)二氧化氮-空气燃料电池的工作原理示意图如图所示,a极为
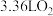 ,则生成
,则生成 的质量为
的质量为
(3)下图为相互串联的甲、乙两电解池。

铁极为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】I.完成下列问题。
(1)在25°C,101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧热的热化学方程式为_______ 。
(2)已知在一定温度下:
C(s)+CO2(g) 2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K2
CO(g)+H2(g) 平衡常数K2
CO(g)+ H2O(g) H2(g)+ CO2(g) 平衡常数K3
H2(g)+ CO2(g) 平衡常数K3
则K1、 K2、K3之间的关系是_______ 。
II.甲醇的合成
(3)已知:CO(g)+ O2(g)= CO2(g) ΔH1=-283 kJ/mol
O2(g)= CO2(g) ΔH1=-283 kJ/mol
H2(g)+ O2(g)= H2O(g) ΔH2= -242 kJ/mol
O2(g)= H2O(g) ΔH2= -242 kJ/mol
CH3OH(g)+ O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol
O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g)+ 2H2(g)= CH3OH(g)。该反应的ΔH为_______ kJ/mol。
III.某化学兴趣小组要完成中和反应反应热的测定实验。
(4)实验桌上备有量热计(含保温装置和温度计)、胶头滴管、0.5mol·L-1盐酸、0.55mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是_______ 。
(5)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·C-1 ·kg-1,各物质的密度均为1g·cm-3。根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:_______ 。
(1)在25°C,101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧热的热化学方程式为
(2)已知在一定温度下:
C(s)+CO2(g)
 2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K2
CO(g)+H2(g) 平衡常数K2CO(g)+ H2O(g)
 H2(g)+ CO2(g) 平衡常数K3
H2(g)+ CO2(g) 平衡常数K3则K1、 K2、K3之间的关系是
II.甲醇的合成
(3)已知:CO(g)+
 O2(g)= CO2(g) ΔH1=-283 kJ/mol
O2(g)= CO2(g) ΔH1=-283 kJ/molH2(g)+
 O2(g)= H2O(g) ΔH2= -242 kJ/mol
O2(g)= H2O(g) ΔH2= -242 kJ/molCH3OH(g)+
 O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol
O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol以CO(g)和H2(g)为原料合成甲醇的反应为CO(g)+ 2H2(g)= CH3OH(g)。该反应的ΔH为
III.某化学兴趣小组要完成中和反应反应热的测定实验。
(4)实验桌上备有量热计(含保温装置和温度计)、胶头滴管、0.5mol·L-1盐酸、0.55mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是
(5)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 生成1mol H2O放出的热量 | |||
| t1 | t2 | ||||
| a | 50mL 0.55mol·L-1NaOH溶液 | 50mL 0.5mol·L-1 HCl溶液 | 20°C | 23.3°C | |
| b | 50mL 0.55mol·L-1NaOH溶液 | 50mL 0.5mol·L-1 HCl溶液 | 20°C | 23.5°C | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·C-1 ·kg-1,各物质的密度均为1g·cm-3。根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______ 。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
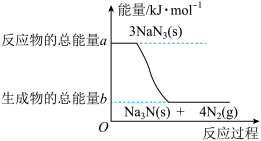
①叠氮化钠的爆炸反应属于_______ (填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学键),则反应的能量变化为____ kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________ g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________ mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________ 。
请回答下列问题:
(1)下列判断正确的是
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:

①叠氮化钠的爆炸反应属于
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学键),则反应的能量变化为
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】 既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
(1)下图为甲烷在镍基催化剂作用下发生裂解反应的能量变化图。

图中各过程属于放热过程的是___________ (填编号);下列各组物质间的反应属于放热反应的是___________ (填序号)。
A.氢氧化钡晶体、氯化债 B.灼热的炭与二氧化碳
C.碳酸氢钠与盐酸 D.镁条、盐酸
(2)一定条件下,工业上合成甲烷的反应为 。将2molCO和10mol
。将2molCO和10mol 充入到体积为2L的恒容密闭容器中发生反应。下图为CO和
充入到体积为2L的恒容密闭容器中发生反应。下图为CO和 的转化率与时间的关系。
的转化率与时间的关系。

则0-6min内,CO的平均反应速率为___________ ,6min时, 的转化率为
的转化率为___________ 。
 既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:(1)下图为甲烷在镍基催化剂作用下发生裂解反应的能量变化图。

图中各过程属于放热过程的是
A.氢氧化钡晶体、氯化债 B.灼热的炭与二氧化碳
C.碳酸氢钠与盐酸 D.镁条、盐酸
(2)一定条件下,工业上合成甲烷的反应为
 。将2molCO和10mol
。将2molCO和10mol 充入到体积为2L的恒容密闭容器中发生反应。下图为CO和
充入到体积为2L的恒容密闭容器中发生反应。下图为CO和 的转化率与时间的关系。
的转化率与时间的关系。
则0-6min内,CO的平均反应速率为
 的转化率为
的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求完成下列各空。
(1)已知数据如图,写出工业合成氨的热化学方程式:___________ 。

(2)0.5 mol甲烷与一定量水蒸气在一定条件下,完全反应生成一氧化碳和氢气,吸热a kJ,则反应物总能量___________ (填“ ”、“
”、“ ”或“=”)生成物总能量。
”或“=”)生成物总能量。
(3)使Cl2和H2O(g)通过灼热炭层,生成气态HCl和CO2,当反应中转移1mol电子时释放145kJ热量。当有1molCO2生成时,ΔH =___________ kJ/mol。
(4)反应mA(g)+nB(g) = pC(g) +qD(g)过程中的能量变化如图所示:

①该反应ΔH =___________ kJ/mol(用含E1、E2式子表示)。
②在反应体系中加入催化剂,ΔH___________ (填“增大”、“减小”、“不变”)。
(1)已知数据如图,写出工业合成氨的热化学方程式:

(2)0.5 mol甲烷与一定量水蒸气在一定条件下,完全反应生成一氧化碳和氢气,吸热a kJ,则反应物总能量
 ”、“
”、“ ”或“=”)生成物总能量。
”或“=”)生成物总能量。(3)使Cl2和H2O(g)通过灼热炭层,生成气态HCl和CO2,当反应中转移1mol电子时释放145kJ热量。当有1molCO2生成时,ΔH =
(4)反应mA(g)+nB(g) = pC(g) +qD(g)过程中的能量变化如图所示:

①该反应ΔH =
②在反应体系中加入催化剂,ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】根据已知条件,写出对应的热化学方程式。
(1)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式______________________________ 。
(2)1mol C2H4(g)与适量O2(g)反应,生成CO2(g)和H2O(l),放出1141kJ热量______________________________ 。
(3)1mol C2H5OH(l)与适量O2(g)反应,生成CO2(g)和H2O(l),放出1366.8kJ热量______________________________ 。
(4)2mol Al(s)与适量O2(g)发生反应,生成Al2O3(s),放出1669.8kJ热量______________________________ 。
(5)已知金刚石的燃烧热△H=-395.0kJ/mol,写出金刚石燃烧的热化学方程式______________________________ 。
(1)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式
(2)1mol C2H4(g)与适量O2(g)反应,生成CO2(g)和H2O(l),放出1141kJ热量
(3)1mol C2H5OH(l)与适量O2(g)反应,生成CO2(g)和H2O(l),放出1366.8kJ热量
(4)2mol Al(s)与适量O2(g)发生反应,生成Al2O3(s),放出1669.8kJ热量
(5)已知金刚石的燃烧热△H=-395.0kJ/mol,写出金刚石燃烧的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=______ kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______ kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________ 。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)=2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ•mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____ 57.3 kJ(填“>”、“<”或“=”)。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)=2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ•mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求完成下列填空:
(1)在101kPa时,4.0g硫粉在氧气中完全燃烧生成二氧化硫,放出27kJ的热量,硫的燃烧热为_______ 。
(2)在101kPa时,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
(3)天然气中含有的微量H2S会腐蚀管道和设备,在1200℃下进行脱硫处理,H2S会被氧气氧化为SO2,并产生水蒸气。
请写出该反应的热化学方程式:_______ 。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl(g)和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式_______ 。
(5)已知:H2O(g)=H2O(l) ∆H=-44 kJ/mol;
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ∆H=-1228 kJ/mol。
写出液态酒精完全燃烧后温度恢复到室温时反应的热化学方程式:_______ 。
(1)在101kPa时,4.0g硫粉在氧气中完全燃烧生成二氧化硫,放出27kJ的热量,硫的燃烧热为
(2)在101kPa时,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为
(3)天然气中含有的微量H2S会腐蚀管道和设备,在1200℃下进行脱硫处理,H2S会被氧气氧化为SO2,并产生水蒸气。
| 化学键 | H-S | O=O | H-O | SO2中共价键 |
| 键能/(kJ▪mol-1) | 339 | 498 | 464 | 1083 |
请写出该反应的热化学方程式:
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl(g)和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式
(5)已知:H2O(g)=H2O(l) ∆H=-44 kJ/mol;
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ∆H=-1228 kJ/mol。
写出液态酒精完全燃烧后温度恢复到室温时反应的热化学方程式:
您最近一年使用:0次



