微型纽扣电池在现代生活中被广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=Zn(OH)2+2Ag,其中一个电极反应式为Ag2O+H2O+2e-=2Ag+2OH-。
(1)负极材料为_______ ,正极材料为_______ 。
(2)电池工作时,电子由_______ (填“正极”或“负极”,下同)流向_______ ,溶液中的阳离子流向电池的_______ ,阴离子流向电池的_______ 。
(3)甲醇(CH3OH)燃料电池为绿色化学电源,在NaOH溶液为电解质溶液时的负极反应式为_______ ,正极反应式为_______ 。该电池工作时,外电路每流过1×103mole-,消耗标准状况下氧气_______ L。
(1)负极材料为
(2)电池工作时,电子由
(3)甲醇(CH3OH)燃料电池为绿色化学电源,在NaOH溶液为电解质溶液时的负极反应式为
更新时间:2022-09-27 16:27:11
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】燃料电池是利用燃料(如H2、CO、CH4、CH3OH、NH3等)与O2反应从而将化学能转化为电能的装置。
(1)甲烷燃料电池(NaOH作电解质溶液)的负极反应式为_________________________ ,正极电极反应式为________________________________ ,放电过程中溶液的pH_______ (填“增大”、“减小”或“不变”)。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨−液氧燃料电池示意图如图所示,有关说法正确的是____________ 。

a.电池工作时,Na+向负极移动
b.电子由电极2经外电路流向电极1
c.电池总反应为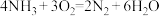
d.电极2发生的电极反应为
(3)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①A为生物燃料电池的________ (填“正”或“负”)极。
②正极反应式为_________________________________________________________ 。
负极反应式为___________________________________________________________ 。
③放电过程中,H+由________ 极区向________ 极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体_______ L。
⑤该电池________ (填“能”或“不能”)在高温下工作。
(4)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2−可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中CO的含量越高,请回答:

①a极电极反应式为________________________________________ 。
②工作时,O2−由电极________ 向电极________ 移动(填“a”或“b”,下同),电子由电极________ 通过传感器流向电极________ 。
(1)甲烷燃料电池(NaOH作电解质溶液)的负极反应式为
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨−液氧燃料电池示意图如图所示,有关说法正确的是

a.电池工作时,Na+向负极移动
b.电子由电极2经外电路流向电极1
c.电池总反应为
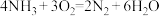
d.电极2发生的电极反应为

(3)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①A为生物燃料电池的
②正极反应式为
负极反应式为
③放电过程中,H+由
④在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体
⑤该电池
(4)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2−可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中CO的含量越高,请回答:

①a极电极反应式为
②工作时,O2−由电极
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作______ (填“正”或“负”)极,Zn电极上的电极反应式为___________ ,Cu电极上的现象是___________ 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。“离子导体”中主要离子的移动方向可描述为___________ 。
(3)从能量转化的角度来看,装置A中反应物的总能量___________ (填“高于”、“低于”或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中___________ (填“快”或“慢”)。
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2 mol电子转移时,Zn电极和Cu电极的质量差为___________ 。

(1)装置B为原电池,则Cu作
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。“离子导体”中主要离子的移动方向可描述为
(3)从能量转化的角度来看,装置A中反应物的总能量
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2 mol电子转移时,Zn电极和Cu电极的质量差为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
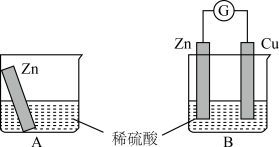
【推荐3】(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氢气从__ 口通入(填“a”或“b”),Y极为电池的___ (填“正”或“负”)极。
(2)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH--2e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Ag2O是__ 极,Zn发生__ 反应。
②电子由__ 极流向__ 极(填“Zn”或“Ag2O”),当电路通过0.1mol电子时,负极消耗物质的质量是___ g。

(2)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH--2e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Ag2O是
②电子由
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:___________ 。若初始时两电极质量相等,当电路中有2mole﹣通过时,两极的质量差为___________ g。
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为___________ ,当反应中收集到标准状况下336mL气体时,消耗负极的物质的量为___________ mol。
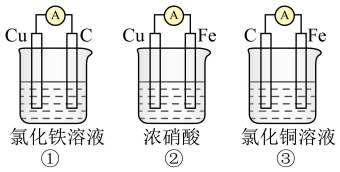
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是___________ ,写出正极的电极反应式___________ 。___________ (填“正”或“负”)极。
②该电池负极的电极反应式为___________ 。
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为___________ 。(用含NA的式子表示)
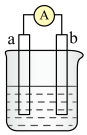
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
②该电池负极的电极反应式为
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应 为放热应:
为放热应:
①下图能正确表示该反应中能量变化的是__________ ;

②根据下表数据,计算生成 时该反应放出的热量为
时该反应放出的热量为__________  :
:
(2)某兴趣小组为研究原电池原理,设计如图装置。
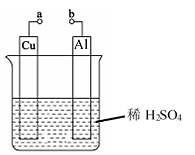
① 和
和 用导线连接,
用导线连接, 极为原电池
极为原电池________ (填“正”或“负”)极,电极反应式是________ ; 极发生
极发生________ (填“氧化”或“还原”)反应,其电极反应式为________ ,溶液中 移向
移向________ (填“ ”或“
”或“ ”极)。当负极金属溶解
”极)。当负极金属溶解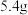 时,通过导线的电子数为
时,通过导线的电子数为________ 。
②不将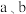 连接,请问如何加快
连接,请问如何加快 与稀硫酸的反映速率?
与稀硫酸的反映速率?____________________ 。
(1)已知一定条件下,反应
 为放热应:
为放热应:①下图能正确表示该反应中能量变化的是

②根据下表数据,计算生成
 时该反应放出的热量为
时该反应放出的热量为 :
:| 化学键 |  | 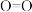 |  | 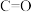 |  |
断开 键所吸收的能量 键所吸收的能量 | 415 | 498 | 343 | 798 | 465 |

①
 和
和 用导线连接,
用导线连接, 极为原电池
极为原电池 极发生
极发生 移向
移向 ”或“
”或“ ”极)。当负极金属溶解
”极)。当负极金属溶解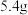 时,通过导线的电子数为
时,通过导线的电子数为②不将
 连接,请问如何加快
连接,请问如何加快 与稀硫酸的反映速率?
与稀硫酸的反映速率?
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】某兴趣小组用下图装置研究原电池的工作原理。
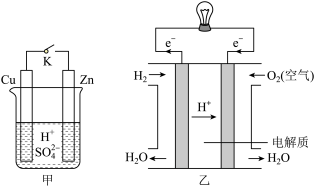
(1)甲中K断开时,装置中发生反应的离子方程式为_______________________ ;K闭合时,Cu棒上的现象为________ ,它为原电池的________ (填“正”或“负”)极。
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的________ (填“正”或“负”)极,发生________ (填“氧化”或“还原”)反应。
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:_______________________________________________ 。

(1)甲中K断开时,装置中发生反应的离子方程式为
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求填空
(1)尝试分析如图所示的原电池的工作原理。

锌原子_______ 电子被氧化成 Zn2+ 进入溶液,反应式为_______ ,锌片上的电子通过导线流向铜片,溶液中的_______ 离子移向正极铜片,在铜片上_______ 电子而被还原形成氢分子逸出,反应式为_______ 。电解质溶液中_______ 离子移向负极锌片。
(2)在图示的装置中,锌片、铜片与稀硫酸,哪些可以替换为其他物质却同样能产生电流?
正极铜可用_______ 替换,硫酸可用_______ 替换。
(1)尝试分析如图所示的原电池的工作原理。

锌原子
(2)在图示的装置中,锌片、铜片与稀硫酸,哪些可以替换为其他物质却同样能产生电流?
正极铜可用
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.(1)下列变化中,属于吸热反应的是_______ 。
①液态水汽化 ②Ba(OH)2•8H2O与固体NH4Cl混合 ③浓H2SO4稀释 ④高锰酸钾分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥将胆矾加热变为白色粉末 ⑦CO2+C 2CO ⑧CaCO3高温分解 ⑨N2+3H2
2CO ⑧CaCO3高温分解 ⑨N2+3H2  2NH3 ⑩C+H2O(g)
2NH3 ⑩C+H2O(g) CO+H2
CO+H2
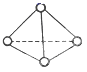
(2)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为N2时要_______ 填“吸收”或“放出”)热量_______ kJ。
Ⅱ.原电池是化学对人类的一项重大贡献。
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。
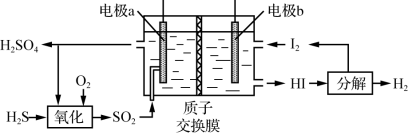
电极a上发生反应的电极反应式为_______ 。
(4)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为_______ 。
(5)一次电池碱性锌锰电池在生活中用途广泛,已知该电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出该电池正极电极反应式_______ 。
(6)甲醇(CH3OH)是一种重要的化工原料和新型燃料。写出用氢氧化钾溶液作电解质时该甲醇燃料电池的负极电极反应式:_______ 。
①液态水汽化 ②Ba(OH)2•8H2O与固体NH4Cl混合 ③浓H2SO4稀释 ④高锰酸钾分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥将胆矾加热变为白色粉末 ⑦CO2+C
 2CO ⑧CaCO3高温分解 ⑨N2+3H2
2CO ⑧CaCO3高温分解 ⑨N2+3H2  2NH3 ⑩C+H2O(g)
2NH3 ⑩C+H2O(g) CO+H2
CO+H2(2)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为N2时要

Ⅱ.原电池是化学对人类的一项重大贡献。
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。

电极a上发生反应的电极反应式为
(4)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为
(5)一次电池碱性锌锰电池在生活中用途广泛,已知该电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出该电池正极电极反应式
(6)甲醇(CH3OH)是一种重要的化工原料和新型燃料。写出用氢氧化钾溶液作电解质时该甲醇燃料电池的负极电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
(1)控制条件,让反应在恒容密闭穼器中进行反应: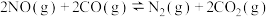 。用传感器测得不同时间
。用传感器测得不同时间 和
和 的浓度如表。
的浓度如表。
前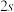 内的平均反应速率
内的平均反应速率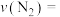
___________ ,从表格看,已达化学平衡的时间段为___________ s;
(2)在一定温度下,某固定容积的密闭容器中充入一定量的 气体后,发生反应
气体后,发生反应 ,已知
,已知 是红棕色气体,
是红棕色气体, 是无色气体。如图所示是反应速率(
是无色气体。如图所示是反应速率(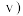 与时间
与时间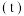 的关系曲线。下列叙述正确的是
的关系曲线。下列叙述正确的是___________ ;

a. 时,反应未达到平衡,
时,反应未达到平衡, 浓度在减小
浓度在减小
b. 时,反应达到平衡,反应不再进行
时,反应达到平衡,反应不再进行
c. 各物质浓度不再变化
各物质浓度不再变化
d. 各物质浓度相等
各物质浓度相等
e.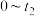 ,
, 浓度增大
浓度增大
f.反应过程中气体的颜色不变
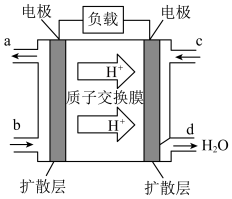
(3)使用 时也要注意防止污染环境。电化学气敏传感器可用于监测环境中
时也要注意防止污染环境。电化学气敏传感器可用于监测环境中 的含量,其工作原理如图:
的含量,其工作原理如图:

①Pt电极(b)上的电极反应式为___________ ;
②电池总反应的化学反应方程式为___________ ,反应一段时间后, 溶液的浓度将
溶液的浓度将___________ (填“增大”“减小”或“不变”)。
(1)控制条件,让反应在恒容密闭穼器中进行反应:
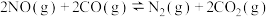 。用传感器测得不同时间
。用传感器测得不同时间 和
和 的浓度如表。
的浓度如表。时间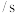 | 0 | 1 | 2 | 3 | 4 | 5 |
 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
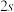 内的平均反应速率
内的平均反应速率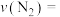
(2)在一定温度下,某固定容积的密闭容器中充入一定量的
 气体后,发生反应
气体后,发生反应 ,已知
,已知 是红棕色气体,
是红棕色气体, 是无色气体。如图所示是反应速率(
是无色气体。如图所示是反应速率(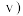 与时间
与时间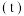 的关系曲线。下列叙述正确的是
的关系曲线。下列叙述正确的是
a.
 时,反应未达到平衡,
时,反应未达到平衡, 浓度在减小
浓度在减小b.
 时,反应达到平衡,反应不再进行
时,反应达到平衡,反应不再进行c.
 各物质浓度不再变化
各物质浓度不再变化d.
 各物质浓度相等
各物质浓度相等e.
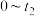 ,
, 浓度增大
浓度增大f.反应过程中气体的颜色不变
(3)使用
 时也要注意防止污染环境。电化学气敏传感器可用于监测环境中
时也要注意防止污染环境。电化学气敏传感器可用于监测环境中 的含量,其工作原理如图:
的含量,其工作原理如图:
①Pt电极(b)上的电极反应式为
②电池总反应的化学反应方程式为
 溶液的浓度将
溶液的浓度将
您最近一年使用:0次



