生活中处处有化学。
Ⅰ.我国西北有很多盐碱湖,湖水中溶有大量的氯化钠和纯碱。在夏天,当地的农民将湖水引入湖滩上晒出了食盐。到了冬天,湖面上又漂浮着大量的石碱晶体(Na2CO3·10H2O),农民则可以直接从湖中捞碱。氯化钠和石碱的溶解度曲线如图所示。
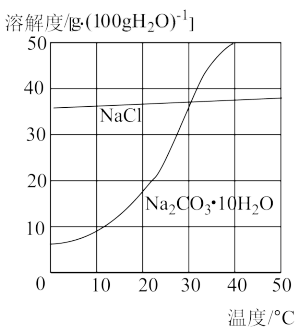
(1)“夏天晒盐”相当于实验室的_______ 法,“冬天捞碱”相当于实验室的_______ 法。
(2)为检验所得石碱样品中是否含有NaCl,应使用的试剂是_______ 。
Ⅱ.为测定石碱样品的质量分数w(Na2CO3·10H2O)(假设只含NaCl杂质),某同学先将样品配成溶液,再测定溶液浓度,最后通过化学反应求出样品的质量分数。
第一步:配制100 mL待测液。该同学的实验单中设计步骤如下:
用电子天平取2.000 g石碱样品,在(A)中加水溶解并冷却至室温后,沿着(B)将液体转移至(C)中。向(C)中直接加水至接近刻度线1~2 cm处,改用(D)逐滴加水至(_______)。摇匀后将液体转移至贴好标签的细口瓶中保存。
(3)该实验单中缺少一个实验步骤,该步骤的名称是_______ 。如果不进行纠正,会造成所配溶液的浓度_______ (填“偏高”、“偏低”、“不影响”)
(4)填写实验单中所用仪器的名称:(A)_______ ;(B)_______ ;(C)_______ ;(D)_______ 。
(5)“配制待测液”的过程中先后两次用到仪器(B),但作用有所区别。按先后顺序 ,说明(B)在实验中的作用:_______ ,_______ 。
(6)实验单中“(_______)”的内容应该是_______ 。
第二步:测定待测液浓度:更正第一步中错误操作后,该同学每次取20.00 mL待测液,与0.160 mol·L-1的稀盐酸反应至完全转化为CO2.多次测量后,平均每次消耗盐酸17.40 mL。
(7)该实验测出的碳酸钠溶液的物质的量浓度为_______ (保留三位有效数字)。
(8)根据实验数据可得出石碱的质量分数w(Na2CO3·10H2O)=_______ 。(保留三位有效数字)
Ⅰ.我国西北有很多盐碱湖,湖水中溶有大量的氯化钠和纯碱。在夏天,当地的农民将湖水引入湖滩上晒出了食盐。到了冬天,湖面上又漂浮着大量的石碱晶体(Na2CO3·10H2O),农民则可以直接从湖中捞碱。氯化钠和石碱的溶解度曲线如图所示。

(1)“夏天晒盐”相当于实验室的
(2)为检验所得石碱样品中是否含有NaCl,应使用的试剂是
Ⅱ.为测定石碱样品的质量分数w(Na2CO3·10H2O)(假设只含NaCl杂质),某同学先将样品配成溶液,再测定溶液浓度,最后通过化学反应求出样品的质量分数。
第一步:配制100 mL待测液。该同学的实验单中设计步骤如下:
用电子天平取2.000 g石碱样品,在(A)中加水溶解并冷却至室温后,沿着(B)将液体转移至(C)中。向(C)中直接加水至接近刻度线1~2 cm处,改用(D)逐滴加水至(_______)。摇匀后将液体转移至贴好标签的细口瓶中保存。
(3)该实验单中缺少一个实验步骤,该步骤的名称是
(4)填写实验单中所用仪器的名称:(A)
(5)“配制待测液”的过程中先后两次用到仪器(B),但作用有所区别。
(6)实验单中“(_______)”的内容应该是
第二步:测定待测液浓度:更正第一步中错误操作后,该同学每次取20.00 mL待测液,与0.160 mol·L-1的稀盐酸反应至完全转化为CO2.多次测量后,平均每次消耗盐酸17.40 mL。
(7)该实验测出的碳酸钠溶液的物质的量浓度为
(8)根据实验数据可得出石碱的质量分数w(Na2CO3·10H2O)=
更新时间:2022-11-08 21:17:56
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示。

(1)将黄铜矿粉碎的目的是___________ 。
(2)高温焙烧时,CuFeS2与O2按物质的量之比为1:1的关系发生反应,该反应的化学方程式是___________ 。该反应中,还原产物是___________ 。
(3)向滤液A中通入Cl2的离子方程式为___________ 。
(4)滤渣焙烧生成三氧化二铁的化学方程式为___________ 。
(5)操作b后检验滤渣已经洗涤干净的实验操作为___________ 。
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
I.H2S+Fe2(SO4)2=S↓+2FeSO4+H2SO4
Ⅱ.4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
由图甲和图乙判断使用硫杆菌的最佳条件:温度为___________ 、pH为___________ ,若反应温度过高,反应速率下降,其原因是___________ 。
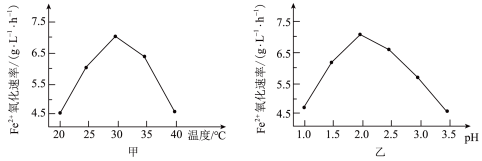

(1)将黄铜矿粉碎的目的是
(2)高温焙烧时,CuFeS2与O2按物质的量之比为1:1的关系发生反应,该反应的化学方程式是
(3)向滤液A中通入Cl2的离子方程式为
(4)滤渣焙烧生成三氧化二铁的化学方程式为
(5)操作b后检验滤渣已经洗涤干净的实验操作为
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
I.H2S+Fe2(SO4)2=S↓+2FeSO4+H2SO4
Ⅱ.4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
由图甲和图乙判断使用硫杆菌的最佳条件:温度为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有A、B、C三种可溶性正盐,阴阳离子各不相同,它们的阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀(微溶物视为可溶物)。请回答下列问题。
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是__________
A.Na+ B.Mg2+ C.Cu2+ D .Ag+
(2)写出三种盐的化学式:A_________________ B______________ C _______________
(3)不需要加入任何试剂就能将上述三种盐溶液区分开来,鉴别出来的先后顺序为______________ (填化学式)
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、K +、SO42-、NO3- 四种离子且物质的量之比为1:4:2:3,则A、B、C三种盐的物质的量之比为__________ ,若向该溶液中加入过量的Ba(OH)2,发生反应的离子方程式为 _____________________ 。
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是
A.Na+ B.Mg2+ C.Cu2+ D .Ag+
(2)写出三种盐的化学式:A
(3)不需要加入任何试剂就能将上述三种盐溶液区分开来,鉴别出来的先后顺序为
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、K +、SO42-、NO3- 四种离子且物质的量之比为1:4:2:3,则A、B、C三种盐的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】卤块的主要成分是MgCl2(还含有少量Fe2+、Fe3+、Mn2+等离子)。以它为原料按下图流程可制得单质镁。
②MnCO3不溶于水。
请回答下列问题:
(1)步骤①中加入NaClO的目的是_______ ;为了尽量除去杂质,pH应调至_______ ,固体a中的成分有_______ 。
(2)溶液b中的主要溶质为_______ ,步骤②后检验固体b已洗涤干净的操作为_______ 。
(3)步骤④选用的试剂X应是_______ 。
(4)步骤⑤操作Ⅰ包括:先制得MgCl2·6H2O,再加热失水得无水MgCl2.由溶液c制MgCl2·6H2O的操作为_______ 、_______ 、过滤。
(5)步骤⑥反应的化学方程式为_______ 。
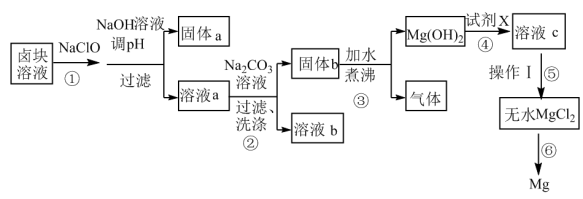
| 物质 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 8.3 | 9.6 |
| 完全沉淀 | 3.7 | 9.8 | 11.1 |
请回答下列问题:
(1)步骤①中加入NaClO的目的是
(2)溶液b中的主要溶质为
(3)步骤④选用的试剂X应是
(4)步骤⑤操作Ⅰ包括:先制得MgCl2·6H2O,再加热失水得无水MgCl2.由溶液c制MgCl2·6H2O的操作为
(5)步骤⑥反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为___ 。
(2)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是___ 。
(3)请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。____

(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是___ 。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚

根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为
(2)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是
(3)请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。

(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】三草酸合铁酸钾【 ,Mr=491】是一种翠绿色晶体,可溶于水,难溶于乙醇,见光易分解。实验室利用如下方法制备该晶体并对其阴离子电荷和晶体组成进行测定。
,Mr=491】是一种翠绿色晶体,可溶于水,难溶于乙醇,见光易分解。实验室利用如下方法制备该晶体并对其阴离子电荷和晶体组成进行测定。
回答下列问题:
I.晶体制备
i.称取一定量 加水溶解,向其中滴加稍过量的
加水溶解,向其中滴加稍过量的 氨水和6%
氨水和6% 溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到
溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到 沉淀。
沉淀。
ii.向 沉淀中缓慢加入
沉淀中缓慢加入 溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。
溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。
(1)步骤i中生成 的离子方程式为
的离子方程式为___________ ;向静置后的上层清液中滴加___________ (填化学式),观察现象可确定上述反应是否进行完全。
(2)步骤ii中为促进结晶,冷却后可加入___________ (填试剂名称);实验室应将产品保存在___________ 瓶中。
(3)步骤ii中减压抽滤时采用如图装置。

①连接好装置后,接下来首先需要进行的操作为___________ 。
②打开水龙头,抽气,用倾析法先后将溶液和沉淀转移至布氏漏斗中。抽滤完毕,接下来的操作为___________ (填选项字母)。
A.先关闭水龙头,后拔掉橡胶管 B.先拔掉橡胶管,后关闭水龙头
③和普通过滤相比,减压抽滤的优点为___________ (写出一点即可)。
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制适当流速,使其全部通过装有阴离子交换树脂(用 表示)的交换柱,发生阴离子(用
表示)的交换柱,发生阴离子(用 表示)交换:
表示)交换: 。结束后,用蒸馏水洗涤交换柱,合并流出液,并将其配成250mL溶液。取25.00mL该溶液,以
。结束后,用蒸馏水洗涤交换柱,合并流出液,并将其配成250mL溶液。取25.00mL该溶液,以 溶液为指示剂,用
溶液为指示剂,用
 标准液滴定至终点,消耗标准液VmL。
标准液滴定至终点,消耗标准液VmL。
(4)阴离子电荷数为___________ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果___________ (填“偏高”“偏低”或“无影响”)。
III.晶体部分组成的测定
i. 含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用
含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用 标准液滴定至终点。
标准液滴定至终点。
ii. 含量测定:向i中滴定后的溶液中加入Zn粉和适量稀
含量测定:向i中滴定后的溶液中加入Zn粉和适量稀 ,加热至沸腾,过滤除去过量Zn粉得滤液,冷却后用
,加热至沸腾,过滤除去过量Zn粉得滤液,冷却后用 标准液滴定至终点。
标准液滴定至终点。
(5)步骤ii中,加入Zn粉的目的为___________ 。
(6)若省略步骤i,直接利用步骤ii不能测定 含量,解释其原因为
含量,解释其原因为___________ 。
 ,Mr=491】是一种翠绿色晶体,可溶于水,难溶于乙醇,见光易分解。实验室利用如下方法制备该晶体并对其阴离子电荷和晶体组成进行测定。
,Mr=491】是一种翠绿色晶体,可溶于水,难溶于乙醇,见光易分解。实验室利用如下方法制备该晶体并对其阴离子电荷和晶体组成进行测定。回答下列问题:
I.晶体制备
i.称取一定量
 加水溶解,向其中滴加稍过量的
加水溶解,向其中滴加稍过量的 氨水和6%
氨水和6% 溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到
溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到 沉淀。
沉淀。ii.向
 沉淀中缓慢加入
沉淀中缓慢加入 溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。
溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。(1)步骤i中生成
 的离子方程式为
的离子方程式为(2)步骤ii中为促进结晶,冷却后可加入
(3)步骤ii中减压抽滤时采用如图装置。

①连接好装置后,接下来首先需要进行的操作为
②打开水龙头,抽气,用倾析法先后将溶液和沉淀转移至布氏漏斗中。抽滤完毕,接下来的操作为
A.先关闭水龙头,后拔掉橡胶管 B.先拔掉橡胶管,后关闭水龙头
③和普通过滤相比,减压抽滤的优点为
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制适当流速,使其全部通过装有阴离子交换树脂(用
 表示)的交换柱,发生阴离子(用
表示)的交换柱,发生阴离子(用 表示)交换:
表示)交换: 。结束后,用蒸馏水洗涤交换柱,合并流出液,并将其配成250mL溶液。取25.00mL该溶液,以
。结束后,用蒸馏水洗涤交换柱,合并流出液,并将其配成250mL溶液。取25.00mL该溶液,以 溶液为指示剂,用
溶液为指示剂,用
 标准液滴定至终点,消耗标准液VmL。
标准液滴定至终点,消耗标准液VmL。(4)阴离子电荷数为
III.晶体部分组成的测定
i.
 含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用
含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用 标准液滴定至终点。
标准液滴定至终点。ii.
 含量测定:向i中滴定后的溶液中加入Zn粉和适量稀
含量测定:向i中滴定后的溶液中加入Zn粉和适量稀 ,加热至沸腾,过滤除去过量Zn粉得滤液,冷却后用
,加热至沸腾,过滤除去过量Zn粉得滤液,冷却后用 标准液滴定至终点。
标准液滴定至终点。(5)步骤ii中,加入Zn粉的目的为
(6)若省略步骤i,直接利用步骤ii不能测定
 含量,解释其原因为
含量,解释其原因为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】亚硝酰氯(Cl-N=O)是有机合成中的重要试剂,熔点为-64. 5℃,沸点为- 5.5℃,遇水易水解。实验室用Cl2与NO反应制备ClNO并测定其纯度的实验装置如图所示(夹持装置略去)。
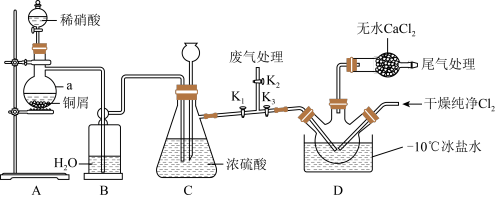
回答下列问题:
(1)仪器a的名称为_______ 。a中发生反应的离子方程式为_______ 。
(2)装置C中长颈漏斗的作用是_______ 。
(3)实验室一般将浓硝酸保存在棕色试剂瓶中,并放置在阴凉处,原因是_______ (用化学方程式表示)。
(4)装置D中将三颈烧瓶浸在- 10℃冰盐水中的目的是_______ 。
(5)若去掉装置D中的干燥管,对实验的影响是_______ (用化学方程式表示)。
(6)通过以下实验测定亚硝酰氯样品的纯度。取D中所得液体100 g溶于适量的NaOH溶液中,配制成250 mL溶液;取出25. 00 mL样品溶于锥形瓶中,用a mol·L-1 AgNO3标准溶液滴定,滴定终点时消耗标准溶液的体积为20. 00 mL。则亚硝酰氯样品的纯度为_______ 。

回答下列问题:
(1)仪器a的名称为
(2)装置C中长颈漏斗的作用是
(3)实验室一般将浓硝酸保存在棕色试剂瓶中,并放置在阴凉处,原因是
(4)装置D中将三颈烧瓶浸在- 10℃冰盐水中的目的是
(5)若去掉装置D中的干燥管,对实验的影响是
(6)通过以下实验测定亚硝酰氯样品的纯度。取D中所得液体100 g溶于适量的NaOH溶液中,配制成250 mL溶液;取出25. 00 mL样品溶于锥形瓶中,用a mol·L-1 AgNO3标准溶液滴定,滴定终点时消耗标准溶液的体积为20. 00 mL。则亚硝酰氯样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】用NaOH固体配制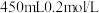 的NaOH溶液。请回答
的NaOH溶液。请回答
(1)用托盘天平称量的NaOH的质量为___________ ,用到的实验仪器有托盘天平、药匙、量筒、烧杯、玻璃棒,还缺少的仪器是:___________ 、___________ 。
(2)溶液转移到后,要洗涤___________ 2-3次,洗液也转移到容量瓶,目的是___________ 。
(3)定容时的操作:当液面接近容量瓶刻度线1~2cm时,___________ ,再将容量瓶塞盖好,反复上下颠倒摇匀。
(4)下列操作会使配制的NaOH溶液浓度偏低的是___________
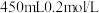 的NaOH溶液。请回答
的NaOH溶液。请回答(1)用托盘天平称量的NaOH的质量为
(2)溶液转移到后,要洗涤
(3)定容时的操作:当液面接近容量瓶刻度线1~2cm时,
(4)下列操作会使配制的NaOH溶液浓度偏低的是___________
| A.定容时仰视容量瓶的刻度线 |
| B.固体溶解后没有冷却到室温就转移到容量瓶中 |
| C.摇匀后发现液面低于容量瓶的刻度线,再滴加蒸馏水至刻度线 |
| D.转移洗涤液时不小心将液体洒到容量瓶外,重新配制时继续使用该未清洗的容量瓶 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某家用防疫用品“84消毒液”的包装说明如下:
该小组同学进行了如下实验,回答下列问题:
(1)稀释:将“84消毒液”原液稀释配制成500mLc(NaClO)=0.060mol/L的溶液。
①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、_______ 。
②稀释时,需要取用_______ mL“84消毒液”原液。
③下列操作会使溶液中NaClO浓度偏高的是_______ 。
A.取用的“84消毒液”原液是久置的
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图装置探究84消毒液与洁厕灵的反应,当注射器中的洁厕灵注入试管中时,可观察到pH试纸的现象是_______ ,湿润的淀粉碘化钾试纸上发生的离子反应方程式为_______ 。
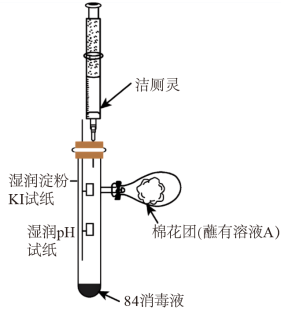
| [产品名称] 84消毒液 [有效成分] NaC1O [规格] 1000mL [浓度] 4.0mol/L 注:①按一定比例稀释后使用 ②不得与酸性产品(如洁厕灵)同时使用 |
(1)稀释:将“84消毒液”原液稀释配制成500mLc(NaClO)=0.060mol/L的溶液。
①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
②稀释时,需要取用
③下列操作会使溶液中NaClO浓度偏高的是
A.取用的“84消毒液”原液是久置的
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图装置探究84消毒液与洁厕灵的反应,当注射器中的洁厕灵注入试管中时,可观察到pH试纸的现象是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室用密度1.18g/mL、质量分数为36.5%的浓盐酸配制250mL0.1mol/L的盐酸,回答下列问题:
(1)配制250mL0.1mol/L的盐酸
(2)配制时,正确的操作顺序是____ (填编号)。
A.用适量蒸馏水洗涤烧杯和玻璃棒2~3 次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌, 使其混合均匀
C.将已冷却的溶液沿玻璃棒注入所选容量瓶中
D.盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm 处
(3)操作A中,将洗涤液都注入容量瓶,其目的是______ , 若无操作A,则所配溶液浓度____ (填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度____ (填“偏大”、“偏 小”或“不变”),应如何处理______ 。
(1)配制250mL0.1mol/L的盐酸
| 应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
(2)配制时,正确的操作顺序是
A.用适量蒸馏水洗涤烧杯和玻璃棒2~3 次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌, 使其混合均匀
C.将已冷却的溶液沿玻璃棒注入所选容量瓶中
D.盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm 处
(3)操作A中,将洗涤液都注入容量瓶,其目的是
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过最NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_____________________________________________________________ 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是__________________________________________________________________ 。
Ⅱ.牙膏样品中碳酸钙的定量测定
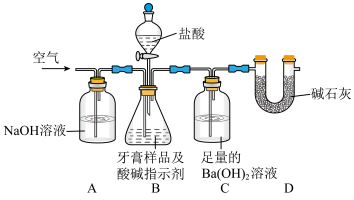
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_________________________________________________ 。
(4)D装置的作用是____________________________________________ 。
(5)C中反应生成BaCO3的化学方程式是_________________________________________ 。
(6)下列各项措施中,不能提高测定准确度的是________ (填标号)。
①在加入盐酸之前,应排净装置内的CO2气体
②滴加盐酸不宜过快
③在A-B之间增添盛有浓硫酸的洗气装置
④在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(7)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____________ 。
(8)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________ 。
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过最NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)D装置的作用是
(5)C中反应生成BaCO3的化学方程式是
(6)下列各项措施中,不能提高测定准确度的是
①在加入盐酸之前,应排净装置内的CO2气体
②滴加盐酸不宜过快
③在A-B之间增添盛有浓硫酸的洗气装置
④在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(7)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为
(8)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】铜(Ⅰ)配合物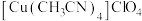 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。
1.制备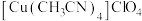
将乙腈的 ,
, ,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
取 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。
已知:① 沸点为81℃.酸性条件下遇水生成
沸点为81℃.酸性条件下遇水生成
②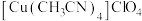 (
(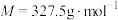 )较易被空气氧化:
)较易被空气氧化:
③EDTA与 形成1:1配合物:
形成1:1配合物:
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器 的作用是
的作用是______ , 中应加入
中应加入______ 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是______ .
(3)“一系列操作”依次为过滤分离出滤液、______ 冷却结晶、过滤、洗涤、干燥。
(4) 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为______ .
(5)加入醋酸钠溶液的主要目的是______ .
(6)测得产品的纯度为______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有______.
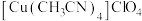 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。1.制备
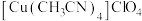
将乙腈的
 ,
, ,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
取
 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。已知:①
 沸点为81℃.酸性条件下遇水生成
沸点为81℃.酸性条件下遇水生成
②
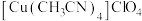 (
(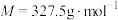 )较易被空气氧化:
)较易被空气氧化:③EDTA与
 形成1:1配合物:
形成1:1配合物:④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器
 的作用是
的作用是 中应加入
中应加入(2)加入过量铜粉能提高产物的纯度,可能的原因是
(3)“一系列操作”依次为过滤分离出滤液、
(4)
 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为(5)加入醋酸钠溶液的主要目的是
(6)测得产品的纯度为
 、
、 、
、 的代数式表示)。
的代数式表示)。(7)下列情况会导致产品纯度测定结果偏高的有______.
A.产品中含有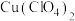 | B.滴定终点时俯视读数 |
| C.盛装EDTA溶液的滴定管未润洗 | D.产品干燥不充分 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易水解,可用作肥料、灭火剂、洗涤剂等。实验室制备氨基甲酸铵的反应如下:2NH3(g)+CO2(g)  NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:

步骤1:按图连接好实验装置,____________________ 。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
(1)将步骤1补充完整:________________________
(2)干燥管中盛放的药品是___________________________
(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有____________________ (写出一种即可)。
(4)三颈烧瓶中产生氨气的原理是________________________________ 。
(5)反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是________________ 。
(6)尾气处理装置中双通玻璃管的作用是_________________ (用文字叙述),浓硫酸的作用是_______________ 、______________ 。
(7)取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为___________ 。
 NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
步骤1:按图连接好实验装置,
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
(1)将步骤1补充完整:
(2)干燥管中盛放的药品是
(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有
(4)三颈烧瓶中产生氨气的原理是
(5)反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是
(6)尾气处理装置中双通玻璃管的作用是
(7)取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为
您最近一年使用:0次



