X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______ ;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________ (用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________ (填“高”或“低”),理由是__________________________________________________ 。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________ 。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
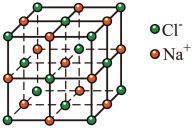
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______ ;晶体中每个镁原子周围距离最近的R原子有_______ 个。
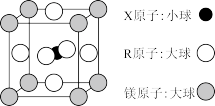
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
(1)Y元素的基态原子中未成对电子数为
(2)W的氯化物的熔点比Q的氯化物的熔点
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为

2013·河南商丘·二模 查看更多[3]
更新时间:2016-12-09 04:43:30
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
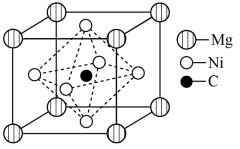
【推荐1】中科院物理所发现一种仅由镍、镁、碳三种元素构成的超导体,它是第一种不含氧原子的钙钛矿结构的超导体。回答下列问题:
(1)基态Ni原子的核外电子排布式为___________ 。
(2)石墨中C原子的杂化方式___________ ;金刚石硬度大、熔点高的原因是___________ ; 晶体的堆积方式为
晶体的堆积方式为___________ ,其等电子体有___________ (任写两种)。
(3)Mg的堆积方式为___________ ,每个Mg原子周围紧邻的原子数为___________ 。Mg及其相邻元素的第一电离能(I1)如表。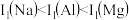 ,原因是
,原因是___________ 。
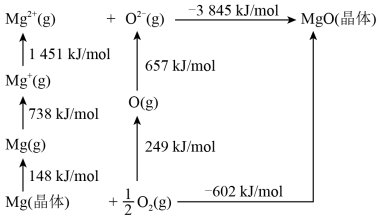
(4)MgO的Born-Haber循环如上中图所示。MgO晶格能为___________  。
。
(5)该超导体的晶胞如图所示,其化学式为___________ ,若晶体密度为d  ,阿伏加德罗常数的值为NA,晶胞参数a=
,阿伏加德罗常数的值为NA,晶胞参数a=___________ (写出表达式,带单位)。
(1)基态Ni原子的核外电子排布式为
(2)石墨中C原子的杂化方式
 晶体的堆积方式为
晶体的堆积方式为(3)Mg的堆积方式为
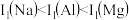 ,原因是
,原因是| I1(kJ/mol) | ||
| Na 496 | Mg 738 | Al 578 |
(4)MgO的Born-Haber循环如上中图所示。MgO晶格能为
 。
。
(5)该超导体的晶胞如图所示,其化学式为
 ,阿伏加德罗常数的值为NA,晶胞参数a=
,阿伏加德罗常数的值为NA,晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:
(1)基态Be原子的电子排布图为____________ ,基态Al原子核外电子占据________ 个轨道,其中能量最高能级的原子轨道的形状为__________ 。
(2)Al、Si、O的第一电离能由大到小的排序为____________________ 。
(3)SO3分子中硫原子的杂化类型是_____ ,SO3分子的空间构型是________ 。
(4)工业上,电解制取金属铝,不能用熔融的AlCl3,AlCl3的晶体类型是__________ ,将Be3Al2Si6O18写为氧化物的式子是_____________________ 。
(5)LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:
1mol甲酸分子中σ键与π键的比值为________________ ,甲酸和乙醇的熔点相差较大的主要原因是____________________________________________ 。
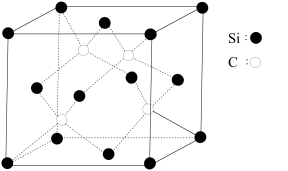
(6)碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3,NA代表阿伏加 德罗常数的数值。该晶胞边长为_____________ pm。
(1)基态Be原子的电子排布图为
(2)Al、Si、O的第一电离能由大到小的排序为
(3)SO3分子中硫原子的杂化类型是
(4)工业上,电解制取金属铝,不能用熔融的AlCl3,AlCl3的晶体类型是
(5)LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:
| 甲酸 | 乙醇 | |
| 相对分子质量 | 46 | 46 |
| 熔点/°C | 8.6 | -114.3 |
| 沸点/°C | 101 | 78.4 |

(6)碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3,NA代表阿伏加 德罗常数的数值。该晶胞边长为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________ 。
(2)Mn位于元素周期表的_____ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__ NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____ 。PO43-的空间构型是___ ,中心原子的杂化方式是______ 。
(4)PH3是_____ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______ 。
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______ nm。(用含a、M、NA的计算式表示)

(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为
(2)Mn位于元素周期表的
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是
(4)PH3是
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铜基及硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)写出Cu原子价电子的轨道表达式:____________ 。BF3的立体构型是____________ 。
(2)NaBH4被认为是有机化学上的“万能还原剂”, NaBH4电子式为____________ ,其中三种元素的第一电离能由大到小的顺序是_________________ 。
(3)BH3·NH3是一种有效、安全的固体储氢材料,结构如右图所示。 B原子的轨道杂化类型是____________ 。该物质中含有配位键,其中提供空轨道接受孤对电子的是____________ 。该物质易溶于水,其原因是____________ 。
(4)硼与氦形成类似苯的化合物B3N3H6(硼氮苯),俗称无机苯。硼氮苯属于分子____________ (填“极性”或“非极性”),一个硼氮苯分子中有____________ 个σ键,形成π键的电子由____________ 提供。
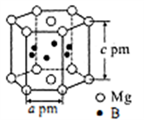
(5)硼与镁形成的高温超导材料晶体结构如图所示。该六方晶胞中镁原子与硼原子的数量比为____________ ,晶体密度d=____________ g·cm-3。
(1)写出Cu原子价电子的轨道表达式:
(2)NaBH4被认为是有机化学上的“万能还原剂”, NaBH4电子式为
(3)BH3·NH3是一种有效、安全的固体储氢材料,结构如右图所示。 B原子的轨道杂化类型是

(4)硼与氦形成类似苯的化合物B3N3H6(硼氮苯),俗称无机苯。硼氮苯属于分子
(5)硼与镁形成的高温超导材料晶体结构如图所示。该六方晶胞中镁原子与硼原子的数量比为
您最近一年使用:0次
【推荐2】铜是人类最早使用的金属之一。回答下列问题:
(1)基态铜原子的价层电子排布图为___________ 。
(2)向 溶液中加入足量氨水得到深蓝色
溶液中加入足量氨水得到深蓝色 溶液,再向其中加入盐酸羟胺(
溶液,再向其中加入盐酸羟胺(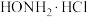 )至溶液变为无色,再通入
)至溶液变为无色,再通入 后析出
后析出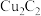 红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是
红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是___________ (填元素符号); 的空间结构名称为
的空间结构名称为___________ ; 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为___________ ; 在水中的溶解度较小的原因是
在水中的溶解度较小的原因是___________ ; 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为___________ 。
(3)上述 、
、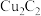 的晶体类型都属于下列中的___________(填标号)。
的晶体类型都属于下列中的___________(填标号)。
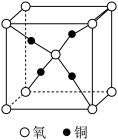
(4)铜和氧形成的一种离子化合物的晶体结构如图所示。若其晶胞边长为a pm,阿伏加德罗常数值为 ,则该晶体密度为
,则该晶体密度为___________  。
。
(1)基态铜原子的价层电子排布图为
(2)向
 溶液中加入足量氨水得到深蓝色
溶液中加入足量氨水得到深蓝色 溶液,再向其中加入盐酸羟胺(
溶液,再向其中加入盐酸羟胺(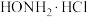 )至溶液变为无色,再通入
)至溶液变为无色,再通入 后析出
后析出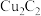 红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是
红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是 的空间结构名称为
的空间结构名称为 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为 在水中的溶解度较小的原因是
在水中的溶解度较小的原因是 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为(3)上述
 、
、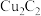 的晶体类型都属于下列中的___________(填标号)。
的晶体类型都属于下列中的___________(填标号)。| A.分子晶体 | B.共价晶体 | C.金属晶体 | D.离子晶体 |
 ,则该晶体密度为
,则该晶体密度为 。
。
您最近一年使用:0次
【推荐3】元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)砷在元素周期表中位于___________ 区,其基态价电子排布式为___________
(2)烟火燃放过程中会产生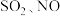 等有毒气体。硫原子最高能级电子云轮廓图的形状是
等有毒气体。硫原子最高能级电子云轮廓图的形状是___________ ,N、O、S原子的第一电离能由大到小的顺序是___________
(3)向 溶液中通入过量氨气可以生成
溶液中通入过量氨气可以生成 ,
, 电子式为
电子式为___________ 比较 键中键角大小,
键中键角大小,
___________  (填“<,>或=”),
(填“<,>或=”), 与
与 均为三角锥形分子,
均为三角锥形分子, 分子中的氮原子不易与
分子中的氮原子不易与 形成配离子,从电负性角度分析其原因是
形成配离子,从电负性角度分析其原因是___________
(4)已知 (晶胞如图所示)晶胞的密度为
(晶胞如图所示)晶胞的密度为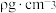 ,
, 的摩尔质量为
的摩尔质量为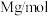 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在
,则在 晶体里
晶体里 和
和 的最短距离为
的最短距离为___________ pm。
(1)砷在元素周期表中位于
(2)烟火燃放过程中会产生
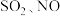 等有毒气体。硫原子最高能级电子云轮廓图的形状是
等有毒气体。硫原子最高能级电子云轮廓图的形状是(3)向
 溶液中通入过量氨气可以生成
溶液中通入过量氨气可以生成 ,
, 电子式为
电子式为 键中键角大小,
键中键角大小,
 (填“<,>或=”),
(填“<,>或=”), 与
与 均为三角锥形分子,
均为三角锥形分子, 分子中的氮原子不易与
分子中的氮原子不易与 形成配离子,从电负性角度分析其原因是
形成配离子,从电负性角度分析其原因是(4)已知
 (晶胞如图所示)晶胞的密度为
(晶胞如图所示)晶胞的密度为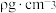 ,
, 的摩尔质量为
的摩尔质量为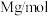 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在
,则在 晶体里
晶体里 和
和 的最短距离为
的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)四水合磷酸锌[Zn3(PO4)2·4H2O]难溶于水,是一种性能优良的绿色环保防锈颜料。Zn2+的价层电子排布式是_______ , 中的磷原子的杂化轨道类型是
中的磷原子的杂化轨道类型是_______ , 离子的立体构型是
离子的立体构型是_______ 。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)_______ I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,原因是_______ (用离子方程式表示)。
(4)锌锰干电池中Zn2+可吸收电池反应产生的NH3生成[Zn(NH3)4]2+,1个该离子中含有_______ 个σ键。
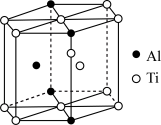
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为_______ ,其结构单元棱长为apm,底面边长为bpm,该合金的密度为_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)四水合磷酸锌[Zn3(PO4)2·4H2O]难溶于水,是一种性能优良的绿色环保防锈颜料。Zn2+的价层电子排布式是
 中的磷原子的杂化轨道类型是
中的磷原子的杂化轨道类型是 离子的立体构型是
离子的立体构型是(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)
(3)新制的Cu(OH)2能够溶解于浓氨水中,原因是
(4)锌锰干电池中Zn2+可吸收电池反应产生的NH3生成[Zn(NH3)4]2+,1个该离子中含有
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为

您最近一年使用:0次
【推荐2】丙烯是三大合成材料的基本原料之一。可以用丙烷直接脱氢、丙烷氧化脱氢和电解法制丙烯。已知下列反应的热化学方程式:
直接脱氢ⅰ: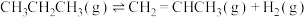
 kJ⋅mol
kJ⋅mol
氧化脱氢ⅱ: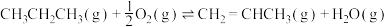
ⅲ:
 kJ⋅mol
kJ⋅mol
(1)
______ kJ⋅mol 。
。
(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率x与平衡常数 的关系可表示为:
的关系可表示为: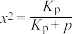 ,式中p为系统总压。p分别为a MPa和b MPa时(
,式中p为系统总压。p分别为a MPa和b MPa时( ),丙烯平衡产率与温度的关系如图1所示。
),丙烯平衡产率与温度的关系如图1所示。______ (填“Ⅰ”或“Ⅱ”), ℃时,
℃时,
______ MPa。
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是____________ 。
③立方ZnO的晶胞如下图2所示,则该晶体中 的配位数为
的配位数为______ ;晶胞参数为cpm, 与
与 间的最小距离为
间的最小距离为______ pm。
(3)以惰性材料作电极,电解法制取丙烯的原理如图3所示。______ 极(填“阳”或“阴”)。
②若电解生成1mol丙烯,理论上阳极区溶液减少的质量为______ g。
直接脱氢ⅰ:
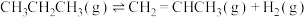
 kJ⋅mol
kJ⋅mol
氧化脱氢ⅱ:
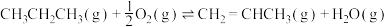
ⅲ:

 kJ⋅mol
kJ⋅mol
(1)

 。
。(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率x与平衡常数
 的关系可表示为:
的关系可表示为: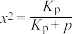 ,式中p为系统总压。p分别为a MPa和b MPa时(
,式中p为系统总压。p分别为a MPa和b MPa时( ),丙烯平衡产率与温度的关系如图1所示。
),丙烯平衡产率与温度的关系如图1所示。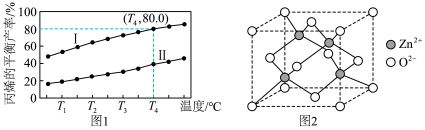
 ℃时,
℃时,
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是
③立方ZnO的晶胞如下图2所示,则该晶体中
 的配位数为
的配位数为 与
与 间的最小距离为
间的最小距离为(3)以惰性材料作电极,电解法制取丙烯的原理如图3所示。
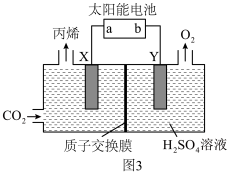
②若电解生成1mol丙烯,理论上阳极区溶液减少的质量为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】Ⅰ. 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用 和
和 在某
在某 催化剂存在下生产
催化剂存在下生产 ,
, 与
与 在一定条件下制得储氢物质
在一定条件下制得储氢物质 。回答问题:
。回答问题:
(1) 在周期表中的位置
在周期表中的位置_______ 。基态 的价层电子排布式
的价层电子排布式_______ 。
(2) 电子式
电子式_______ 。
(3) 可以与水以任意比例互溶的,除它们都是极性分子外还因为
可以与水以任意比例互溶的,除它们都是极性分子外还因为_______ 。
(4) 的空间构型为
的空间构型为_______ ,杂化轨道类型为_______ 。
(5)基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为_______ 。
Ⅱ. 立方氮化硼的晶胞结构与金刚石结构相似(如图所示),是超硬材料。
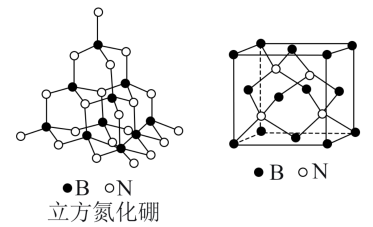
(6)晶胞中每个硼原子周围与其最近且等距离的硼原子有_______ 个。
(7)氮原子的配位数为_______ 。
(8)已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为_______  (只列出计算式)。
(只列出计算式)。
 和
和 在某
在某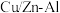 催化剂存在下生产
催化剂存在下生产 ,
, 与
与 在一定条件下制得储氢物质
在一定条件下制得储氢物质 。回答问题:
。回答问题:(1)
 在周期表中的位置
在周期表中的位置 的价层电子排布式
的价层电子排布式(2)
 电子式
电子式(3)
 可以与水以任意比例互溶的,除它们都是极性分子外还因为
可以与水以任意比例互溶的,除它们都是极性分子外还因为(4)
 的空间构型为
的空间构型为(5)基态
 与
与 中未成对的电子数之比为
中未成对的电子数之比为Ⅱ. 立方氮化硼的晶胞结构与金刚石结构相似(如图所示),是超硬材料。

(6)晶胞中每个硼原子周围与其最近且等距离的硼原子有
(7)氮原子的配位数为
(8)已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为
 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次



